环介导恒温扩增快速检测植物油中 掺假地沟油方法的建立
赵彩红,蔡 勇,曹 忻,杨具田,伍欣然,臧荣鑫,*,徐红伟,*
(1.西北民族大学生命科学与工程学院,甘肃兰州 730030;2.西北民族大学实验中心,甘肃兰州 730030)
近年来,诸多不法企业将动物油脂或者地沟油按比例勾兑成食用植物油,从中谋取暴利。地沟油主要是由各种潲水、用于油炸食品的油、劣质动物肉、内脏、毛皮等加工及提炼后产出的油炼制而成。其色泽、气味、滋味等感官指标,以及酸价和过氧化值等理化指标接近或完全符合国家《食用植物油卫生标准》(GB2716-2005),掺混后与正常食用植物油难以区分[1]。植物油中掺假地沟油,使得大量地沟油重回餐桌,危害人们的健康。因此,建立一种快速、高效、准确、适应性强的现场检测方法具有重要的意义。
2011年中华人民共和国卫生部组织全国相关领域的专家、学者和技术人员开展了大规模的地沟油检测技术的联合攻关研究,先后征集和验证的地沟油检测方法达到300多种,包含光谱法、色谱法、核磁共振及电子鼻、电子舌等气滋味谱方法。2012年初步确定了4个检测方法以及3个筛查方法,其中含三种辣椒碱残留量的液相色谱-质谱法[2-4]、特征奇数碳脂肪酸的多维气相色谱-质谱法[5]、高场核磁共振法[6-8]等。但是由于地沟油来源及成分的复杂性和精炼工艺的差异性,迄今为止未得出任何公认的鉴别检测方法,而筛选出的7种方法还需进一步验证和完善,确定其有效性和准确性。地沟油在收集过程中会不可避免地混入动物源性成分,因此,新发展起来的分子生物学技术检测地沟油的方法值得深究。
目前,分子生物学方法包括普通PCR法[9],单一荧光PCR法[10],多重荧光PCR法及实时荧光PCR[11-12]等。杨冬燕等利用多重实时荧光PCR法鉴别牛肉[13]、羊肉[14]的掺假,候东军等[15]也利用三重荧光PCR技术鉴定食品中的牛、猪、鸭源性成分,王立平等[16]利用PCR法检测食用植物油中动物源性成分,黄治国等[17]应用PCR技术检测食用油中鸡和牛源成分,探讨了PCR技术在食用油中检测动物源性成分的可行性。由 Notomi等[18]人发明的环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)克服了PCR技术的某些不足,针对靶基因的6个特异区域,设计4条特异性引物,具有特异灵敏、简单易学等特征,尤其适合一些场所的快速检测。谭贵良等[1]根据GenBank 数据库中猪、牛、鸡、鸭的线粒体基因序列设计了四组引物,首次采用LAMP方法对食用植物油和地沟油中的动物源性成分进行了检测,但此方法需通过四次扩增反应,才仅能检测四种动物源性DNA,不利于现场快速检测。本研究依据脊椎动物线粒体基因组中的超级保守DNA序列[19]为靶标,以植物油中不应该存在动物源性成分为鉴定依据,以期建立一种能一次反应同时特异性扩增出牛、羊、猪和鸡等所有脊椎动物源性DNA的现场快速检测LAMP技术,为油脂的掺假鉴伪提供科学依据。
1 材料与方法
1.1 材料与仪器
牛油、羊油、猪油以及鸡油 自制,从本地市场分别采购牛板油、羊板油、猪板油以及鸡板油,切成约1 cm3熬制1 h左右,弃油渣,将油储于陶瓷容器中,待冷却凝固后室温放置备用;阳性对照(猪质粒) 根据陈正芳[20]方法制备;大豆油、花生油、玉米油、橄榄油和两种不同品牌的植物调和油 购自本地超市;Bst DNA聚合酶、甜菜碱、dNTP、荧光染料SYBR Green I、SDS、Tris、NaCl、Na2EDTA、巯基乙醇、TE缓冲液等 购自宝生物工程(大连)有限公司。
超速低温离心机 湘仪离心机仪器有限公司;超纯水系统 购自德国;FTC-3000+实时荧光PCR仪 产自加拿大Funglyn Biotech。
1.2 实验方法
1.2.1 LAMP引物设计 涂四利等[19]在比较所有细菌、古细菌及所有线粒体全基因组数据后,发现仅在脊椎动物的线粒体基因组有4段独有的最长或次长的22~30 bp的超级保守子序列,经BLAST在线比对进行分析,这4段保守子序列集中在一段259 bp的保守序列中。本研究根据这段259 bp的保守序列为目标序列,利用引物设计网站http://primerexplorer.jp/e/v4_manual/index.heml设计了两对特异性引物,即两条外引物(F3、B3)和两条内引物(FIP、BIP)。引物由宝生物工程(大连)有限公司合成,PAGE纯化。引物序列见表1。

表1 LAMP反应引物 Table 1 Primer used in LAMP
1.2.2 基因组DNA的提取 采用SDS碱裂解法[21]提取植物油以及65 ℃水浴成液态后的动物油脂的总DNA。在2 mL离心管中加入400 μL TE(Tris-HCl)缓冲液,然后加入食用油1 mL,漩涡振荡混匀约5 min,室温下13000 r/min离心5 min,小心去除上层油脂,留下层水相,在同一支EP管中再次加入食用油1 mL,涡旋振荡混匀,离心共重复20次后,转移水相至另一新的EP管中,加入100 μL 20% SDS 混匀,65 ℃水浴10 min,期间颠倒数次。加入200 μL 3 mol/L NaAc,混匀,置于冰上20~30 min后,4 ℃、13000 r/min 离心10 min,取上清液至一新的EP管中,再加入等体积的Tris苯酚∶氯仿∶异戊醇(25∶24∶1)混匀,静置10 min,离心。取上清液至一新的EP管中,加0.7倍体积的异丙醇,颠倒混匀后于-20 ℃冰箱静置过夜沉淀DNA,再4 ℃ 13000 r/min离心10 min,去除上清液,用70%乙醇洗涤沉淀,反复2次,自然晾干,加50 μL TE溶解,-20 ℃保存。
1.2.3 LAMP反应及反应体系的优化 LAMP反应体系(25 μL)含有1.2~2.4 μmol/L FIP、1.2~2.4 μmol/L BIP、0.2 μmol/L F3、0.2 μmol/L B3、0.8~1.6 mol/L 甜菜碱、4~10 mmol/L MgSO4、1.6 mmol/L dNTP、2.5 μL 10×Thermo pol Buffer、8 U BstDNA聚合酶及2 μL DNA模板。反应条件为65 ℃,扩增1 h。以双蒸水作为阴性对照。
LAMP扩增产物采用恒温实时荧光法检测以及加入SYBR Green I荧光染料,肉眼观察反应结果。方法一:反应体系配制完成后加入0.2 mL的离心管,在体系中加入0.2 μmol/L的SYBR Green I荧光染料,并加入50 μL的稳定液以避免反应体系的挥发和污染。通过实时荧光PCR仪设定 Holding Stage为 65 ℃ 30 s,1 个循环;Cycling Stage为 65 ℃ 15 s,65 ℃ 45 s,60个循环,于65 ℃ 45 s处收集荧光信号,荧光通道为FAM。
方法二:反应体系配制完成后加入0.2 mL的HF管的大隔室,再加入50 μL的稳定液,最后向小隔室加入1~2 μL的100×SYBR Green I显色液进行扩增。通过实时荧光PCR仪设定Holding Stage为65 ℃ 30 s,1个循环;Cycling Stage为65 ℃ 15 s,65 ℃ 45 s,60个循环,当反应程序结束后,将HF反应管倒置甩动2次,在正置甩动2次,使工作液与显色液充分混合,冷却至室温后,肉眼观察,颜色变绿表明发生了扩增,橙色表明未发生扩增。
1.2.4 LAMP特异性实验 采用优化好的LAMP方法对牛油、羊油、猪油、鸡油及六种植物油样品DNA进行LAMP扩增,以验证特异性引物对牛、羊、猪和鸡源性成分检测的特异性,设置程序,65 ℃ 1 h,扩增产物采用实时荧光法,加入SYBR Green I荧光染料进行观察。
1.2.5 LAMP灵敏性实验 分别提取牛油、羊油、猪油和大豆油中的总DNA,测定DNA浓度,将牛油、羊油、猪油用大豆油梯度稀释至含0.10、0.01、0.001 ng/μL三个浓度梯度的样品作为DNA模板。采用优化好的LAMP方法对牛油、羊油、猪油三种混合样品的三个稀释梯度进行LAMP扩增,设置1.2.3中方法二的程序,65 ℃ 1 h,扩增产物加入SYBR Green I荧光染料进行观察。当反应程序结束后,将HF反应管倒置甩动2次,在正置甩动2次,使工作液与显色液充分混合,冷却至室温后,肉眼观察,颜色变绿表明发生了扩增,橙色表明未发生扩增。
1.2.6 LAMP稳定性实验 采用优化好的LAMP方法,将牛、羊、猪和鸡四种不同DNA浓度的油脂,每个样品设置4管平行,同时设置1管阴性对照和大豆油、花生油以及玉米油三种植物油对照,进行LAMP扩增,设置1.2.3中方法二的程序,65 ℃ 1 h,扩增产物是加入SYBR Green I荧光染料进行观察。当反应程序结束后,将HF反应管倒置甩动2次,在正置甩动2次,使工作液与显色液充分混合,冷却至室温后,肉眼观察,颜色变绿表明发生了扩增,橙色表明未发生扩增。
2 结果与分析
2.1 基因组DNA提取结果
本研究采用SDS碱裂解法提取植物油和动物油脂中的总DNA,获得牛、羊、猪和鸡四个物种DNA模板的纯度260/280比值在1.8~2.0之间,浓度在16.0~30.0 ng/μL。大豆油、花生油、玉米油、橄榄油和2种植物调和油的DNA模板纯度260/280比值在1.8~2.0之间,浓度在2.0~10.0 ng/μL之间。样品DNA的浓度及纯度适合后续的扩增反应,且符合后续扩增曲线的结果。
2.2 LAMP反应体系优化结果
本研究通过预实验,选定羊DNA作为标准体系,测定DNA浓度,并梯度稀释至0.10、0.01、0.001 ng/μL三个浓度梯度作为优化标准,对甜菜碱、Bst DNA聚合酶等参数进行了优化。经过一系列的优化实验后,最终确定LAMP(25 μL)反应体系为:1.6 μmol/L内引物(FIP和BIP),0.2 μmol/L外引物(F3和B3),6 mmol/L MgS04,1.6 mmol/L dNTP,10×Thermo pol Buffer,8 U BstDNA聚合酶,在65 ℃条件下扩增1 h。在该反应体系下,羊DNA的扩增结果见图1。

图1 实时荧光LAMP优化结果Fig.1 Real-time fluorescence LAMP reaction under the optimized condition注:1:阳性对照(猪质粒);2:羊DNA模板浓度0.1 ng/μL;3:羊DNA模板浓度0.01 ng/μL;4:羊DNA模板浓度0.001 ng/μL;5:阴性对照(双蒸水)。
2.3 LAMP特异性检测实验
本研究选取生活中常用的大豆油、花生油等六种植物油以及常见的牛、羊、猪和鸡四种动物油脂作为研究对象。实时荧光扩增曲线和LAMP染色法结果见图2。LAMP扩增产物的实时荧光曲线图表明,该法仅对牛油、羊油、猪油、鸡油这四种样品油脂发生了特异性扩增,其他油脂和阴性对照均未起峰。扩增产物的LAMP肉眼观察法结果与实时荧光LAMP法相一致,均是牛油、羊油、猪油和鸡油为阳性,其余油脂以及阴性对照为正常阴性。这表明上述LAMP引物在DNA模板纯度合适的情况下,对油脂中动物源性成分检测具有很好的特异性。
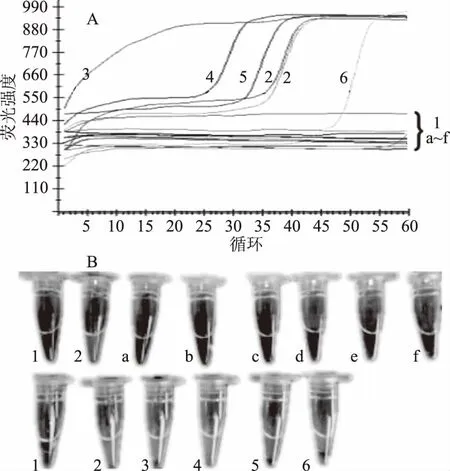
图2 LAMP特异性检测结果Fig.2 Specificity detection by LAMP注:1:阴性对照(双蒸水);2:阳性对照(猪质粒);3:牛油DNA;4:猪油DNA;5:鸡油DNA;6:羊油DNA;a:大豆油;b:花生油;c:玉米油;d:橄榄油;e:植物调和油1;f:植物调和油2。
2.4 LAMP灵敏度检测结果
采用荧光染色法对结果进行判定,其扩增结果见图3。结果显示,牛油、羊油及猪油三种动物油脂DNA样品与大豆油DNA混合后,被稀释成0.01 ng/μL时能检测出动物源性,但当稀释成0.001 ng/μL后HF管内呈现橙色,即未发生扩增。由此表明,LAMP方法可以检测出大豆油中含有0.01 ng/μL的动物源性成分,即植物油中掺入动物油脂的最低检出限度是0.01 ng/μL。当扩增产物的浓度低时,肉眼观察结果易产生误差[22]。根据专利[21]报道,采用LAMP技术鉴别地沟油时,当LAMP检测结果为阳性时,该待检样品为地沟油。当LAMP检测结果为阴性时,且待检测样品DNA的浓度偏差小于同等条件下市售标准油脂样品处理后的浓度的1%时,则应判断样品为地沟油。

图3 LAMP灵敏度检测结果Fig.3 Sensitivity detectionby LAMP注:N:阴性对照(双蒸水);A-1:混合样品含猪油DNA浓度0.001 ng/μL;A-2:混合样品含猪油DNA浓度0.01 ng/μL;A-3:混合样品含猪油DNA浓度0.1 ng/μL;B-1:混合样品含牛油DNA浓度0.001 ng/μL;B-2:混合样品含牛油DNA浓度0.01 ng/μL;B-3:混合样品含牛油DNA浓度0.1 ng/μL;C-1:混合样品含羊油DNA浓度0.001 ng/μL;C-2:混合样品含羊油DNA浓度0.01 ng/μL;C-3:混合样品含羊油DNA浓度0.1 ng/μL。
2.5 LAMP稳定性检测结果
由于地沟油成分的复杂性,单一指标难以涵盖所有种类的地沟油,且检测指标易受精炼程度和人为勾兑的影响。因此,在研究地沟油检测指标特点的同时,还需对其稳定性进行评价。其扩增结果见图4,结果表明,牛、羊、猪和鸡四种不同DNA浓度的油脂均发生扩增,阴性对照和大豆油、花生油以及玉米油均未发生扩增,说明LAMP扩增技术具有很好的稳定性,适合做快速检测,同时他对仪器设备的要求不高,表明在现场检测中有很高的适应性。

图4 LAMP稳定性检测结果Fig.4 Stability detection by LAMP注:N:阴性对照(双蒸水);1:大豆油;2:花生油;3:玉米油;A:鸡油DNA;B:猪油DNA;C:牛油DNA;D:羊油DNA。
3 讨论与结论
地沟油的来源多样、加工工艺不同,有的地沟油经过高温、粉碎、搅拌等生产处理,细胞核基因组往往被破坏,石亚新[23]以鸡油和猪油为代表的动物油脂进行脱胶、脱色、脱臭处理,模拟油脂精炼工艺,研究其 DNA 信息衰减变化。实验结果表明,鸡油精炼处理后 DNA 含量下降了9.5%,猪油下降了11%,因此证实了油脂精炼工艺会对动物基因信息造成部分损失。杨冬燕等[24]以动物源性HOXC6基因为特异性检测指标,采用实时荧光PCR法检测食用油中掺假地沟油时发现,随着地沟油含量的降低其检测准确率也随之降低。因此,在检测地沟油时,检测靶标DNA是分子生物学技术能否成功检验地沟油的关键因素。线粒体DNA具有稳定性好、分子量小、拷贝数多等特点,在地沟油的反复精炼过程中,具有更高的灵敏度和稳定性,可作为动物性外源成分鉴定和物种分类等技术的理想靶基因[25]。
LAMP技术的发展十分迅速,已成功的应用于致病菌[26-28]、转基因成分[29-31]的检测等方面,而且其灵敏度高,检测极限能达到10拷贝[32-33]。本研究建立的LAMP法检测植物油中掺假地沟油,在1.6 μmol/L内引物(FIP和BIP),0.2 μmol/L外引物(F3和B3),6 mmol/L MgS04,1.6 mmol/L dNTP,10×Thermo pol Buffer,8 U Bst DNA聚合酶,扩增温度为65 ℃,扩增时间为1 h的优化条件下,能检出模拟地沟油样品中0.01 ng/μL的动物源性DNA成分。但因地沟油样品来源的限制,下一步还需扩大样品量,以提高实验检测方法的适用性。
本研究以植物油中不应该存在动物源性成分为鉴定依据,以动物线粒体DNA为检测靶标,针对靶基因的六个区域,设计了两对特异性引物,建立了利用LAMP法检测食用植物油和地沟油中动物源性成分的新方法。该方法不需要特殊试剂与设备,检测成本低,且重复性好、稳定性高,能够特异性扩增出牛、羊、猪和鸡等脊椎动物的动物源性基因。为油脂鉴伪和地沟油的鉴别提供一种稳定、高效、适应性强的现场快速检测技术。
[1]谭贵良,刘垚,李向丽,等. 食用植物油和地沟油中动物源性成分LAMP检测方法的建立[J]. 现代食品科技,2015,31(12):244-248.
[2]王龙星,金静,王淑秋,等. 非正常食用油鉴别新方法(一):三种辣椒碱残留量的液相色谱-质谱分析[J]. 色谱,2012,30(11):1094-1099.
[3]吴春英,魏薇.UPLC-MS/MS法同时测定地沟油中特征组分[J].食品工业,2016,37(12):283-286.
[4]Zhang Z,Ren F,Zhang P,et al. Determination of capsaicinoids and eugenol in waste-edible-oil by liquid-liquid extraction and liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2012,30(11):1108-1112.
[5]金静,王龙星,陈吉平,等. 非正常食用油鉴别新方法(二):特征奇数碳脂肪酸的多维气相色谱-质谱检测[J]. 色谱,2012,30(11):1100-1107.
[6]黄慧英,胡友恒,杨朝,等. 一种地沟油的检测方法:中国,201210220692.1[P]. 2012-10-03.
[7]Mannina L,Imperio M D,Capitani D,et al. 1H NMR-based protocol for the detection of adulterations of refined olive oil with refined hazelnut oil[J]. J Agric Food Chem,2009,57(24):11550-11556.
[8]蔡波太,袁龙飞,周影,等. 基于1H NMR指纹图谱结合多变量分析的地沟油检测方法[J]. 中国科学:化学,2013,43(5):558-567.
[9]王立平,刘晓莉,曹悦,等.PCR 法检测食用植物油中动物源性成分[J].粮油食品科技,2013,21(4):95-98.
[10]杨永存,杨冬燕,李浩,等.实时荧光PCR检测动物源性基因鉴定地沟油[J].中国卫生检验杂志,2013,23(18):3514-3517.
[11]阿扎提·伊明霍加,杨开伦.新疆反刍动物饲料和动物源性饲料中牛羊源成分检测[J].新疆畜牧业,2012(10):30-33.
[12]王建昌,王金凤,陈瑞春,等.鸭肉冒充牛羊肉的分子生物学检测[J].肉类研究,2012,26(6):20-23.
[13]杨冬燕,韦梅霞,杨永存,等. 多重荧光PCR鉴别羊肉掺假[J]. 食品安全质量检测学报,2015(2):555-562.
[14]杨冬燕,杨小柯,李浩,等. 用多重荧光PCR技术鉴别牛肉中掺入的猪马鸭成分的研究[J]. 中国预防医学杂志,2015,16(7):528-533.
[15]侯东军,韩合敬,郝智慧,等.三重荧光PCR法鉴定食品中牛、猪、鸭3种动物源性成分[J].畜牧与兽医,2016,48(4):45-48.
[16]王立平,刘晓莉,曹悦,等. PCR法检测食用植物油中动物源性成分[J]. 食品工业,2013,21(9):214-217.
[17]黄治国,赵斌,冯治平,等. 应用PCR技术检测食用油中
鸡和牛源成分[J]. 粮油食品科技,2014,22(3):89-91.
[18]Notomi T,Okayama H,Masubuchi H,et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research,2000,28(12):63-69.
[19]涂四利,方伟武.脊椎动物线粒体全基因组中的超级保守序列与进化[J].科学通报,2006,51(4):427-430.
[20]陈正芳,曾萍,杨具田,等. 动物源性食品中猪源性成分检测[J].中国农学通报,2015,31(36):259-264.
[21]徐红伟,臧荣鑫.一种用于地沟油检测的试剂盒及其检测方法:中国,104328193[P].2016-08-24.
[22]Maeda H,Kokeguchi S,Fujimoto C,et al. Detection of periodontal pathogen Porphyromonas gingivalis by loop-mediated isothermal amplification method[J]. FEMS Immunology Medical Microbiology,2005,43(2):233-239.
[23]石亚新.基于动物源基因分析的地沟油检测技术研究[D].杨凌:西北农林科技大学,2016:1-41.
[24]杨冬燕,李浩,杨永存,等.荧光PCR扩增动物源性HOXC6基因鉴别老火油[J].中国医学装备,2014,12(11):153-155.
[25]Sevilla RG,Diez A,Norén M,et al. Primers and polymerase chain reaction conditions for DNA barcoding teleost fish based on the mitochondrial cytochrome b and nuclear rhodopsin genes[J]. Mol Ecol Notes,2007,7(5):730-734.
[26]谷晓红,谭晴晴,刘艳艳,等. 利用环介导等温扩增技术快速检测饮用水中的大肠杆菌[J]. 山东农业科学,2017(1):130-135.
[27]Ibrahim Abbasi,Oscar D Kirstein,Asrat Hailu,et al. Optimization of loop-mediated isothermal amplification(LAMP)assays for the detection of Leishmania DNA in human blood samples[J]. Acta Tropica,2016,162:20-24.
[28]顾思宇,张红星,金君华,等. LAMP法检测单核细胞增生性李斯特菌的研究[J]. 食品科技,2016(8):297-301.
[29]李向丽,谭贵良,刘垚,等. 实时LAMP法快速检测食用植物油中的转基因成分CaMV-35S[J]. 现代食品科技,2014(2):244-248.
[30]周杰,黄文胜,邓婷婷,等. 环介导等温扩增法检测6种转基因大豆[J]. 农业生物技术学报,2017(2):335-344.
[31]Chen LL,Guo JC,Wang QD,et al. Development of thevisual Loop-Mediated Isothermal amplification assays forseven genetically modified maize events and their applicationin practical samples analysis[J]. J Agric Food Chem,2011,59:5914-5918.
[32]Zhang SQ,Tan B,Li P,et al. Comparison of conventional RT-PCR,reverse-transcription loop-mediated isothermal amplification,and SYBR green I-based real-time RT-PCR in the rapid detection of bovine viral diarrhea virus nucleotide in contaminated commercial bovine sera batches[J].J Virol Methods,2014(207):204-209.
[33]Jung JH,Oh SJ,Kim,YT,et al. Combination of multiplex reverse-transcription loop-mediated isothermal amplification with an immunochromatographic strip for subtyping influenza A virus[J].Analytica Chimica Acta,2015(853):541-547.

