响应面法优化新疆芜菁多糖 提取工艺及体外抗氧化活性研究
王 伟,杨晓君,高 蕾,戴小华,陈 恺
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
近年来,研究表明植物源多糖是一类非常重要的生物活性物质,在经济领域与临床应用上逐渐引起越来越多的关注[1]。芜菁(BrassicarapaL.),属于十字花科(Cruciferae)芸苔属(Brassica)草本植物,被维吾尔族用来治疗咳嗽和支气管哮喘[2]。据报道,芸苔属植物含有芥子油甙、花青素、多糖、萜烯及香豆素类等生物活性物质,这些生物活性物质与阻止氧化应急、免疫调节、减少癌症发生率等功效有关[3]。
Xie等[4]研究表明中国青海省及西藏自治区的芜菁多糖具有抗缺氧的功效;Jafarian-Dehkordi等[5]发现不同有机溶剂的芜菁提取液均对小鼠具有免疫调节作用。但目前对新疆芜菁多糖生物活性的研究还未见报道。因此,本论文主要对新疆芜菁多糖的提取工艺进行优化,并利用DPPH自由基清除能力和还原力评价其体外抗氧化能力,为今后新疆芜菁的开发利用奠定一定的理论基础。
1 材料与方法
1.1 材料与仪器
新疆芜菁 新疆乌鲁木齐市农贸市场;DPPH、VC美国Sigma公司;苯酚、浓硫酸、乙醇、乙醚、丙酮、氯化铁及三氯乙酸等均为国产分析纯。
HH-6数显恒温水浴锅 常州普天仪器制造公司;TDZ5-WS台式离心机 长沙湘智离心机仪器有限公司;DHG-9140A恒温鼓风干燥箱 上海一恒科技有限公司;AY-120电子天平 日本SHIMADZU公司;SF180粉碎机 上海制药仪器公司;OSB-2100真空旋转蒸发仪 日本EYELA公司。
1.2 实验方法
1.2.1 芜菁多糖(BRP)的提取工艺 原料预处理:将新疆芜菁洗净、切片,30 ℃烘干,粉碎后过60目筛,然后用80%乙醇浸提24 h,反复2~3次,料渣于30 ℃烘干,置于干燥皿中备用。
在一定料液比、温度、时间和提取次数下进行热水浸提,浸提液抽滤取上清,50 ℃旋蒸浓缩至1/8原体积,向浓缩液加3倍体积无水乙醇后置于4 ℃冰箱过夜,3000 r/min 离心10 min取沉淀,依次用乙醚、无水乙醇和丙酮洗涤沉淀,20 ℃烘干至恒重,得到的即为芜菁多糖,多糖得率按下式计算:

式中:W1为多糖质量,g;W0为预处理后干燥芜菁粉末质量,g。
1.2.2 单因素实验设计 液料比分别设置为40、50、60、70和80 mL/g,其它提取条件分别为提取温度90 ℃,提取时间2 h,提取次数1次;提取温度分别设置为80、85、90、95和100 ℃,其它提取条件分别为提取时间2 h,液料比70 mL/g,提取次数1次;提取时间分别设置为1、2、3、4和5 h,其它提取条件分别为提取温度95 ℃,液料比70 mL/g,提取次数1次;提取次数分别设置为1、2、3、4和5,其它提取条件分别为提取温度95 ℃,液料比70 mL/g,提取时间4 h。
1.2.3 响应面法(RSM)优化提取工艺 根据单因素实验结果,选取提取温度(X1)、液料比(X2)及提取时间(X3)三个实验因子,在适宜范围内,采用响应面法(RSM)的Box-Behnken design(BBD)优化新疆芜菁多糖的提取工艺,因素水平见表1。
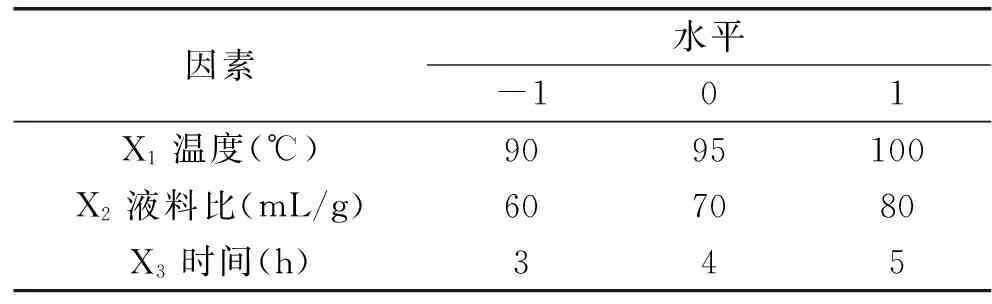
表1 Box-Behnken设计各因素的编码及实验水平Table 1 Code and level of factors chosen for Box-Behnken design
1.2.4 新疆芜菁多糖的体外抗氧化活性研究
1.2.4.1 DPPH自由基清除能力的测定 DPPH自由基清除活性的测定参照报道的方法并稍作修改[6]:依次移取浓度为0.25、0.5、0.75、1.0、2.0、3.0及4.0 mg/mL的多糖溶液1.0 mL,分别加入0.4 mmol/L DPPH溶液0.5 mL,加水2.0 mL,混匀,30 ℃暗处反应30 min,于517 nm处测定吸光值。VC作为阳性对照,利用下式计算DPPH自由基清除活性:
式中:A0是对照的吸光值(即以水代替样品),A1是样品的吸光值,A2是样品自身干扰的吸光值(即以水替代DPPH溶液)。
1.2.4.2 还原能力的测定 参照师萱[7]的方法并稍作修改。在2.0 mL样品中加入0.2 mol/L磷酸盐缓冲液(pH=6.6)2.0 mL和K3Fe(CN)6溶液(1%,w/v)2.0 mL,混匀后50 ℃反应20 min,再加2.0 mL三氯乙酸(10%,w/v),0.5 mL氯化铁溶液(0.1%,w/v),测定700 nm吸光值。VC作为阳性对照,按下式计算还原力:
还原力=A1-A2
式中:A1是样品的吸光值,A2是样品干扰的吸光值(即以水代替氯化铁溶液)。
1.3 统计分析
所有数据均以平均值±标准差(Mean±SD)表示,使用SPSS 20.0统计软件的单因素方差分析(One-way ANOVA)和Tukey检验进行显著性分析,不同字母代表差异显著(p<0.05)。
2 结果与分析
2.1 液料比对新疆芜菁多糖得率的影响
液料比对新疆芜菁多糖得率的影响如图1所示。
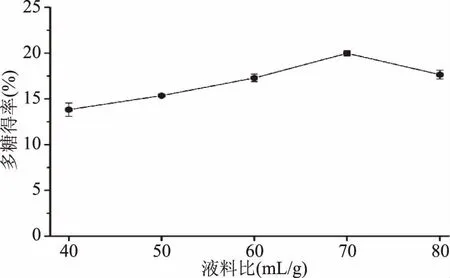
图1 液料比对新疆芜菁多糖得率的影响Fig.1 Effect of ratio of extraction solvent to raw material on the extraction yield of BRP
由图1可知:当液料比从40 mL/g增加到70 mL/g时,新疆芜菁多糖得率由13.82%增加(p<0.05)到19.97%;之后,随着液料比继续增加,新疆芜菁多糖得率开始下降(p<0.05)。这种现象可能是由于液料比过小会导致多糖溶解不完全,而液料比过大会导致后续醇沉等工艺劳动强度加大[8]。因此,为了避免提取溶剂和浓缩费用的浪费,液料比为70 mL/g被选择作为Box-Behnken design(BBD)实验的中心点。
2.2 提取温度对新疆芜菁多糖得率的影响
提取温度对新疆芜菁多糖得率的影响如图2所示。

图2 提取温度对新疆芜菁多糖得率的影响Fig.2 Effect of extraction temperature on the extraction yield of BRP
由图2可知,当提取温度从80 ℃增加到95 ℃时,新疆芜菁多糖得率由10.37%增加(p<0.05)到17.68%;之后,随着提取温度继续增加,新疆芜菁多糖得率基本保持不变。原因可能是随着提取温度的升高,样品溶液的粘度减小,溶剂可以更好的渗透到原料中,使溶剂溶解原料组分的能力提高[9];当温度升高至100 ℃时,溶剂蒸发量和多糖浓度的增大反而不利于多糖的提取[10]。因此,选择提取温度95 ℃作为Box-Behnken design(BBD)实验的中心点。
2.3 提取时间对新疆芜菁多糖得率的影响
提取时间对新疆芜菁多糖得率的影响如图3所示。

图3 提取时间对新疆芜菁多糖得率的影响Fig.3 Effect of extraction time on the extraction yield of BRP
由图3可知:当提取时间从1 h增加到4 h时,新疆芜菁多糖得率由12.26%增加(p<0.05)到20.02%;4 h之后,新疆芜菁多糖得率基本保持不变。这种现象可能是随着原料与提取溶剂接触时间的延长,原料组分不断从原料中扩散出来,但是当大部分的原料组分都通过扩散溶解到提取溶剂中后,继续延长提取时间,反而不利于多糖得率的提高[11]。因此,提取时间4 h被选择作为Box-Behnken design(BBD)实验的中心点。
2.4 提取次数对新疆芜菁多糖得率的影响
提取次数对新疆芜菁多糖得率的影响如图4所示。

图4 提取次数对新疆芜菁多糖得率的影响Fig.4 Effect of extraction times on the extraction yield of BRP
由图4可知:当提取次数从1次增加到3次时,新疆芜菁多糖得率由19.38%增加(p<0.05)到22.29%;之后,继续增加提取次数,新疆芜菁多糖得率基本保持不变。另外考虑到新疆芜菁多糖提取成本[12],选择提取次数为3次。
2.5 响应面法优化新疆芜菁多糖的提取工艺
根据单因素实验结果,分别选取液料比60~80 mL/g,提取温度90~100 ℃,提取时间3~5 h进行响应面法(RSM)的Box-Behnken design(BBD)实验对新疆芜菁多糖的提取工艺进行优化,实验结果见表2,新疆芜菁多糖得率从17.32%到23.28%不等,利用Design-Expert(Version 8.0.7)软件对实验结果进行多元回归分析,Y=7.1785X1+1.6985X2+9.6775X3+0.00305X1X2+0.0695X1X3-0.10275X2X3-0.03895X12-0.010388X22-1.06875X32-415.9375。式中,Y为新疆芜菁多糖得率的预测值;X1、X2、X3分别代表提取温度、液料比和提取时间的编码值。
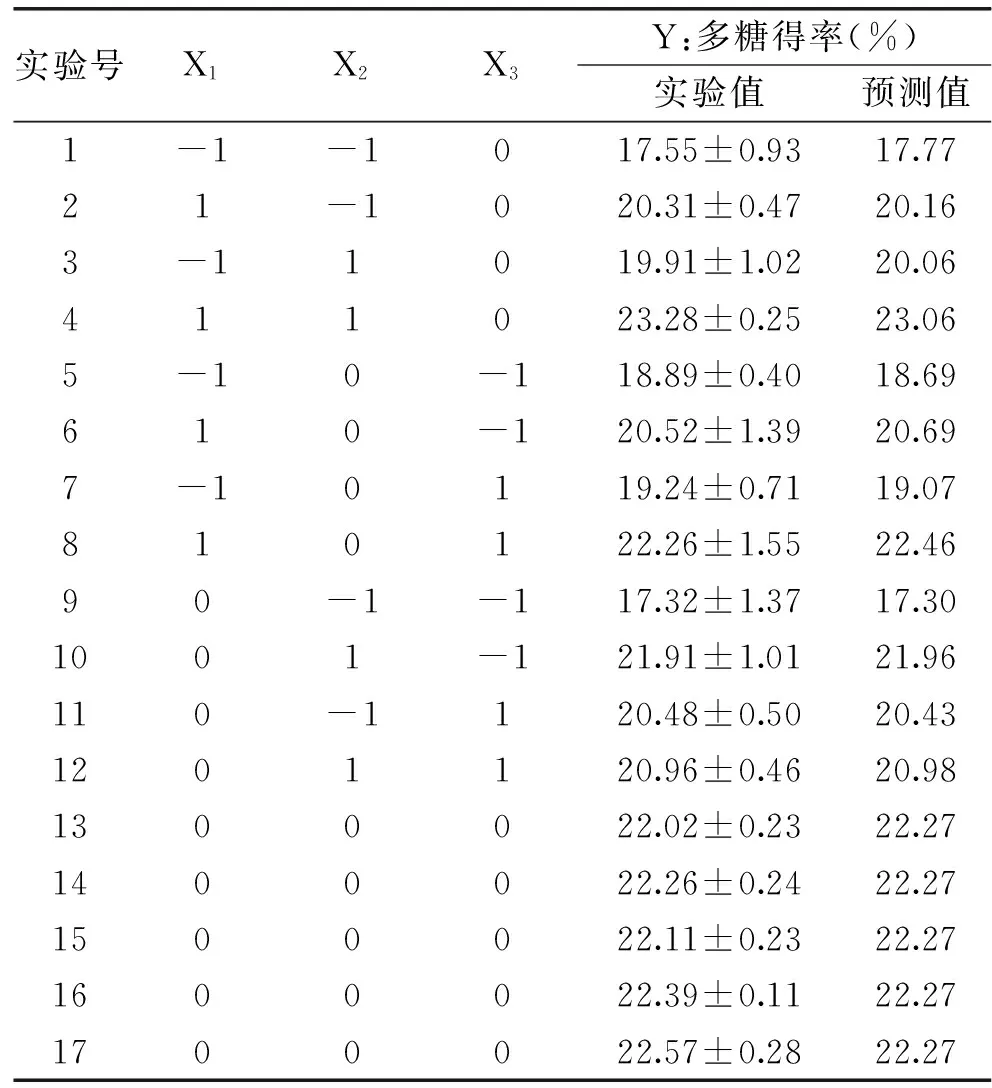
表2 新疆芜菁多糖的Box-Behnken实验设计及其响应值Table 2 Box-Behnken design and the response values for the yield of BRP


表3 多元回归模型方差分析Table 3 ANOVA for quadratic polynomial model
注:*差异显著(p<0.05),**差异较显著(p<0.01),***差异极显著(p<0.001)。

表4 响应面回归模型的方差分析Table 4 ANOVA for response surface quadratic model
注:*差异显著(p<0.05),**差异较显著(p<0.01),***差异极显著(p<0.001)。 从表4中可以看出,二次项系数(X12,X22及X32),线性系数(X1,X2及X3),实验因子交互系数(X1X3及X2X3)都存在显著差异(p<0.05),而其他实验因子交互系数(X1X2)不显著。
在各实验因素的取值范围内,利用Design-Expert(Version 8.0.7)软件预测最优的提取条件为:提取温度93.18 ℃,液料比75.11 mL/g,提取时间4.3 h,多糖得率的预测值为23.89%±0.34%。为了便于新疆芜菁多糖提取条件的实际操作,最优的提取条件修正为:提取温度93 ℃,液料比75 mL/g,提取时间4.3 h。在该最优提取条件下进行三次验证实验,测得的新疆芜菁多糖得率为23.72%±0.33%。
2.6 新疆芜菁多糖的体外抗氧化活性研究
2.6.1 DPPH自由基清除能力的测定 DPPH自由基能够接受一个氢原子变成稳定的DPPH·H分子[13],因此,DPPH自由基被广泛用于评价多糖的自由基清除能力。
由图5可知,新疆芜菁多糖的DPPH自由基清除能力具有量效依存关系,在该体系中的EC50值为8.55 mg/mL,多糖样品的活性明显低于VC(p<0.05),表明新疆芜菁多糖具有中等的DPPH自由基清除活性。

图5 新疆芜菁多糖的DPPH自由基清除活性Fig.5 Scavenging activity on DPPH radical of BRP
2.6.2 还原能力的测定 多糖还原力是其抗氧化活性的重要指标,研究表明还原力与样品的抗氧化活性紧密联系[14],机理主要为样品中的还原酮通过电子/氢原子给予能力,阻止自由基链形成,从而发挥抗氧化活性作用[15]。
由图6可知,新疆芜菁多糖的还原力具有量效依存关系,在该体系中的EC50值为2.25 mg/mL,表明新疆芜菁多糖具有较强的还原力,然而,其还原力明显低于VC(p<0.05)。

图6 新疆芜菁多糖的还原能力Fig.6 Reducing power of BRP
3 结论
本论文在单因素实验结果基础上,采用响应面法(RSM)对新疆芜菁多糖的提取工艺进行优化,并利用DPPH自由基清除能力和还原力评价其体外抗氧化能力。利用Design-Expert(Version 8.0.7)软件对实验结果进行多元回归分析,获得的新疆芜菁多糖二次多项回归方程为:Y=7.1785X1+1.6985X2+9.6775X3+0.00305X1X2+0.0695X1X3-0.10275X2X3-0.03895X12-0.010388X22-1.06875X32-415.9375;最优的新疆芜菁多糖提取条件为:提取温度93 ℃,液料比75 mL/g,提取时间4.3 h,提取次数3次,在该提取条件下进行验证,测得的新疆芜菁多糖得率为23.72%±0.33%。此外,体外抗氧化实验表明:新疆芜菁多糖的DPPH自由基清除能力和还原力具有量效依存关系,其在两种体系中的EC50值分别是8.55和2.25 mg/mL,表明新疆芜菁多糖具有较强的体外抗氧化能力,可以作为天然抗氧化剂应用于功能食品或者制药工业。
[1]HSD Santa,PRT Romao,V Sovrani,et al. Dietary polysaccharides and immune modulation[J]. Polysaccharides:Bioactivity and Biotechnology,2015:1991-2016.
[2]孙莲,马合木提,曾玲力,等.柱前衍生化HPLC测定新疆芜菁多糖中的单糖[J].华西药学杂志,2010,25(2):171-172.
[3]RM Kestwal,JC Lin,D Bagal-Kestwal,et al. Glucosinolates fortification of cruciferous sprouts by sulphur supplementation during cultivation to enhance anti-cancer activity[J]. Food Chemistry,2011,126(3):1164-1171.
[4]Y Xie,S Jiang,D Su,et al. Composition analysis and anti-hypoxia activity of polysaccharide fromBrassicarapaL.[J]. International Journal of Biological Macromolecules,2010,47(4):528-533.
[5]A Jafarian-Dehkordi,B Zolfaghari,M Mirdamadi. The effects of chloroform,ethyl acetate and methanolic extracts ofBrassicarapaL. on cell-mediated immune response in mice[J]. Research in Pharmaceutical Sciences,2013,8(3):159.
[6]谭莉,陈瑞战,常清泉,等.淫羊藿叶多糖工艺优化及抗氧化活性[J].食品科学,2017,38(2):255-263.
[7]师萱,程晓庆,杨勇,等.响应面优化银耳结缔多糖提取工艺与抗氧化活性研究[J].食品工业科技,2017,38(2):297-301.
[8]姜曼.微波辅助提取玫瑰花多糖的工艺研究[J].食品研究与开发,2017,38(1):33-36.
[9]V Samavati. Polysaccharide extraction fromAbelmoschusesculentus:Optimization by response surface methodology[J]. Carbohydrate Polymers,2013,95(1):588-597.
[10]W Li,SW Cui,Y Kakuda. Extraction,fractionation,structural and physical characterization of wheat-D-glucans[J]. Carbohydrate Polymers,2006,63(3):408-416.
[11]段晓梅,储维维,张烨.大理苍山野生蕨菜多糖的提取及抗氧化性研究[J].中国食品添加剂,2015(8):79-85.
[12]J Liu,XY Wen,XQ Zhang,et al. Extraction,characterization andinvitroantioxidant activity of polysaccharides from black soybean[J]. International Journal of Biological Macromolecules,2015,72:1182-1190.
[13]S Li,NP Shah. Antioxidant and antibacterial activities of sulphated polysaccharides fromPleurotuseryngiiandStreptococcusthermophilusASCC 1275[J]. Food Chemistry,2014,165:262-270.
[14]PD Duh,PC Du,GC Yen. Action of methanolic extract of mung bean hulls as inhibitors of lipid peroxidation and non-lipid oxidative damage[J]. Food and Chemical Toxicology,1999,37(11):1055-1061.
[15]T Zhao,Q Zhang,H Qi,et al. Degradation of porphyran fromPorphyrahaitanensisand the antioxidant activities of the degraded porphyrans with different molecular weight[J]. International Journal of Biological Macromolecules,2006,38(1):45-50.
一套《食品工业科技》在手, 纵观食品工业发展全貌

