双孢菇废弃菇柄多糖的 超声波提取及其体外抗氧化活性
李顺峰,赵蒙姣,王安建,田广瑞,刘丽娜
(1.河南省农业科学院农副产品加工研究中心,河南郑州 450002;2.河南农业大学食品科学技术学院,河南郑州 450002)
双孢蘑菇肉质肥嫩、风味鲜美,是典型的高蛋白低脂肪食材之一,深受消费者喜爱。近年来的研究表明,双孢蘑菇还具有抗氧化的功效,这与其含有的多糖等功能成分密不可分[1]。然而,这些研究都是基于整个蘑菇或者菇盖为原料的[1-3]。菇柄作为双孢蘑菇加工中的废弃物,约占其总产量的1/10~1/8,直接抛弃既污染环境又造成资源浪费[4-5],前期研究发现,双孢蘑菇的菇柄与菇盖的内容物含量差别不大[6-8]。
目前,已有研究者针对葡萄牙东北部地区盛产的4种野生食用蘑菇的菇盖和菇柄成分进行了比较,表明野生蘑菇菇盖的抗氧化能力要略高于菇柄,猜测主要归因于菇盖中有机酸含量较高[9]。然而,菇盖和菇柄中的多酚和生物碱等成分的含量也有差别[9-10]。因此,仅仅采用有机酸、多酚和生物碱的含量差别衡量其抗氧化能力的差异是不全面的[3,9-10]。近年来,多糖作为具有抗氧化活性的功能成分,其赋予蘑菇较高抗氧化活性的报道不断被发现[1-2,11-14]。为了提高蘑菇多糖的提取率,相继有热水提取[4,11-12]、酶法提取[15-16]、碱液提取[17]、微波辅助提取[18]等方法。已有研究者采用超声波辅助提取的技术获得了较高的双孢蘑菇多糖得率[1,19]。本文以双孢蘑菇加工中的废弃菇柄为原料,采用超声波提取菇柄中的多糖,并评价其抗氧化能力,为开发和提升双孢菇加工产业的附加值提供技术支持。
1 材料与方法
1.1 材料与仪器
双孢菇菇柄 洛阳奥达特食用菌技术开发有限公司;葡萄糖、浓硫酸、重蒸酚、无水乙醇、抗坏血酸(VC)、铁氰化钾、氯化铁等 分析纯;二苯代苦味酰基自由基(DPPH·) Sigma公司。
HN-1000Y超声波细胞粉碎机 上海汗诺仪器有限公司;GM-1.0A隔膜真空泵 天津市津腾实验设备有限公司;TDL-5A离心机 上海菲恰尔分析仪器有限公司;VORTEX-5振荡器 海门市其林贝尔仪器制造有限公司;RE-5003旋转蒸发仪 上海予华仪器设备有限公司;UV-1800紫外分光光度计 岛津仪器(苏州)有限公司;WT1000KF精密电子天平 常州万泰天平仪器有限公司;HH-S4数显恒温水浴锅 金坛市医疗仪器厂。
1.2 实验方法
1.2.1 菇柄多糖的提取 双孢菇菇柄经微波真空干燥(微波功率1000 W、温度60 ℃、真空度-98 kPa)后粉粹过40目筛,取菇柄粉5.0 g于烧杯中,以蒸馏水为浸提溶剂,经超声波提取后在4 ℃下沉淀多糖,经4000 r·min-1离心10 min后,所得沉淀即为菇柄多糖,将其用无水乙醇洗涤3次后用适量蒸馏水溶解,采用苯酚-硫酸法[20]测定多糖含量并计算多糖得率。

1.2.2 单因素实验设计 取菇柄粉5.0 g于烧杯中,液固比分别为10∶1、20∶1、30∶1、40∶1、50∶1 (mL·g-1),超声功率560 W,超声提取时间30 min下提取1次,2倍乙醇沉淀多糖;在液固比20∶1,超声功率分别为420、490、560、630、700、770 W,超声提取时间30 min下提取1次,2倍乙醇沉淀多糖;在液固比20∶1 (mL·g-1),超声功率630 W,超声提取时间分别为10、20、30、40、50、60、70 min下提取1次,2倍乙醇沉淀多糖;在液固比20∶1 (mL·g-1),超声功率630 W,超声提取时间50 min下提取1次,分别在乙醇用量为1、2、3、4、5倍提取液体积下沉淀多糖;在液固比20∶1,超声功率630 W,超声提取时间50 min下分别提取1、2、3次,4倍乙醇沉淀多糖,考察不同条件对菇柄多糖得率的影响。
1.2.3 正交实验 在单因素实验的基础上,选择对菇柄多糖得率影响较大的超声功率、超声提取时间、液固比进行L9(34)正交实验优化,以确定较佳的提取条件。正交实验因素和水平如表1所示。

表1 正交实验因素和水平表Table 1 Factors and levels of orthogonal test
1.2.4 菇柄多糖抗氧化活性评价 依据正交实验优化所得最佳提取条件制备菇柄多糖,并将其配制成不同浓度多糖溶液,采用羟自由基(·OH)清除率[14]、DPPH·清除能力和还原能力评价其抗氧化活性[9,21]。
1.3 数据处理
所有实验平行测定3次,实验结果用平均值±SE表示,采用SPSS 22.0软件进行ANOVA分析(显著性水平p<0.05),采用Origin 9.2软件作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 液固比对双孢菇菇柄多糖得率的影响 从图1可以看出,随着液固比的增加,菇柄多糖得率显著升高,并在液固比为20∶1 (mL·g-1)时多糖得率达到较高水平(3.49 g·100 g-1);当液固比超过20∶1 (mL·g-1)时,继续增大料液比,多糖得率升高趋于平缓,可能是由于反应体系中水越多,物料与超声波的接触机会就越多,有利于破壁,从而使糖分更易从细胞内释放出来[15]。在液固比为50∶1 (mL·g-1)时,其多糖得率(3.63 g·100 g-1)仅比液固比为20∶1 (mL·g-1)时提高了4个百分点,综合考虑后续浓缩成本,选择20∶1为较佳液固比。

图1 液固比对双孢菇菇柄多糖得率的影响Fig.1 Effect of ratio of liquid to solid on the yield of polysaccharides from A. bisporus stipe
2.1.2 超声功率对双孢菇菇柄多糖得率的影响 由图2可知,在实验范围内,随着超声功率的增大,双孢菇菇柄多糖得率迅速增加,并在超声功率为630 W时达到较高水平,此时多糖得率为3.55 g·100 g-1,此后继续增大超声功率,多糖得率增加趋于平缓,且与超声功率为630 W时无显著差异(p>0.05)。出现这一现象的原因可能是超声功率越大,其空化和机械剪切作用越强,分子扩散速度也越快,细胞壁破坏程度越大,得到内容物就越多[19]。综合考虑,选择超声功率为630 W作为后续实验的较佳条件。
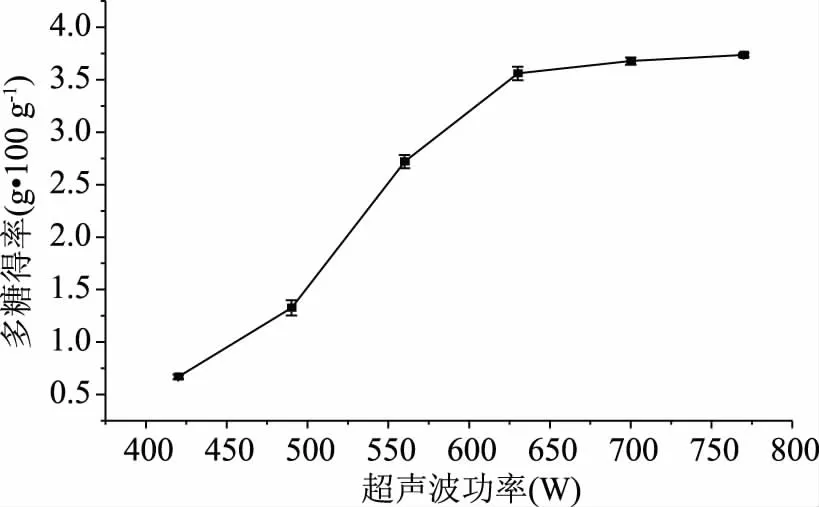
图2 超声功率对双孢菇菇柄多糖得率的影响Fig.2 Effect of ultrasonic power on the yield of polysaccharides from A. bisporus stipe
2.1.3 超声提取时间对双孢菇菇柄多糖得率的影响 在超声提取时间为10~50 min时,随着提取时间的延长,双孢菇菇柄多糖得率逐渐增大,并在提取时间为50 min时,双孢菇菇柄多糖得率达到最大值(3.89 g·100 g-1),此后继续延长提取时间,多糖得率又呈下降趋势(图3)。这可能是由于随着超声提取时间的延长,在50 min左右达到了平衡,而后继续延长超声提取时间,由于超声波的机械剪切作用导致部分多糖发生降解,从而使多糖得率下降[19]。为了提高双孢菇菇柄多糖得率,缩短提取时间,本实验选择超声提取时间50 min作为较佳时间。

图3 超声提取时间对双孢菇菇柄多糖得率的影响Fig.3 Effect of ultrasonic extraction time on the yield of polysaccharides from A. bisporus stipe
2.1.4 醇析乙醇用量对双孢菇菇柄多糖得率的影响 当乙醇体积1~4倍于多糖提取液时,随着乙醇体积的增大,双孢菇菇柄多糖得率逐渐增大;并在4倍体积时,多糖得率达到最大(4.35 g·100 g-1),继续增大乙醇用量至5倍体积时,多糖得率略有下降(图4),这可能是由于在乙醇用量为4倍体积时大部分的多糖已沉淀析出,继续增大乙醇用量为5倍体积时由于乙醇用量较大且醇析时间较长而使部分多糖复溶[22-23]。故宜选择4倍体积的乙醇用量为最佳的醇析用量。

图4 醇析乙醇用量对双孢菇菇柄多糖得率的影响Fig.4 Effect of ethanol content on the yield of polysaccharides from A. bisporus stipe
2.1.5 超声提取次数对双孢菇多糖得率的影响 由表2可知,随着超声提取次数的增加,双孢菇菇柄多糖得率也逐渐增加,在提取次数为2次时,多糖得率达到较高水平,继续增加提取次数,多糖得率随有所增加,但未达到显著水平,故考虑提取得率、能耗等,选择提取次数2次为宜。

表2 超声提取次数对双孢菇菇柄多糖得率的影响Table 2 Effect of extraction times on the yield of polysaccharides from A. bisporus stipe
注:不同字母表示差异显著(p<0.05)。
2.2 正交实验
以多糖得率为指标,对双孢菇菇柄多糖的提取条件进行优化,正交实验结果及方差分析见表3、表4。

表3 正交实验结果Table 3 Results of orthogonal test
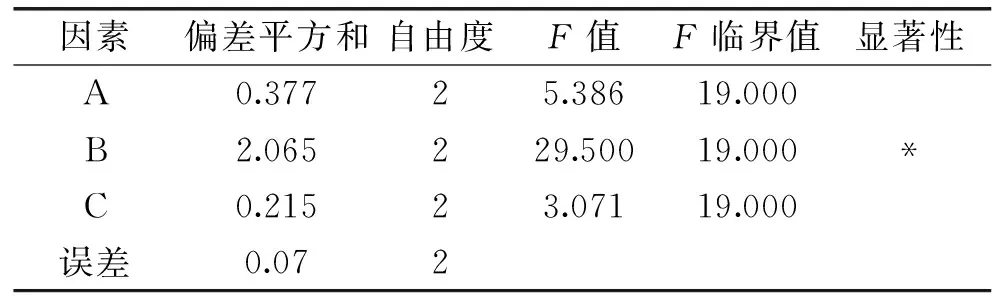
表4 正交实验方差分析结果Table 4 ANOVA results of orthogonal test
从表3的极差R可看出,各因素对多糖得率的影响依次为B>A>C,即影响多糖得率的因素依次为超声提取时间>超声功率>液固比,此结果与表4方差分析结果相一致。由表3中的k值可以看出,超声波提取双孢菇菇柄多糖的最佳工艺组合为A3B2C2,即超声功率700 W、超声提取时间50 min、液固比20∶1。为了验证所得结论的正确性,在此最优条件下测得双孢菇菇柄多糖得率为(5.35±0.13) g·100 g-1,高于9号实验条件下的双孢菇菇柄多糖得率,说明通过正交实验优选的超声波提取条件是可行的。这一结果与Tian等[1]采用超声波辅助提取整菇多糖的结果相差不大,在超声功率230 W,提取温度70 ℃,提取时间62 min和液固比30 g·mL-1的条件下,整菇多糖提取率为6.02%。这一结果虽然高于本研究的结果,但是菇柄的多糖得率仅低于整菇约11%,因此,菇柄的多糖含量还是非常可观的。
2.3 抗氧化活性
2.3.1 双孢菇菇柄多糖对羟自由基(·OH)的清除效果 由图5可以看出,在实验范围内,随着浓度的升高,双孢菇菇柄多糖对·OH清除率呈上升趋势,在多糖浓度为12 mg·mL-1时对·OH的清除率达89.24%。而VC在0.6 mg·mL-1时对·OH的清除率即达到了99.52%,说明虽然双孢菇菇柄多糖对·OH具有一定的清除效果,但仍弱于VC。

图5 双孢菇菇柄粗多糖及VC对·OH的清除效果Fig.5 Scavenging ability on ·OH of VC and the polysaccharides extracted from A.bisporus stipe

图6 双孢菇菇柄粗多糖及VC对DPPH·的清除效果Fig.6 Scavenging ability on DPPH· of VC and the polysaccharides extracted from A.bisporus stipe
2.3.2 双孢菇菇柄多糖对DPPH·的清除作用 在实验范围内,随着双孢菇菇柄多糖和VC浓度的增大,二者对DPPH·清除率均呈逐渐增大的趋势(图6),这一结果与Tian等[1]所报道的双孢菇多糖对DPPH·清除效果相似,但清除能力弱于Tian等[1]的结果,可能是由于双孢菇品种或其子实体和菇柄所含多糖组分不一致所造成。双孢菇菇柄多糖在浓度由0.6 mg·mL-1增加到12 mg·mL-1时,其对DPPH·清除率增大了45.87%。而VC在0.6~3 mg·mL-1时对DPPH·清除率迅速升高,达到26.78%,之后继续提高VC浓度至12 mg·mL-1时对DPPH·的清除率仅比3 mg·mL-1时增加了1.5个百分点,仅达到双孢菇菇柄多糖在0.6 mg·mL-1时的清除率。以上结果说明,双孢菇菇柄多糖对DPPH·的清除能力要高于VC。
2.3.3 双孢菇菇柄多糖的还原能力 样品的还原能力越强,在波长700 nm测定的吸光值越大。由图7可知,在实验所测定的浓度范围内,双孢菇菇柄多糖具有一定的还原能力,且其还原能力与多糖浓度呈正相关,即随着样品浓度的增大,还原能力也逐渐增强,但其还原能力远低于VC。这一结果与王娅玲等[18]对菱红菇多糖的还原能力相类似。

图7 双孢菇菇柄粗多糖及VC的还原能力Fig.7 Reducing power of VC and the polysaccharides extracted from A.bisporus stipe
3 结论
在提取次数为2次、乙醇用量为4倍体积时,最佳提取工艺参数为超声功率700 W、超声提取时间50 min、液固比为20∶1 (mL·g-1),此时双孢菇菇柄多糖得率可达5.35 g·100 g-1。
双孢菇菇柄多糖对DPPH·的清除效果较强,且其清除能力高于VC;虽然其对·OH清除率和还原能力低于VC,但仍有一定的作用效果。结果表明,双孢菇菇柄多糖具有一定的抗氧化能力,可作为多糖类产品开发的原料。
[1]Tian Y,Zeng H,Xu Z,et al. Ultrasonic-assisted extraction and antioxidant activity of polysaccharides recovered from white button mushroom(Agaricusbisporus)[J]. Carbohydrate Polymers,2012,88(2):522-529.
[2]Sun Y-X,Liu J-C,Yang X-D,et al. Purification,structural analysis and hydroxyl radical-scavenging capacity of a polysaccharide from the fruiting bodies ofRussulavirescens[J]. Process Biochemistry,2010,45(6):874-879.
[3]Liu J,Jia L,Kan J,et al.Invitroandinvivoantioxidant activity of ethanolic extract of white button mushroom(Agaricusbisporus)[J]. Food and Chemical Toxicology,2013,51:310-316.
[4]侯传伟,王安建,李顺峰,等. 双孢菇废弃物菇柄多糖提取工艺研究[J]. 食品工业科技,2013,34(21):266-268,289.
[5]李顺峰,王安建,侯传伟,等. 废弃双孢蘑菇菇柄微波真空干燥特性及动力学模型[J]. 中国食品学报,2016,16(2):181-188.
[6]吴素玲,孙晓明,王波,等. 双孢蘑菇子实体营养成分分析[J]. 中国野生植物资源,2006,25(2):47-48,52.
[7]徐伟. 双孢蘑菇菇柄中多糖、核酸等成分的提取利用[J]. 科技创新导报,2012(9):237.
[8]Nasiri F,Tarzi B G,Bassiri A R,et al. Comparative study on the main chemical composition of button mushroom’s(Agaricusbisporus)cap and stipe[J]. Journal of Food Biosciences and Technology,2013,3(3):41-48.
[9]Ferreira I C F R,Baptista P,Vilas-Boas M,et al. Free-radical scavenging capacity and reducing power of wild edible mushrooms from northeast Portugal:Individual cap and stipe activity[J]. Food Chemistry,2007,100(4):1511-1516.
[10]Ribeiro B,Lopes R,Andrade P B,et al. Comparative study of phytochemicals and antioxidant potential of wild edible mushroom caps and stipes[J]. Food Chemistry,2008,110(1):47-56.
[11]Radzki W,Ziaja-Sotys M,Nowak J,et al. Effect of processing on the content and biological activity of polysaccharides from Pleurotus ostreatus mushroom[J]. LWT-Food Science and Technology,2016,66:27-33.
[12]Vaz J A,Barros L,Martins A,et al. Chemical composition of wild edible mushrooms and antioxidant properties of their water soluble polysaccharidic and ethanolic fractions[J]. Food Chemistry,2011,126(2):610-616.
[13]Vamanu E,Nita S. Biological activity of fluidized bed ethanol extracts from several edible mushrooms[J]. Food Science and Biotechnology,2014,23(5):1483-1490.
[14]Guerra Dore C M P,Alves M G d C F,Santos M d G L,et al. Antioxidant and anti-inflammatory properties of an extract rich in polysaccharides of the mushroom Polyporus dermoporus[J]. Antioxidants,2014,3(4):730-744.
[15]华洵璐,张一平,匡群,等. 酶法结合超声破壁提取香菇水溶性糖和多糖的研究[J]. 食用菌,2011(2):54-57.
[16]陈海强,胡汝晓,黄晓辉,等. 复合酶法水解香菇工艺的研究[J]. 微生物学通报,2012,39(1):62-67.
[17]付娟妮,刘兴华,蔡福带,等. 真姬菇菌丝体多糖碱提取工艺优化[J]. 农业机械学报,2008,39(6):98-101,93.
[18]王娅玲,李维峰,郭芬,等. 微波辅助提取菱红菇多糖及抗氧化活性研究[J]. 食品工业科技,2015,36(9):251-254.
[19]高振鹏,袁亚宏,岳田利,等. 超声波辅助提取双孢菇多糖的研究[J]. 西北农林科技大学学报:自然科学版,2012,40(7):215-220.
[20]Dubois M,Gilles K A,Hamilton J K,et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry,1956,28(3):350-356.
[21]Blois M S. Antioxidant determinations by the use of a stable free radical[J]. Nature,1958,181(4617):1199-1200.
[22]李顺峰,刘兴华,张丽华,等. 真姬菇子实体多糖的提取工艺优化[J]. 农业工程学报,2008,24(2):281-284.
[23]董洪新,刘新海,徐志玲,等. 白灵菇子实体多糖提取工艺的研究[J]. 食用菌学报,2004,11(1):22-25.

