菌酶协同下的低温压榨菜籽粕 抗氧化肽制备工艺研究
叶国栋,潘婉莲,柯 婉,余海忠
(湖北文理学院化学工程与食品科学学院,湖北襄阳 441053)
我国油菜籽产量居世界首位,每年的制油副产物——菜籽粕多达600~700万吨,其中含35%~45%的粗蛋白[1],还含有硫甙、单宁、植酸等多种抗营养因子[2],因此,物理、化学、生物学等脱毒方法[3]被用于去除这些有害物质。菜籽多肽,则是菜籽粕粗蛋白水解之后的多肽混合物,具有抗氧化、抗肿瘤、降血压和促进动物细胞生长等活性,相较粗蛋白它具有更优的溶解性、凝胶性、吸水性等加工特性[4],可用于营养饮品、酸性饮料和高蛋白食品的生产。
目前,关于抗氧化多肽的制备工艺,国内外开展了一些研究。Wendee[5]用酶膜反应器连续生产大豆多肽,由于它能及时分离酶解生产的多肽并且除去了产物反馈干扰,从而使得酶解效率得到提高。雷鸣[6]以FRAP法测定的大豆多肽总抗氧化活性为评价指标,获得最佳木瓜蛋白酶水解条件:温度50 ℃,pH7.0,底物浓度5%,加酶量4%,水解时间4 h。武万兴[7]固态发酵制备核桃粕多肽,筛选出枯草芽孢杆菌为最佳菌株,且发现分子量小于5000 Da的多肽抗氧化活性最强。郭涛[8]用中性蛋白酶AS1.398水解菜籽蛋白,确定了温度45 ℃,pH7.2,酶解时间2 h、加酶量5%的最佳酶解条件,约有75%的蛋白质被转化为可溶性肽。刘大川[9]发明了一套菜籽粕直接酶水解制备菜籽多肽的工艺,缩短了工艺过程,降低了生产成本。何荣[10]利用枯草芽孢杆菌进行固态发酵生产菜籽多肽,获得最佳工艺条件:葡萄糖浓度0.26%,料液比1∶2.35 (W/V),培养基初始pH6.5,KH2PO4浓度0.26%,发酵温度31.2 ℃,接种量3.37×107个/mL,时间100 h。姚晓红[11]用枯草芽孢杆菌和酶共同发酵处理菜籽粕,使得多肽含量提高几倍,且硫甙降解率较高。
尽管已有菌酶协同制备菜籽多肽的相关研究,但尚未见以组合菌种与碱性蛋白酶共同作用、液体发酵制备抗氧化菜籽多肽的报道。为此,本实验以发酵菌种组合、菌酶比、接种量、料液比、发酵时间、发酵温度、pH、转速等参数为考察指标,通过单因素实验与响应面法优化,以获取最优的菜籽抗氧化多肽制备工艺,并对最优工艺条件下制备的菜籽多肽抗氧化能力进行考察,以期能为菜籽粕的综合开发利用、产品附加值的提高提供一定的理论支持。
1 材料与方法
1.1 材料与仪器
菜籽粕 干燥、粉碎,过50目筛,密封后置-20 ℃保存待用,湖北奥星粮油工业有限公司;枯草芽孢杆菌、啤酒酵母、黑曲霉、米曲霉、碱性蛋白酶(≥20万U/g) 北京科博汇智生物科技(发展)有限公司;牛肉膏蛋白胨培养基(牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂15.0~25.0 g,自来水1000 mL,pH7.4~7.6)、PDA培养基(马铃薯200.0 g,葡萄糖20.0 g,琼脂15.0~20.0 g,自来水1000 mL,自然PH)、PDB培养基(马铃薯200.0 g,葡萄糖20.0 g,自来水1000 mL,自然PH) 实验室自配;无水乙醇、Tris碱、邻苯三酚、HCl、铁氰化钾、磷酸氢二钾、磷酸二氢钾、三氯乙酸、醋酸、正丁醇、氨水、NaOH、CuSO4、生育酚等 上海国药集团公司;TBA、DPPH、Gly-Gly-Tyr-Arg Sigma公司。
FZ-102微型植物粉碎机 天津泰斯特设备公司;YSQ-LS-30SII立式压力蒸汽灭菌器 上海博讯设备公司;HZ-9211K恒温振荡器 常州恒隆仪器有限公司;DKB-501A超级恒温水槽 上海精宏仪器公司;UV-2550型可见-紫外分光光度计 日本岛津公司;AL204电子分析天平 上海梅特勒公司;Finnpipette可调式微量移液器 Finnpipette公司;KQ-250DA超声波清洗机 昆山超声仪器公司;BCD-208K冰箱 青岛海尔公司;GZX-9240MBE鼓风干燥箱 上海博讯设备公司;SIGMA 3K15低温冷冻离心机 Sigma公司。
1.2 实验方法
1.2.1 供试菌株的活化与酶液的配制 枯草芽孢杆菌划线转接到牛肉膏蛋白胨培养基上,37 ℃活化培养12 h;酿酒酵母、黑曲霉、米曲霉分别划线转接到PDA斜面上,28 ℃活化培养24 h。活化后的菌株分别用PDB培养基进行150 r/min振荡培养,16 h后对菌液进行无菌分装,4 ℃保存,待用。此外,称取一定质量的碱性蛋白酶,按2.5%的比例(W/V=g/mL)加入无菌水,配制酶液,待用。
1.2.2 菜籽多肽的制备与含量测定
1.2.2.1 菜籽多肽的制备 称取一定质量的菜籽粕粉碎物,按一定的料液比(W/V=g/mL)加入无菌水,充分振荡,置121 ℃湿热灭菌30 min,待其冷却至室温后,将等体积混合的组合菌液按一定的菌酶比(V/V=mL/mL)与碱性蛋白酶液混合,得到菌酶混合液。最后,根据文献[12],按10%的接种量(V/V=mL/mL)将混合液接种于菜籽粕,设置一定的pH和发酵温度,150 r/min振荡培养,发酵一定的时间后取出,4 ℃ 5000 r/min离心20 min,取上清液,即得水溶性菜籽多肽[13]。
1.2.2.2 菜籽多肽含量的测定 参照鲁伟等[14]的方法。首先,用5%的三氯乙酸依次配制0.2、0.4、0.6、0.8、1.0 mg/mL的Gly-Gly-Tyr-Arg四肽标准溶液,分别取3 mL标准溶液与2 mL的双缩脲试剂充分混匀,静置10 min,2000 r/min离心10 min,取上清液于540 nm下测定OD值。以四肽的浓度为横坐标X,OD值为纵坐标Y,制作标准曲线,得到回归方程Y=0.372X+0.0164,R2=0.998。然后,将上述制备的上清液全部转进25 mL容量瓶中,并用5%的三氯乙酸定容,摇匀。然后从中取3 mL溶液与2 mL的双缩脲试剂充分混匀,静置10 min,2000 r/min离心10 min,取上清液于540 nm下测定OD值,对照标准曲线即可求得菜籽多肽浓度(mg/mL)。
1.2.3 菜籽多肽的抗氧化活性测定 工艺参数优化阶段的菜籽多肽抗氧化活性测定,采用铁氰化钾还原法[15]:取1 mL样品溶液与2.5 mL pH6.6的磷酸盐缓冲液(0.2 mol/L)及2.5 mL 1.0%铁氰化钾溶液混合,50 ℃保温20 min,加入2.5 mL 10%三氯乙酸,混匀,静置10 min于700 nm处测吸光值。以吸光值大小表示还原能力大小,测得的吸光值越大,表明菜籽多肽的还原能力也就越强,即它的抗氧化活性就越大。
最优发酵工艺下制备的菜籽多肽抗氧化活性测定,采用以下三种方法:

DPPH法[16]。取3.9 mL DPPH甲醇溶液(25 mg/L)于具塞试管中,与0.1 mL样品甲醇溶液充分振荡混合。暗处反应30 min后,在515 nm波长处测定吸光值,空白管用甲醇溶液代替样品溶液。清除率(%)=[(A0-A)/A0]×l00。其中,A0为空白吸光值,A为样品吸光值。
抗脂质过氧化法[15]。抗脂质过氧化作用采用卵黄过氧化体系,在具塞试管中加入0.5 mL 10%的卵黄悬浮液和0.1 mL不同浓度样品溶液,用蒸馏水补至1 mL,再加入1.5 mL 20%的醋酸溶液,1.5 mL 0.8% TBA溶液,振荡混匀,加塞于95 ℃恒温水浴中加热60 min,流水冷却至室温,加入5.0 mL正丁醇,振荡后,3000 r/min离心10 min,取上层清液,以正丁醇为空白管调零,用紫外分光光度计测定532 nm处的吸光度A1。不加提取物的对照体系吸光度为A0,平行测定5次。按下式计算提取物对卵黄脂蛋白过氧化作用:清除率(%)=(A0-A1)/A0×100。
对获得的水溶性菜籽多肽分别进行0、10、100、1000倍的梯度稀释,获得供试样品(浓度分别为0.7648、0.07648、0.007648、0.007648 mg/mL)同时,配制相同梯度浓度的生育酚作为阳性对照。
1.2.4 单因素实验
1.2.4.1 菌种组合对菜籽多肽的抗氧化性的影响 取等体积的菌液相互混合进行菌种组合,设置如下:Ⅰ-枯草芽孢杆菌;Ⅱ-酿酒酵母;Ⅲ-黑曲霉;Ⅳ-米曲霉;Ⅴ-枯草芽孢杆菌、酿酒酵母;Ⅵ-枯草芽孢杆菌、黑曲霉;Ⅶ-枯草芽孢杆菌、米曲霉;Ⅷ-枯草芽孢杆菌、酿酒酵母、黑曲霉;Ⅸ-枯草芽孢杆菌、酿酒酵母、米曲霉;Ⅹ-枯草芽孢杆菌、黑曲霉、米曲霉;Ⅺ-枯草芽孢杆菌、酿酒酵母、黑曲霉、米曲霉。设置菌酶比为1∶1,在自然pH、料液比为1∶15的条件下,分别接种上述组合菌种,150 r/min振荡,30 ℃发酵24 h,测定菜籽多肽的抗氧化活性。
1.2.4.2 菌酶比对菜籽多肽的抗氧化性的影响 以枯草芽孢杆菌、黑曲霉、米曲霉为菌株组合,分别按1∶0、1∶0.5、1∶1、1∶1.5、1∶2的菌酶比,对菜籽粕进行接种,在温度30 ℃,振荡速率150 r/min,自然pH,料液比为1∶15 (W/V)的条件下发酵24 h,测定菜籽多肽的抗氧化活性。
1.2.4.3 时间对菜籽粕多肽的抗氧化性的影响 以枯草芽孢杆菌、黑曲霉、米曲霉为菌株组合,设置菌酶比为1∶1,在温度30 ℃,振荡速率150 r/min,自然pH,料液比1∶15 (W/V)的条件下,发酵12、24、28、36、40、48、60、72 h,测定菜籽多肽的抗氧化活性。
1.2.4.4 温度对菜籽多肽的抗氧化性的影响 以枯草芽孢杆菌、黑曲霉、米曲霉为菌株组合,设置菌酶比为1∶1,分别在温度27、30、33、36、39 ℃,振荡速率150 r/min,自然pH,料液比为1∶15 (W/V)的条件下发酵24 h,测定菜籽多肽的抗氧化活性。
1.2.4.5 pH对菜籽多肽的抗氧化性的影响 以枯草芽孢杆菌、黑曲霉、米曲霉为菌株组合,设置菌酶比为1∶1,在温度30 ℃,振荡速率150 r/min,pH为6、7、8、9、10、11,料液比为1∶15 (W/V)的条件下发酵24 h,测定菜籽多肽的抗氧化活性。
1.2.4.6 料液比对菜籽多肽的抗氧化性的影响 以枯草芽孢杆菌、黑曲霉、米曲霉为菌株组合,设置菌酶比为1∶1,在温度30 ℃,振荡速率150 r/min,自然pH,料液比为1∶10、1∶15、1∶20、1∶25、1∶30 (W/V)的条件下发酵24 h,测定菜籽多肽的抗氧化活性。
1.2.5 响应面实验 本实验用Design-expert软件以发酵温度(A)、发酵时间(B)、pH(C)、料液比(D)进行响应面实验设计,确定最优组合,实验因素及水平见表1。

表1 Box-Behnken中心组合设计的因素水平表Table 1 The level table of factors of Box-Behnken central composite design
1.3 数据处理
采用OriginPro软件(版本8.5)对单因素实验及抗氧化活性测定的数据进行分析处理;响应面实验设计与数据处理采用Design-expert软件(版本8.0.6)进行。
2 结果与分析
2.1 不同因素对菜籽多肽抗氧化能力的影响
2.1.1 菌种组合对菜籽多肽的抗氧化性的影响 不同菌种组合发酵对制备的菜籽多肽抗氧化活性影响见图1。从图1中可以看出,单株菌种发酵制备的菜籽多肽中,枯草芽孢杆菌和米曲霉的还原能力较强,而酿酒酵母和黑曲霉则很弱。猜测这可能与酿酒酵母、黑曲霉单独发酵时代谢产生的蛋白酶水解菜籽粕蛋白程度不够、产生的肽链过长有关。此外,当使用Ⅹ菌种组合,即枯草芽孢杆菌、黑曲霉、米曲霉,对菜籽粕进行液体发酵时,制备的菜籽多肽还原能力最强。因此,确定枯草芽孢杆菌、黑曲霉、米曲霉为最佳菌种组合。

图1 不同菌种组合对菜籽多肽抗氧化活性的影响Fig.1 Effect of different strains combination on antioxidant activity of rapeseed peptides
2.1.2 菌酶比对菜籽多肽的抗氧化性的影响 按不同体积比混合组合菌种与碱性蛋白酶,接种菜籽粕后进行液体发酵,考察其对制备的菜籽多肽抗氧化活性的影响。由图2可知,在设置的菌酶比范围内,菜籽多肽的还原能力呈现先增强后减弱的趋势,菌酶比为1∶1时抗氧化活性最强。因此,确定最佳菌酶比为1∶1。

图2 不同菌酶比对菜籽多肽抗氧化活性的影响Fig.2 Effect of different microorganism-enzyme ratio on antioxidant activity of rapeseed peptides
2.1.3 发酵时间对菜籽多肽的抗氧化性的影响 不同发酵时间对菜籽多肽的抗氧化性的影响见图3。在设置的发酵时间范围内,发酵36 h后菜籽多肽的还原能力最强。因此,选择最佳发酵时间为36 h。

图3 不同发酵时间对菜籽多肽抗氧化活性的影响Fig.3 Effect of different fermentation time on antioxidant activity of rapeseed peptides
2.1.4 发酵温度对菜籽多肽的抗氧化性的影响 图4显示的是发酵温度对菜籽多肽抗氧化性的影响。当发酵温度设置为36 ℃时,菜籽多肽的还原能力最强,因此,确定36 ℃为最佳发酵温度。

图4 不同发酵温度对菜籽多肽抗氧化活性的影响Fig.4 Effect of different fermentation temperature on antioxidant activity of rapeseed peptides
2.1.5 pH对菜籽多肽的抗氧化性的影响 pH对菜籽多肽的抗氧化性的影响见图5。由图5可知,当pH为7和8时,二者对制备的菜籽多肽的还原能力影响效果差异不大。但考虑到碱性蛋白酶的活性pH范围,所以选择8作为最佳pH。
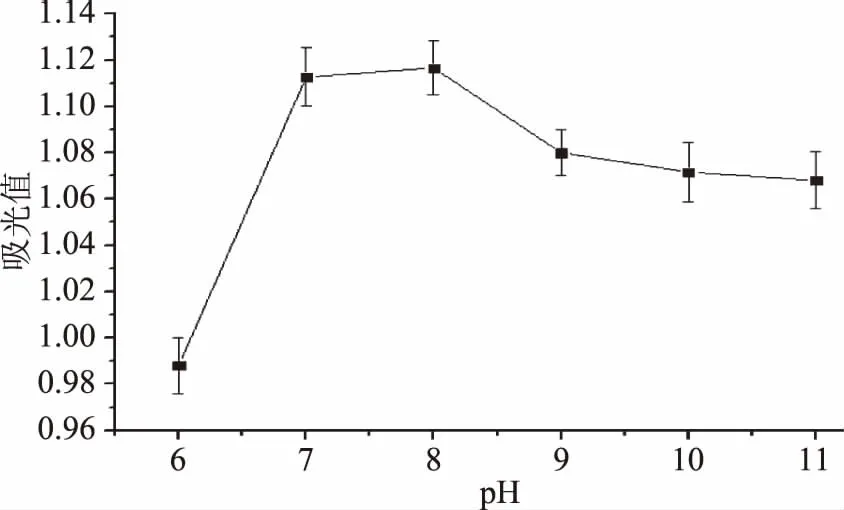
图5 不同pH对菜籽多肽的抗氧化活性的影响Fig.5 Effect of different pH on antioxidant activity of rapeseed peptides
2.1.6 料液比对菜籽多肽的抗氧化性的影响 菜籽粕粉碎物与无菌水按一定的质量体积比进行混合,接入菌酶后进行液体发酵制备菜籽多肽。图6显示了不同的料液比对菜籽多肽抗氧化活性的影响。由图6可知,当料液比在1∶20时,制备的菜籽多肽还原能力最强。因此,确定1∶20为最佳料液比。

图6 不同料液比对菜籽多肽的抗氧化活性的影响Fig.6 Effect of different solid-liquid ratio on antioxidant activity of rapeseed peptides

表2 Box-Behnken中心组合的实验设计及结果Table 2 Experimental design and results of Box-Behnken center composite

表3 响应面试验的方差分析Table 3 Variance analysis results
注:*:p<0.05,显著;**:p<0.01,极显著。
2.2 响应面实验
2.2.1 响应面法实验设计及结果 在单因素实验的基础上,选择菜籽多肽抗氧化性最强的因子:温度(A)、时间(B)、pH(C)、料液比(D)做响应面实验,分析各种因素间对菜籽多肽抗氧化性强弱的影响,实验设计及结果见表2。
2.2.2 方差分析 利用软件对表2实验数据进行多元回归比拟,得出菜籽多肽抗氧化活性(吸光值)对发酵温度、发酵时间、料液比和pH的二次多项回归方程为:抗氧化活性(吸光值)=1.00+0.052A+0.068B-0.056C+0.075D+0.058AB-0.012AC-0.073AD-0.014BC+8.500E-003BD-0.011CD+0.060A2-0.071B2-0.040C2+0.048D2。对实验数据进行方差分析,结果见表3。由表3可以看出,模型p=0.0216<0.05,说明此回归模型显著;而失拟误差p=0.2483>0.05,说明检验结果与模型计算结果不存在显著差异;相关系数R2=0.912,说明91.2%的实验数据的变异性可以用此回归模型解释,和实际情况拟合程度较好。因此,可用于分析和预测抗氧化菜籽多肽的制备工艺条件研究。

图7 两因素间的交互效应分析Fig.7 Surface figure analysis of interaction between two factors
根据各因素变量的显著性检验,可以看出:D因素、B因素、C因素、A因素的p<0.05,说明料液比、发酵时间、pH、发酵温度对响应值吸光值的影响显著。其中,料液比对响应值(吸光值)的影响最大,发酵时间次之,pH则影响更小;而A因素的p>0.05,即发酵温度的影响不显著。各因素对菜籽多肽抗氧化活性影响的主次顺序为:D>B>C>A。
2.2.3 两因素间的交互效应分析 本实验使用Design-Expert软件分析因素间的交互效应影响,在保持2个因素均为最优条件下,来分析其它2个因素间的交互效应,它们与响应值的关系用三维空间响应面图表示,具体见图7。
图7a显示的是发酵温度与发酵时间对菜籽多肽抗氧化活性影响。随着温度和时间的增加,菜籽多肽的抗氧化性均逐渐升高,但当它们增加到一定程度时,抗氧化性的增加趋势平缓。图7b显示的是发酵温度和pH对菜籽多肽抗氧化活性影响。当固定pH在某一值时,随着温度的升高,菜籽多肽抗氧化活性逐渐升高;当固定发酵温度在某一值时,随着pH的升高,菜籽多肽抗氧化活性先增加后减少。图7c显示的是发酵温度和料液比对菜籽多肽抗氧化活性影响:在发酵温度固定在某一值时,随着料液比的增大,菜籽多肽抗氧化活性逐渐减小;而固定料液比值,抗氧化性随着发酵温度的升高而增强。图7d显示的是发酵时间和pH对菜籽多肽抗氧化活性的影响。当固定发酵时间在某一定值时,随着pH的升高,菜籽多肽抗氧化活性逐渐减小;反之,固定pH时,抗氧化活性随著发酵时间的延长而增强。图7e显示的是发酵时间和料液比对菜籽多肽抗氧化活性的影响。当固定料液比在某一定值时,随着时间的延长,菜籽多肽抗氧化活性逐渐升高。图7f显示的是pH和料液比对菜籽多肽抗氧化活性的影响。当固定料液比在某一定值时,随着pH的升高,菜籽多肽抗氧化活性逐渐升高。
2.2.4 响应面最佳条件选择 利用软件对菜籽多肽抗氧化活性响应面的分析,得出最佳条件为:用枯草芽孢杆菌、黒曲霉、米曲霉为最佳菌种组合(V/V/V=1∶1∶1),菌酶比1∶1 (V/V),菌酶混合物的接种量为10%(V/V),发酵温度为36.13 ℃、发酵时间为36.43 h、pH为8.32、料液比为1∶20.13 (W/V)。此时,菜籽多肽的抗氧化活性最强,吸光值为1.28。
2.3 验证实验
为了验证预测值是否准确,同时考虑到实际操作的便利,将优化的最佳工艺参数调整为:最佳菌种组合为枯草芽孢杆菌、黒曲霉、米曲霉为(V/V/V=1∶1∶1),菌酶比为1∶1 (V/V),接种量为10%(V/V),发酵温度为36 ℃,发酵时间为36 h,pH为8,料液比为1∶20 (W/V),在此条件下进行三次平行实验,结果测得的吸光值为1.26,与预测值相差0.02,非常接近。这证明由响应面分析得到的实际值与二次多元回归模型预测值吻合良好,因此,优化后的菜籽多肽制备工艺有较高的可信度和实用价值。
2.4 最优工艺条件下制备的菜籽多肽抗氧化性测试
对最优工艺下制备的菜籽多肽含量进行测定,结果为0.7648 mg/mL,梯度稀释后,分别测定其清除超氧阴离子自由基、DPPH自由基以及抗脂质过氧化能力,其抗氧化活性随浓度的变化情况见图8。由图8可知,不同浓度的菜籽多肽对上述3种作用对象均具有较好的清除活性,在设置的最高浓度0.7648 mg/mL,对超氧阴离子的清除率达到67.4%(图8A),对DPPH自由基清除能力达到76.78%(图8B),抗脂质过氧化作用能力达到61.5%(图8C)。其中,菜籽多肽对DPPH的抗氧化活性最强,超氧阴离子次之,抗脂质过氧化能力最低,最高浓度下3种抗氧化活性均低于阳性对照生育酚,但是三者的清除率都超过了60%。上述实验结果,进一步印证了本工艺所制备的菜籽多肽具有良好的抗氧化活性。

图8 不同浓度的菜籽多肽清除自由基活性。Fig.8 Free radicals scavenging activity of different concentrations rapeseed peptides注:A:超氧阴离子;B:DPPH自由基;C:抗脂质过氧化。
3 结论
本实验采用液态发酵方法制备具有抗氧化活性的菜籽多肽,确定枯草芽孢杆菌、黒曲霉、米曲霉为最佳菌种组合(V/V/V=1∶1∶1),菌酶比为1∶1 (V/V),菌酶混合物的接种量为10%(V/V),在此条件下,接
种菜籽粕水溶液,通过响应面实验,得出最优工艺参数为:发酵温度为36 ℃,发酵时间为36 h,pH为8,料液比为1∶20 (W/V)。此时,菜籽多肽的抗氧化活性(吸光值)达到1.26。通过三次平行实验验证,表明采用响应面法优化得到的发酵参数准确、可靠,具有实用价值。同时,本实验对最优工艺下制备的菜籽多肽的抗氧化活性也进行了测试,在设定的最大浓度0.7648 mg/mL处,菜籽多肽对超氧阴离子和DPPH自由基的清除率分别达到67.4%和76.78%,抗脂质过氧化活性达到61.5%,结果进一步印证了菜籽多肽具有良好的抗氧化能力。
[1]刘文冰. 浅析我国油菜生产的现状与发展[J]. 中国种业,2005(1):17.
[2]严奉伟,邓明,朱建飞. 菜籽粕综合利用.[J]. 粮食与石油,2005(9):6-8.
[3]朱文优,李华兰,周守叙. 菜籽粕脱毒方法及其特点[J]. 粮食与食品工业,2009(16):6-10.
[4]刘清,谢奇珍,师建芳. 菜籽蛋白活性肽研究[J]. 粮食与油脂,2008(3):4-6.
[5]Wendee Chiang D. Function properties of soy protein by hydrolysate produced from a continuous membrane reactor system[J]. Food Chemistry,1999,65(2):189-194.
[6]雷鸣. 大豆多肽抗氧化研究[D]. 兰州:兰州理工大学,2007.
[7]武万兴. 固态发酵核桃粕制备抗氧化活性肽的研究[D]. 昆明:昆明理工大学,2014.
[8]郭涛,黄桃菊,韩文忠,等. 油菜籽脱皮冷榨制备菜籽多肽的研究[J]. 中国油脂,2005,30(9):15-16.
[9]刘大川,刘晔,张寒俊,等. 一种用菜籽粕直接酶水解制备菜籽多肽的方法:中国,200610019136.2[P]. 2006-12-27.
[10]何荣. 固态发酵生产菜籽多肽的研究[D]. 南京:南京财经大学,2009.
[11]姚晓红,吴逸飞,王新,等. 菌酶协同制备菜籽多肽工艺的优化及其营养成分分析[J]. 饲料工业,2011,32(18):47-51.
[12]孙冰沁,秦可欣,王桂荣,等. 基于油酸诱导的高产三萜灵芝菌丝体发酵条件优化[J]. 食品工业科技,2016,37(24):233-237,244.
[13]何荣海,刘磊,蒋边,等. 枯草芽孢杆菌液态发酵菜籽粕制备抗氧化肽[J]. 中国食品学报,2013,13(12):12-20.
[14]鲁伟,任国谱,宋俊梅. 蛋白水解液中多肽含量的测定方法[J]. 食品科学,2005,26(7):169-171.
[15]聂伦,熊尚森,余海忠. 襄麦冬不同极性部位粗提物抗氧化性能初步评价[J]. 山地农业生物学报,2013,32(1):32-34.
[16]余海忠,刘统,林丹洁,等. 鄂西北产鱼腥草提取物体外抗氧化性的四种化学方法评价[J]. 中国野生植物资源,2012,31(1):22-25.

