芝麻菜种子萌发过程中芽苗生长和硫苷代谢
李昕悦,杨润强,王 沛,田 璐,顾振新
(南京农业大学食品科技学院,江苏南京 210095)
芝麻菜(ErucasativaMill)是十字花科芸薹属一年生植物,原产于东亚与地中海,其具有生长周期短(40~60 d),气味辛辣,类似芝麻种子的香气等特点,并且富含胡萝卜素、维生素C、膳食纤维、类黄酮、硫代葡萄糖苷(Glucosinolate,GLs,简称硫苷)等功能成分[1]。欧洲国家常用其叶片做沙拉或清蒸蔬菜;由于其种子的高含油量,印度、巴基斯坦及一些非洲国家则将其作为一种重要的油料作物[2-3]。在日本,芝麻菜在过去数十年中被广泛食用,且显示出不断增长的经济潜能。在我国,河北、山西、陕西、黑龙江、云南、四川等地均有种植[4],但仍然未被广泛认知或食用。
硫苷是植物体的一类含氮、硫的次级代谢产物,主要存在于十字花科植物中,流行病学研究发现,硫苷能降低患癌风险,经常食用十字花科芸薹属蔬菜,如西兰花、花椰菜、甘蓝、芝麻菜等,有助于预防多种癌症的发生[5-6]。硫苷一般存在于液泡中,而黑介子酶(Myrosinase,MYR)则位于特定的蛋白体中,正常情况下,两者分离,相对稳定,当植物组织和细胞遭到机械损伤、病原菌侵染、昆虫取食或代谢诱导时,硫苷与MYR接触,逐步发生降解反应形成异硫氰酸盐(Isothiocyanates,ITCs)、硫氰酸盐、腈类等一系列产物[7]。目前研究认为其中ITCs在十字花科植物抗癌功效中起决定性的作用,萝卜硫苷的降解产物萝卜硫素(Sulforaphane,Sul)是迄今为止在蔬菜中发现的抗癌能力最强的天然活性物质,而芝麻菜中主要含有的是芝麻菜苷(Glucoerucin,GER),其降解产物芝麻菜素(Erucin,Eru)具有与萝卜硫素相似的结构,两者可以相互转化,且芝麻菜素还具有独特的直接抗氧化作用[8],具有极大的研究价值。
种子在发芽过程中生理生化变化显著,并伴随着多种物质间的转化、分解与合成。郭丽萍等[9]对西兰花苗研究发现,随着发芽的进行,萝卜硫苷含量和萝卜硫素的形成量不断降低;周晨光[10]研究了萝卜种子萌发过程中的生理变化,发现随着幼苗的生长,硫苷总体上呈下降趋势;张亮[11]的实验表明西兰花种子发芽过程中萝卜硫苷含量呈先升后降再上升,且与萝卜硫素含量呈极显著负相关。说明发芽过程中不同品种间物质变化存在差异,而芝麻菜芽苗菜作为一种新型的即食性食物鲜少被研究。
本研究选择“板叶”和“东升”两个品种芝麻菜,研究其萌发过程中生长状况及硫苷代谢的变化情况,旨在为芝麻菜芽苗菜及相关食品的开发提供一定的科学指导。
1 材料与方法
1.1 材料与仪器
芝麻菜种子 山东寿光惠农种业公司;烯丙基硫苷(纯度≥98%)、硫酸酯酶(酶活≥10.000 units/g solid)、异硫氰酸苯酯(纯度≥99%) 美国Sigma公司;芝麻菜素 纯度≥98%,美国LKT Labs公司;DEAE Sephadex A-25树脂、咪唑 北京索莱宝科技有限公司;甲醇、乙腈(色谱级) 美国天地公司;葡萄糖试剂盒 货号:F 006,南京建成生物工程公司;二氯甲烷、没食子酸、福林酚、甲醇、乙醇、乙酸、醋酸钠、盐酸 医药集团(上海)化学试剂公司。
PGX-150智能光照培养箱 宁波海曙赛福实验仪器厂;DY02九阳智能发芽机 山东九阳股份有限公司;Agilent 1200型高效液相色谱仪 美国安捷伦公司;UV-2802型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;TDL-40B型离心机 上海安亭科学仪器厂;Orion818型pH计 美国Orion公司。
1.2 实验方法
1.2.1 发芽及取样方法 称取2 g芝麻菜种子,于1.5%次氯酸钠溶液中浸泡消毒15 min,然后用蒸馏水冲洗至pH中性,置于蒸馏水中,30 ℃浸泡3 h后,均匀撒入铺有蛭石的发芽机中,于30 ℃下发芽,光照16 h/黑暗8 h,每隔12 h用100 mL蒸馏水喷施一次。分别在发芽2、4、6、8 d后取样(去根),吸水纸吸干芽苗表面水分,液氮速冻后于-80 ℃保存待测。0 d样品为仅浸泡3 h后的种子。
1.2.2 芽长、鲜重和含水率的测定 芽长:随机选取30株芽苗,用游标卡尺测定;鲜重:随机选取30株芽苗为一组,准确测定其重量,重复3次;干重:随机选取50株芽苗或50粒种子为一组,于60 ℃恒温箱中烘干至恒重后,准确测定重量,重复3次。

1.2.3 可溶性糖含量的测定 根据王学奎[12]的方法稍作修改。取0.1 g种子或10株芽苗,各加入3.0 mL水研磨成匀浆,90 ℃恒温水浴浸提20 min,于10000×g离心10 min,然后吸取0.5 mL上清于20 mL刻度试管中,加1.5 mL蒸馏水、0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分振荡,立即将试管放于沸水浴中准确保温1.0 min,取出后自然冷却至室温,在630 nm波长下测其吸光值。
式中:n为根据标准曲线所得可溶性糖含量(μg);Vt为样品提取液总体积,mL;Vs为测定时取用的样品体积,mL。标准曲线方程式为Y=0.006X+0.001(Y为630 nm处吸光度,X为可溶性糖质量,μg),相关系数r=0.9956。
1.2.4 游离氨基酸含量的测定 根据王学奎[12]的方法稍作修改。取0.1 g种子或10株芽苗,各加入3.0 mL 10%乙酸研磨成匀浆,10000×g离心15 min,取1.0 mL上清液于20 mL刻度试管中,依次加入1.0 mL去离子水、3.0 mL水合茚三酮试剂、0.1 mL 0.1%的抗坏血酸。充分混匀后盖上合适大小的玻璃球,置于沸水中加热15 min,取出后用冷水冷却并不时摇动,使加热时形成的红色空气被空气逐渐氧化而褪去,进而呈现蓝紫色时,用60%乙醇定容至20 mL,混匀后于570 nm处测吸光值。
式中:n为根据标准曲线所得的游离氨基含量(μg);Vt为样品提取液总体积,mL,Vs为测定时取用的样品体积,mL。标准曲线方程式为Y=0.0479X-0.0034(Y为570 nm处吸光度,X为游离氨基酸质量,μg),相关系数r=0.9982。
1.2.5 硫苷含量的测定 根据Wei等[13]的方法稍作修改。取0.1 g种子或10株芽苗,各加入2.0 mL 70%的沸甲醇,80 ℃恒温水浴浸提20 min,10000×g离心10 min后收集上清液,沉淀再用2.0 mL 70%沸甲醇提取20 min,合并两次提取的上清液,即为硫苷粗提液。取2.0 mL上清液流经DEAE SephadexTMA-25离子交换柱,待提取液充分排干后,加2.0 mL 0.02 mol/L的醋酸钠溶液冲洗2次,随后加500 μL硫酸酯酶,于30 ℃下反应16 h。用2.0 mL去离子水洗脱,洗脱液用0.45 μm水相滤膜过滤后用于HPLC分析。
HPLC色谱条件:色谱柱为Eclipse XDB-C18column(4.6 mm×150 mm×5 μm),流动相为超纯水和20%的乙腈(色谱级),洗脱程序:水洗脱1 min后,1~21~26 min内乙腈线性梯度变化0%~100%~0%。检测波长:226 nm;流速为1 mL/min;柱温:30 ℃;进样量:20 μL。以烯丙基硫苷为内标,结果以nmol/株表示。
1.2.6 异硫氰酸盐含量测定 根据Chung等[14]的方法并稍作修改。取0.1 g种子或10株芽苗,各用4.0 mL去离子水研磨成匀浆,30 ℃下恒温水浴2 h后于10000×g离心15 min。取250 μL上清液,与250 μL磷酸缓冲液(0.1 mol/L,pH8.5)、500 μL 1,2-苯二硫醇(10 mmol/L)混合均匀后,于65 ℃下反应2 h,待冷却后10000×g离心5 min。上清过0.45 μm有机相滤膜后用于HPLC分析。
HPLC色谱条件:色谱柱为Eclipse XDB-C18column(4.6 mm×150 mm×5 μm),流动相为超纯水-甲醇(30∶70,V/V),检测波长:365 nm;流速为1 mL/min;柱温:30 ℃;进样量:20 μL。以异硫氰酸苯酯做标准曲线,根据标准曲线计算样品中异硫氰酸盐的含量,结果以nmol/株表示。标准曲线方程式为Y=6403.2X+234.73(Y为HPLC所测峰面积,X为异硫氰酸苯酯浓度μmol/mL),相关系数r=0.9993。
1.2.7 黒芥子酶活性的测定 根据Kim等[15]的方法稍作修改。取0.1 g种子和10株芽苗,各用3.0 mL磷酸缓冲液(0.1 mol/mL,pH6.5)冰浴研磨,4 ℃下10000×g离心15 min,上清液即为粗酶液。各取500 μL粗酶液分别与500 μL去离子水和500 μL 0.2 mg/mL烯丙基硫苷混合均匀,加去离子水的样直接沸水灭酶5 min,加烯丙基硫苷的样于37 ℃水浴反应15 min后沸水灭酶5 min,用葡萄糖试剂盒测定葡萄糖的含量。以每分钟被黒芥子酶转化生成1 nmol葡萄糖为1个酶活力单位,酶活单位为U/株。
1.3 统计学处理
实验设3次生物学重复,各指标测定设3次技术重复,结果以x±SD表示。采用Sigmaplot 12.0作图,实验数据采用统计分析软件SPSS 17.0进行统计分析,均值间比较采用Duncan’s多重比较,在0.05水平上进行显著性检验。
2 结果与分析
2.1 芝麻菜芽苗芽长、株重及含水率的变化
“东升”的芽长(图1)、鲜重(图2)始终高于“板叶”。两者鲜重在发芽前4 d迅速增加,发芽后4 d有所减缓。发芽前2 d内“板叶”和“东升”的含水率均迅速升高,分别是发芽初始的1.57倍和1.64倍,4 d后变化趋于平缓,两品种含水率均无显著差异(p>0.05),发芽8 d后含水率分别为91.94%和91.88%(图3)。
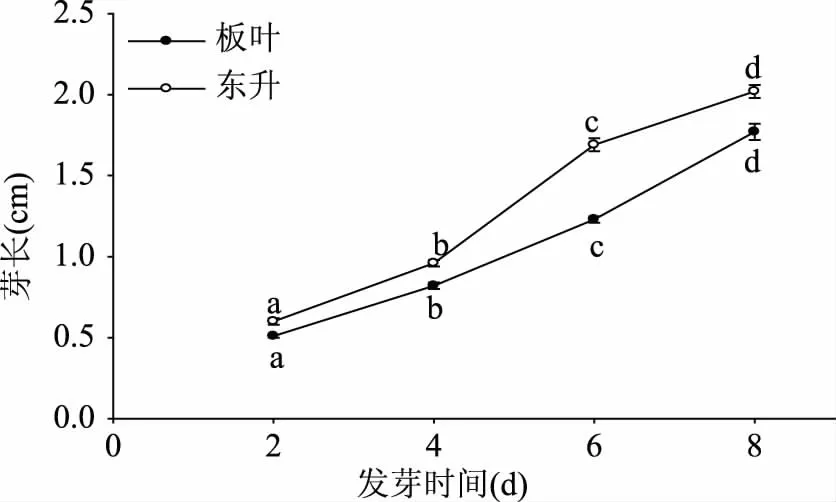
图1 两种芝麻菜种子发芽过程中芽长变化Fig.1 Changes of sprout length of Banye and Dongsheng rocket during germination注:不同小写字母表示不同发芽时间下 差异显著(p<0.05),图2~图7同。

图2 两种芝麻菜种子发芽过程中鲜重变化Fig.2 Changes of sprout fresh weight of Banye and Dongsheng rocket during germination
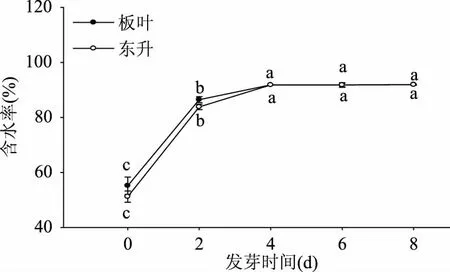
图3 两种芝麻菜种子发芽过程中含水率变化Fig.3 Changes of the rate of water content of Banye and Dongsheng rocket during germination
种子吸涨后开始萌发,胚芽突破种皮,随着发芽时间的延长,胚得到充分发育,各种内源酶被激活或合成,大分子有机物分解为小分子物质,为芽苗生长提供物质和能量。同时,细胞不断分裂、分化,吸水量也迅速增加,具体表现为芽长、株重及含水率的逐渐增长,在其他芽苗类蔬菜中也有相似的变化[16-17]。
2.2 游离氨基酸及可溶性糖含量
如图4所示,发芽过程中“板叶”和“东升”芝麻菜芽苗中游离氨基酸含量呈相似的变化趋势,且“东升”始终高于“板叶”。两者含量均在0 d时最低,分别为1.01 μg/株和1.19 μg/株,然后急剧升高,2 d时分别为0 d的4.22倍和5.24倍,随后逐天下降,在第6~8 d时又逐渐上升并达到最高值,分别为7.68 μg/株和7.64 μg/株。游离氨基酸是在细胞中以游离状态存在,是植物根部与土壤间氮素循环和植物体内氮素储存的主要形态,能反应植物氮素营养状况[18]。本研究中,芝麻菜种子发芽初期(0~2 d),游离氨基酸含量显著上升,可能是因为种子中贮藏的蛋白质在发芽初期被分解成可溶的小分子蛋白质或氨基酸,便于运输及合成新的蛋白质[19]。后随着发芽时间延长,光合作用被启动,相关酶活增强,游离氨基酸等小分子在相关酶的催化下,又再度合成新的蛋白或其他含氮物质。

图4 两种芝麻菜种子发芽过程中游离氨基酸变化Fig.4 Changes of free amino acid content of Banye and Dongsheng rocket during germination
由图5可知,在发芽过程中,“板叶”和“东升”两品种芝麻菜芽苗中可溶性糖的含量总体上先上升后下降,均在第6 d达到最高值,分别达到216.8 μg/株和203.5 μg/株,较0 d时增加1.80和1.25倍。发芽前4 d,“东升”芝麻菜芽苗中可溶性糖含量高于“板叶”,而发芽6 d后,“板叶”则高于“东升”。两种芝麻菜中可溶性糖含量变化呈现单峰曲线,这与刘浩荣[20]等对油菜在不同生育期的可溶性糖变化有类似的趋势。可能原因为种子萌发过程中,生命活动所需的能量主要依靠自身贮藏的物质,体内储存的淀粉被分解为小分子糖类以供芽苗的生长。发芽后期,生命活动旺盛,新的组织、器官合成,呼吸作用和光合作用均增强,各种小分子的糖类减少,用于新物质的合成[21]。

表1 两种芝麻菜种子发芽过程中硫苷含量变化Table 1 Changes of GLs content of Banye and Dongsheng rocket during germination

图5 两种芝麻菜种子发芽过程中可溶性糖含量变化Fig.5 Changes of soluble sμgar content of Banye and Dongsheng rocket during germination
注:GLs:硫代葡萄糖苷(硫苷),Glucosinolates;GRA:4-甲基亚磺酰-丁基硫苷,Glucoraphanin;GER:4-甲硫基-丁基硫苷,Glucoerucin;DIM:聚-4-巯丁基硫苷,Dimer-4-mercaptobutyl;-:未检测出;同列小写字母不同表示同一品种在在不同发芽时间下有显著性差异(p<0.05)。
2.3 硫苷代谢
2.3.1 硫苷含量 “板叶”和“东升”两品种种子中均只检测到GRA和GER两种GLs,而在发芽后,主要检测到GRA、GER和DIM三种GLs(表1),与Kim等[6]的研究结果相似。两品种中GLs总含量均呈先升高后降低趋势,在第2 d达到最高,且显著高于其他发芽时间(p<0.05),分别为初始时的1.20倍和1.91倍,随后逐天降低,发芽8 d后仅为53.74 nmol/株和55.87 nmol/株。发芽前2 d,“东升”品种中GLs总含量均远高于“板叶”,在0、2 d分别是其1.47倍和2.34倍,而从第4 d开始,两者的GLs总含量在相同的发芽时间差异很小。
由表1可知,“板叶”中GRA含量在发芽过程中呈先下降后上升再下降的变化趋势,其中,第2 d芽苗GRA含量较0 d降低了26.42%,4 d时GRA含量最高,达到37.68 nmol/株,是0 d时的3.63倍,第8 d含量最低,仅为14.65 nmol/株。GER含量则逐渐降低,第8 d仅为0 d时的5.91%。DIM则是发芽后才出现,随着芽苗的生长逐渐减少,8 d时其含量仅为2 d时的34.98%。
“东升”在发芽过程中,GRA、GER、DIM三种GLs变化趋势相同,均呈先上升后降低趋势。GRA在萌发第2 d较第0 d增加了5.68倍,第4、6 d较第2 d分别下降46.84%和88.85%,第8 d仅为15.03 nmol/株。GER也在第2 d含量最高,分别是0 d时的1.64倍和8 d时的65.75倍,不同发芽时间均有显著性差异(p<0.05)。DIM在发芽后才检测到,在第4 d达到峰值后逐渐下降,8 d时其含量为4 d时的50.55%。
种子中GER占总GLs的95%~97%,DIM则是发芽后才出现。随着芽苗生长,DIM逐渐占据主导地位,说明在发芽过程中GER的下降速度最快。有研究表明,在甘蓝[22]和萝卜[10]种子发芽过程中GRA含量及总硫苷含量逐渐下降,而本实验发现GRA含量及总硫苷含量均呈现先上升后下降趋势。可能原因是计量单位不同,本实验以株计量而其他学者以克计量,芽苗生长过程中水分增多,以克计算会受到水分的干扰。硫苷在种子发芽过程中存在着复杂的合成、分解及转化过程[23],发芽初始阶段硫苷的合成速率大于分解速率,使硫苷含量在一定程度上表现出上升的趋势,并且不同种类的硫苷也会相互转化;后随着芽苗的生长,部分硫苷作为硫源被分解,用于芽苗的生长代谢[17],致使总硫苷不断下降。
2.3.2 黑芥子酶活性及异硫氰酸盐含量 “板叶”的MYR活性在0 d时最低,发芽4 d时达到3.70 U/株且显著高于其他时间点(p<0.05)(图6),随后逐渐降低,2、6和8 d时酶活性无显著差异(p>0.05)。在“东升”中,发芽初期MYR活性迅速升高,2 d时达到5.70 U/株,是0 d时的10倍,随着发芽时间延长酶活逐渐降低,但仍显著高于0 d。发芽4、6 d无显著差异,8 d时又有所升高,为3.24 U/株。Guo等[24]的研究显示西兰花芽苗在发芽过程中MYR活性逐渐增强,而Willianms等[25]的研究则显示发芽2 d其活性达到最高,3~7 d无显著差异。Yuan等[26]发现萝卜芽苗在发芽过程中酶活先增强后下降,在第5 d时最高。这些结果表明发芽可以提高黒芥子酶的酶活,种子吸水萌芽后,与硫苷合成代谢相关的酶被激活,初始阶段MYR活力升高。而酶活表现出的变化差异可能与品种和酶活的表示方法有关,前人用的是比活或每克样品的活性,而本文用的是每株样品的活性。

图6 两种芝麻菜种子发芽过程中MYR活性变化Fig.6 Changes of MYR activity of Banye and Dongsheng rocket during germination
在MYR作用下GLs发生水解产生ITCs,本研究发现在不同的发芽时间节点,除6 d外,“东升”芝麻菜芽苗的ITCs形成量高于“板叶”(图7)。在发芽初始阶段,“板叶”中ITCs形成量升高较快,于第4 d达到最高,为0 d的3.68倍,与第6 d无显著差异(p>0.05),8 d时含量减少但仍显著高于0 d(p<0.05)。“东升”在0 d时ITCs形成量最低且不同时间间均有显著差异,在第4 d时达到最高值89.76 nmol/株。其他学者在甘蓝芽苗[22]的研究中发现发芽第1 d ITCs形成量达到最高。这可能与所选实验材料不同、所选时间节点不同及计量单位不同有关。初始阶段,种子进入萌芽状态,体内相关代谢途径被激活,且硫苷含量及MYR活性升高,所以形成更多的ITCs。随着发芽的进行,硫苷急剧减少,ITCs形成量减少。
3 结论
本研究通过比较两个芝麻菜品种在发芽过程中的生理生化与硫苷代谢的变化,发现发芽可以有效提高种子的品质。芽苗生长过程中储存性糖类物质先于蛋白质被降解,硫苷不断降解,黑芥子酶活性与异硫氰酸盐的形成存在时空差异。综合比较,“东升”的植株大小、含有的营养物质、GLs及ITCs含量较“板叶”更高,更为优秀。因芽苗中主要关注的功能性成分为ITCs,最佳发芽天数选为4 d。目前对芝麻菜相关的功能性食品的研究较少,芽苗菜作为一种廉价易得型食物具有良好的开发前景,可以进一步研究其发芽条件从而获得富含ITCs的优质芽苗菜,如控制温度、喷施外源物质、紫外照射等。
[1]Steinmetz K A,Potter J D. Vegetables,fruit,II. Mechanisms[J].Cancer Causes & Control,1991,2(6):427-442.
[2]Jirovetz L,Smith D,Buchbauer G. Aroma Compound Analysis ofErucasativa(Brassicaceae)SPME Headspace Leaf Samples Using GC,GC-MS,and Olfactometry[J]. Journal of Agricultural & Food Chemistry,2002,50(16):4643-4646.
[3]Yadava T P,Friedt D W,Gupta S K. Oil Content and Fatty Acid Composition of Taramira(ErucasativaL.)Genotypes[J]. Journal of Food Science & Technology,1998,35(6):557-558.
[4]李磊,杨霞,周昇昇. 植物化学物芝麻菜素的研究进展[J].食品科学,2012,33(19):344-348.
[5]Verhoeven D T,Goldbohm R A,Van P G,et al. Epidemiological studies on brassica vegetables and cancer risk[J]. Cancer Epidemiol Biomarkers Prev,1996,5(9):733-748.
[6]Kim S J,Ishii G. Glucosinolate profiles in the seeds,leaves and roots of rocket salad(ErucasativaMill.)and anti-oxidative activities of intact plant powder and purified 4-methoxyglucobrassicin[J]. Soil Science and Plant Nutrition,2006,52(3):394-400.
[7]Brown P D,Morra M J. Control of soil-borne plant pests using glucosinolate-containing plants[J]. Advances in Agronomy,1997,61(C):167-231.
[8]Barillari J,Canistro D,Paolini M,et al. Direct antioxidant activity of purified glucoerucin,the dietary secondary metabolite contained in rocket(ErucasativaMill.)seeds and sprouts[J]. Journal of Agricultural & Food Chemistry,2005,53(7):2475-2482.
[9]郭丽萍,王志英,杨润强,等. 西兰花种子发芽过程中生理活性物质含量的变化[J]. 中国食品学报,2016(3):160-167.
[10]周晨光,朱毅,罗云波. 萝卜苗发芽过程中营养物质的动态变化[J]. 食品科学,2014,35(9):1-5.
[11]张亮. 西兰花种子发芽过程中萝卜硫素的形成变化及结构鉴定[D]. 南京:南京农业大学,2011.
[12]王学奎. 植物生理生化实验原理和技术(第二版)[M]. 北京:高等教育出版社,2006:195-207.
[13]Wei J,Miao H,Wang Q. Effect of glucose on glucosinolates,antioxidants and metabolic enzymes in Brassica sprouts[J]. Scientia Horticulturae,2011,129(4):535-540.
[14]Chung F L,Jiao D,Getahun S M,et al. A urinary biomarker
for uptake of dietary isothiocyanates in humans[J]. Cancer Epidemiol Biomarkers Prev,1998,7(2):103-108.
[15]Kim H J,Chen F,Wang X,et al. Effect of methyl jasmonate on phenolics,isothiocyanate,and metabolic enzymes in radish sprout(RaphanussativusL.)[J]. Journal of Agricultural & Food Chemistry,2006,54(19):7263-7269.
[16]王志英,郭丽萍,杨润强,等. 甘蓝种子发芽过程中主要的生理生化变化[J]. 食品科学,2015,36(4):6-11.
[17]Gu Y,Guo Q,Zhang L,et al. Physiological and Biochemical Metabolism of Germinating Broccoli Seeds and Sprouts[J]. Journal of Agricultural & Food Chemistry,2012,60(1):209-213.
[18]申丽霞,王璞. 不同基因型玉米氮素吸收利用效率研究进展[J]. 玉米科学,2016,24(1):50-55.
[19]李瑞国,朱秀敏,杨慧. 不同萌发期绿豆芽蛋白质含量的测定及营养价值分析[J]. 山东农业科学,2011(1):97-99.
[20]刘浩荣,宋海星,刘代平,等. 油菜茎叶可溶性糖与游离氨基酸含量的动态变化[J]. 西北农业学报,2007,16(1):123-126.
[21]张继浪,骆承庠. 大豆在发芽过程中的化学成分和营养价值变化[J]. 中国乳品工业,1994(2):68-74.
[22]Wang Z,Guo L,Qianqian L I,et al. Changes in Main Physiological and Biochemical Metabolism in Cabbage Sprouts during Germination[J]. Food Science,2015,36(3):6-11.
[23]Gu Z X,Guo Q H,Gu Y J. Factors Influencing Glucoraphanin and Sulforaphane Formation in Brassica Plants:A Review[J]. Journal of Integrative Agriculture,2012,11(11):1804-1816.
[24]Guo L P,Yang R Q,Wang Z Y,et al. Glucoraphanin,sulforaphane and myrosinase activity in germinating broccoli sprouts as affected by growth temperature and plant organs[J]. Journal of Functional Foods,2014,9(1):70-77.
[25]Williams D J,Critchley C,Pun S,et al. Epithiospecifier protein activity in broccoli:the link between terminal alkenyl glucosinolates and sulphoraphane nitrile[J]. Phytochemistry,2008,69(16):2765-2773.
[26]Yuan G,Wang X,Guo R,et al. Effect of salt stress on phenolic compounds,glucosinolates,myrosinase and antioxidant activity in radish sprouts[J]. Food Chemistry,2010,121(4):1014-1019.

