妊娠期瘢痕子宫破裂11例病例分析及文献复习
罗敏,金力,刘欣燕,刘俊涛,沈铿
(中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730)
瘢痕子宫是一个相对广义的概念,任何针对子宫施行的妇产科手术后均可形成瘢痕子宫。常见的瘢痕子宫包括剖宫产、子宫肌瘤剔除、子宫腺肌症或肌腺瘤切除等手术后的子宫。瘢痕子宫在整个妊娠期面临子宫先兆破裂或子宫破裂的风险。随着全面二胎政策的放开,瘢痕子宫妊娠问题及孕期子宫破裂的风险日益受到关注。本文通过对妊娠期瘢痕子宫破裂的病例进行回顾性分析,旨在探讨瘢痕子宫破裂病例的临床特点、瘢痕子宫破裂的风险因素及预防、改善孕产妇及胎儿的妊娠结局。
资料与方法
一、研究资料
回顾性分析2000年1月至2016年6月我院收治的妊娠期完全性子宫破裂病例。无明确既往子宫手术史的自发子宫破裂,或剖宫产术中探查发现的子宫肌层连续性消失,但浆膜层尚完整的先兆子宫破裂者不属于本次研究范畴。共有11例病例符合上述要求被纳入研究范围。全部11例均接受急诊剖宫产,并于术中探查确诊子宫破裂。
二、研究方法
根据患者的既往子宫手术的类型,我们将所有病例分为剖宫产手术组(4例)和妇科手术组(7例)。每组患者根据接受手术的次数,再细分为单次和多次亚组。我们回顾分析这两组病例患者既往子宫手术史、孕产史、子宫破裂发生的妊娠周数、子宫破裂探查情况、母胎预后等特点,探讨瘢痕子宫孕前评估及孕期管理,预防子宫破裂的发生。
结 果
一、患者一般情况
患者平均年龄(32.6±4.5)岁(23~38岁),平均孕次(2.8±1.8)次(1~6次),平均产次(1.1±0.7)次(0~2次)。11例中,4例(36.4%)为剖宫产史的瘢痕子宫,纳入剖宫产组。其余7例(63.6%)为子宫肌瘤剔除术后的瘢痕子宫,纳入子宫肌瘤剔除组。
4例剖宫产组的患者,既往均为无宫缩的择期剖宫产分娩。其中2例(50%)为2次剖宫产史,2例(50%)为1次剖宫产史。剖宫产后平均避孕时间(18.8±8.1)月(11~31个月)。值得注意的是,2次剖宫产史的两位患者产后避孕时间均不足1年即再次妊娠(分别为9/11个月)。
7例子宫肌瘤剔除组的病例中,5例为单次子宫肌瘤剔除,1例为子宫肌瘤两次手术史,1例为不同部位子宫手术史2次(子宫肌瘤剔除术、宫腔镜子宫内膜多发息肉切除术)。以子宫肌瘤所在的位置来看,1例单发子宫肌瘤入宫腔,其余6例多发肌壁间肌瘤合并浆膜下肌瘤。7例手术均在腹腔镜下完成,肌壁间肌瘤的创面采用单层间断缝合或8字缝合。浆膜下肌瘤肌瘤拧除后创面均为双极电凝止血。子宫肌瘤剔除后避孕时间平均(13.7±7.4)月(9~30个月)。
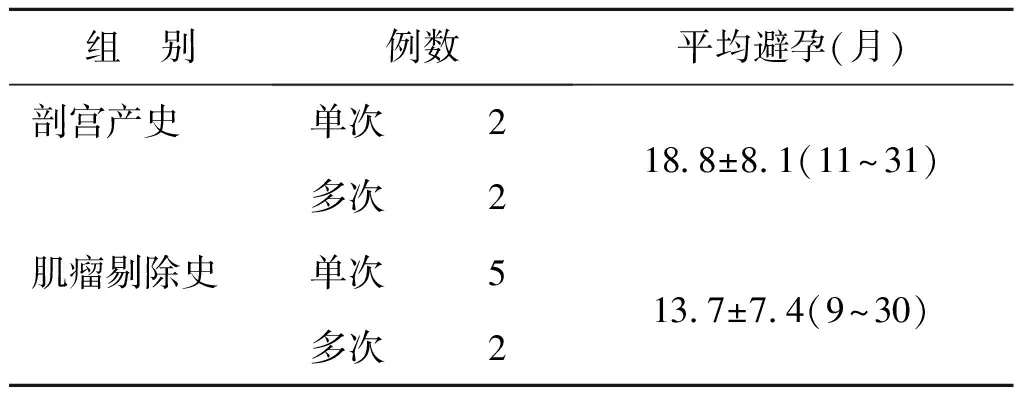
表1 患者一般情况
二、本次妊娠情况
子宫破裂发生的平均孕周为(28.1±7.7)周。3例为不足28周的宫内中孕(15/21/27周),5例为未足月晚孕(28/28/32/32/34周),3例足月妊娠(39/40/41周)。其中,剖宫产史组发生子宫破裂的平均孕周(23.8±6.5)周,肌瘤剔除史发生破裂组发生子宫破裂的平均孕周为(34.6±5.2)周。
三、临床表现
所有患者均以急性加重的持续性腹痛为主诉。其中1例足月临产,产程中突然发生持续性下腹痛伴胎心窘迫。54.5%(6例)合并失血性休克,45.5%就诊时胎死宫内(5例)。
急诊探查术中情况:平均腹腔内出血量2 486 ml,大于500 ml者占81.8%(9例),54.5% (6例)的患者术中输血纠正休克。1例剖宫产后行子宫切除术。
四、母胎预后
10例产妇存活,1例因失血性休克继发缺血缺氧脑病死亡。5例新生儿健康存活,5例胎儿就诊时已经胎死宫内,1例新生儿重度窒息并发缺血缺氧性脑病死亡。
讨 论
剖宫产瘢痕缺损(CSD)是剖宫产子宫切口愈合不良的表现,可导致妊娠子宫破裂。在众多影响CSD的因素中,子宫下段缝合方式是文献中讨论最多的影响因素。有作者通过系统回顾[1-2]发现多次剖宫产史影响子宫瘢痕的愈合,而单层还是双层缝合、缝合时全层缝合还是避开内膜层缝合,是否曾试产,是否采取引产措施,包括孕妇年龄都不影响瘢痕恢复。目前缺乏大规模前瞻对照研究,但meta分析[3]发现单层缝合后子宫下段前壁肌层(Lower uterine segment,LUS)厚度较双层缝合薄[-2.6 mm,95%CI(-3.1,-2.2),P<0.01]。
随着剖宫产次数的增加,CSD的发生率和程度也都在增加。2012年的系统回顾[1-2]也提出,多次剖宫产史影响子宫瘢痕的愈合。Hamar等[4]发现在剖宫产后6个月子宫瘢痕的厚度逐渐增厚。妊娠间隔少于18个月子宫破裂风险显著增高。妊娠间隔过短,导致子宫瘢痕愈合不良,明显增加子宫破裂的风险。
子宫肌瘤剔除术后的子宫是另一种常见类型的瘢痕子宫。不同文献报道肌瘤剔除术后妊娠子宫破裂的发生率约0.07%~1%,约为无子宫手术史者孕期子宫自发破裂发生率的10倍[5-6]。肌瘤剔除术后孕期子宫破裂的高危因素包括[5-6]:子宫肌瘤突向宫腔,尤其剔除后创面进入宫腔者;多发肌瘤,子宫创面多灶者;缝合方法不当影响子宫创面愈合;术后未待子宫瘢痕完全愈合,过早妊娠。
我院收治的7例子宫肌瘤剔除组中,肌壁间肌瘤的创面单层间断缝合或8字缝合;浆膜下肌瘤肌瘤拧除后创面均为双极电凝止血。结合这些缝合或电凝止血的患者既往史,我们考虑在子宫肌瘤剔除术中,尽量可以降低子宫破裂风险的方法包括:(1)尽量避免电凝止血:肌瘤剔除后的创面尽量减少过多的电凝止血,以避免子宫创面在愈合过程中的缺血导致愈合不良[7-8]。(2)分层缝合:分层缝合子宫肌瘤剔除后较深的子宫创面,避免创面内因空腔或血肿形成而影响子宫创面愈合。(3)手术入路的选择:一般来讲,肌瘤较小、外突的子宫肌瘤可以考虑腹腔镜手术,但如果肌瘤多发、内突向宫腔者建议考虑开腹手术,既能减少肌瘤残留的风险又可以做到创面缝合紧密。(4)术后避孕时间的长短。这主要根据术中肌瘤剔除多少及子宫创面深度而定。对于创面深入深肌层甚至进入宫腔的病例,建议术后至少避孕1年;肌壁间肌瘤剔除后的表浅创面建议至少避孕3~6个月。(5)终止妊娠方式的选择:产科医生需要结合既往子宫肌瘤剔除术时创面的位置、深度、个数等术中的情况,以及本次妊娠情况,综合考虑决定分娩方式。文献报道的子宫肌瘤剔除术后的择期剖宫产率一般为65%~80%[9-10]。Dubuisson等[5]报道了100例腹腔镜子宫肌瘤剔除术后妊娠患者的随访,择期剖宫产率38%,急诊剖宫产率33%,子宫破裂发生率1% [95%CI(0.0,5.5)]。
研究表明,剖宫产后子宫瘢痕的愈合情况评估对于再次妊娠子宫破裂的风险有重要的预警意义。在剖宫产术后半年内,瘢痕处肌层的厚度呈逐渐增加的趋势,所以最好在术后6个月后再行评估。鉴于子宫超声造影具有非常高的敏感性(87%),特异性(100%),阳性预测值(100%)和阴性预测值(95%),在有症状人群中诊断的准确率高达96%[11]。故推荐在非孕期采用子宫超声造影来评估子宫瘢痕愈合情况。在超声下子宫瘢痕缺损表现为子宫下段前壁的三角形,楔形,囊腔状的无回声区。评价的指标包括该无回声的宽度和深度,残余肌层厚度,残余肌层与下段前壁肌层厚度的比值。有学者将瘢痕缺损分为大和小缺损,以评估再次妊娠并发症的风险。以缺损深度超过6 mm或残余肌层厚度≤2.2 mm(超声造影)或残余肌层厚度≤2.5 mm(经阴超声)来界定大小缺损[12-13]。
剖宫产瘢痕缺损修补手术对于降低再次妊娠子宫破裂的风险尚处于研究之中。这部分患者再次妊娠时剖宫产瘢痕部位胚胎种植和子宫破裂的风险都可能增加,临床中可以手术切除子宫瘢痕组织并重新缝合,以期恢复子宫下段正常的厚度和解剖结构。手术途径有开腹,腹腔镜和经阴道三种。另外还有人通过宫腔镜切除瘢痕组织,打开缺损的底部,以减少经血潴留。Marotta等[14]提出,宫腔镜剖宫产瘢痕切除术,可能导致残余肌层变得更薄,从而增加再次妊娠的子宫破裂的发生。他们设计了根据患者的生育要求及残余肌层厚度的CSD分类及治疗方案。该方案提出如果剖宫产史妇女有生育要求残余肌层厚度小于3 mm,建议行腹腔镜下的CSD修补术。大于3 mm者在孕期超声监测子宫下段情况。如果患者无生育要求且有妇科症状时,当残余肌层厚度小于3 mm时,建议腹腔镜下CSD修补术或是腹腔镜监视下宫腔镜CSD切除术,当残余肌层厚度大于等于3 mm时,可行宫腔镜下CSD切除术,对于无临床症状者观察即可。
[1] Roberge S,Boutin A,Chaillet N,et al.Systematic review of cesarean scar assessment in the nonpregnant state:imaging techniques and uterine scar defect [J].Am J Perinatol,2012,29:465-471.
[2] Parant O.Uterrine rupture:prediction,diagnosis et management [J].J Gynecol Obstet Biol Reprod(Paris),2012,41:803-816.
[3] Roberge S,Demers S,Berghella V,et al.Impact of single-vs double-layer closure on adverse outcomes and uterine scar defect:a systematic review and metaanalysis [J].Am J Obstet Gynecol,2014,211:453-460.
[4] Hamar BD,Saber SB,Cackovic M,et al.Ultrasound evaluation of the uterine scar after cesarean delivery:a randomized controlled trial of one-and two-layer closure [J].Obstet Gynecol,2007,110:808-813.
[5] Dubuisson JB,Fauconnier A,Deffarges JV,et al.Pregnancy outcome and deliveries following laparoscopic myomectomy [J].Hum Reprod,2000,15:869-873.
[6] Kim HS,Oh SY,Choi SJ,et al.Uterine rupture in pregnancies following myomectomy:A multicenter case series [J].Obstet Gynecol Sci,2016,59:454-462.
[7] Hurst BS,Matthews ML,Marshburn PB.Laparoscopic myomectomy for symptomatic uterine myomas [J].FertilSteril.2005,83:1-23.
[8] Frishman GN,Jurema MW.Myomas and myomectomy [J].J Minim Inva-sive Gynecol,2005,12:443-456.
[9] Seracchioli R,Rossi S,Govoni F,et al.Fertility and obstetric outcome after laparoscopic myomectomy of large myomata:a randomized comparison with abdominal myomectomy [J].Hum Reprod,2000,15:2663-2668.
[10] Chen C.Laparoscopic myomectomy for large myomas [J].Int Surg,2006,91:S77-80.
[11] Menada Valenzano M,Lijoi D,Mistrangelo E,et al.Vaginal ultrasonographic and hysterosonographic evaluation of the low transverse incision after caesarean section:correlation with gynaecological symptoms[J].Gynecol Obstet Invest,2006,61:216-222.
[12] Osser OV,Jokubkiene L,Valentin L.High prevalence of defects in Cesarean section scars at transvaginal ultrasound examination[J].Ultrasound Obstet Gynecol,2009,34:90-97.
[13] Vikhareva Osser O,Valentin L.Clinical importance of appearance of cesarean hysterotomy scar at transvaginal ultrasonography in nonpregnant women[J].Obstet Gynecol,2011,117:525-532.
[14] Marotta ML,Donnez J,Squifflet J,et al.Laparoscopic repair of post-cesarean section uterine scar defects diagnosed in nonpregnant women [J].J Minim Invasive Gynecol,2013,20:386-391.

