薄型子宫内膜患者冻融胚胎移植周期17β雌二醇、人绝经期促性腺激素及他莫昔芬三种内膜准备方案临床结果比较
刘景瑜,朱颖春,孔娜,王玢
(南京大学医学院附属鼓楼医院,南京 210008)
自1983年首例冻融胚胎成功妊娠以来,冻融胚胎移植(FET)已成为辅助生殖技术的重要部分。胚胎的成功种植取决于优质胚胎和具有“容受性”的子宫内膜。子宫内膜厚度对胚胎种植至关重要,厚度<7~8 mm不利于胚胎着床[1]。FET周期的内膜准备方案主要包括:自然周期,激素替代周期及刺激周期。对于薄型子宫内膜患者,常用内膜准备药物包括激素替代(HRT),人绝经期促性腺激素(HMG)及他莫昔芬(TAM)。本研究比较了这三种方案的临床结果,拟探寻适合薄型子宫内膜患者的内膜准备方案。
资料与方法
一、研究对象
回顾性分析2015年1月至2016年10月于我中心行FET的薄型子宫内膜患者427例,共分为3组。
1.纳入标准:目前对于薄型内膜的定义无统一标准,通常认为内膜在7~8 mm以下不适宜胚胎移植,妊娠率降低[1-2]。结合我中心B超测量内膜的标准,本文将既往IVF/ICSI促排卵周期HCG扳机日及至少1次激素替代周期诱导内膜向分泌期转化开始使用孕酮(孕酮转化)日内膜厚度<8 mm定为薄型内膜。所有患者均签署知情同意书,且经过本院医学伦理委员会同意认可。
2.分组:三组分别为HRT组:123例,激素替代治疗后达到薄型子宫内膜标准,要求移植者。HMG组:155例,激素替代治疗后内膜厚度<8 mm放弃移植,改用HMG刺激准备内膜。TAM组:149例,激素替代治疗后内膜厚度<8 mm放弃移植,改用TAM刺激准备内膜。每一位患者均移植1~2枚优质冻融卵裂期胚胎。不育因素主要为输卵管因素,和(或)男方因素。
3.排除标准:重度子宫内膜异位症,子宫腺肌症,宫腔粘连或疤痕均不纳入研究范围。
二、HRT组内膜准备方案
月经周期第3天开始服用芬吗通雌激素片早晚各1片(2 mg 17-βE2/片,雅培,荷兰),服用第12~14天,B超监测内膜,若厚度≤7 mm,芬吗通加至早2片,晚1片,可酌情芬吗通1片/d置于阴道内,雌激素使用时间为20 d,若内膜厚度<8 mm可以要求放弃本周期。若要求移植,芬吗通改用雌孕激素片[2 mg 17-βE2+地屈孕酮10 mg/片(雅培,荷兰)],同时给予雪诺通1支/d(90 mg,默克雪兰诺,德国)置于阴道内,5 d后行解冻卵裂期胚胎移植。
三、HMG组内膜准备方案
月经第3天开始肌肉注射HMG 75 U/d(75 U/支,丽珠制药),4 d后可酌情增量至150~225 U/d,当卵泡直径≥18 mm时给予HCG 10 000单位(5 000 U/支, 丽珠制药)诱导排卵,诱导后第5天行解冻卵裂期胚胎移植。诱导后第2天开始口服地屈孕酮(10 mg/片,荷兰,雅培)20 mg,bid,同时给予HCG 2 000单位(2 000 U/支,丽珠制药),每3天1次,共2次。若无卵泡发育则放弃本周期。
四、TAM组内膜准备方案
月经周期第3天开始服用枸橼酸他莫昔芬(10 mg/片,扬子江药业)20 mg/d,连续5 d,月经周期第9天开始监测卵泡生长情况,当卵泡直径≥18 mm时给予HCG 10 000单位诱导排卵,诱导后第5天行解冻卵裂期胚胎移植。诱导后第2天开始口服地屈孕酮20 mg,bid,同时给予HCG 2 000 U,每3天1次,共2次。若无卵泡发育则放弃本周期。
五、优质胚胎标准
卵裂期胚胎解冻后为I级胚胎:细胞大小均等、透亮,胞质无颗粒,碎片≤5%;Ⅱ级胚胎:细胞大小略不均,胞质可有颗粒现象,碎片 6%~20%。
六、妊娠结局评估
移植后14 d验尿HCG,移植后30 d经阴道B 超检查见妊娠囊为临床妊娠。
七、统计学分析

结 果
一、一般资料
HRT组,HMG组及TAM组患者的年龄、不育年限、不育因素(输卵管因素,男方因素,双方因素)构成比均无统计学差异(表1)。
二、各组激素水平、内膜厚度比较
HRT组、HMG组及TAM组孕酮转化日的血清E2水平具有显著的统计学差异(P<0.05)。HRT组孕酮转化日内膜厚度与HMG组及TAM组前一放弃周期的内膜厚度无统计学差异(P>0.05)。HMG组及TAM组的孕酮转化日内膜较前一放弃周期显著增厚,且显著厚于HRT组,具有统计学意义(表1)(P<0.05)。3组的移植胚胎数平均为1.7枚左右,无统计学差异(P>0.05)。3组中I级和II级胚胎的占比无统计学差异(P>0.05)(表1)。
三、临床结局
HMG组的临床妊娠率及胚胎种植率略高于TAM组及HRT组,3组的临床妊娠率及胚胎种植率无统计学差异(P>0.05)。HRT组的早期流产率高于HMG组及TAM组。3组中HMG组的宫外孕比率最低,低于TAM组和HRT组。HMG组中9.7%的周期会出现多卵泡发育(≥4枚),而TAM组无多卵泡发育周期,两组间有统计学差异(P<0.05)(表2)。

表1 薄型内膜HRT组、HMG组、他莫昔芬组临床资料比较(-±s)
注:与HMG组、TAM组相比,*P<0.05;与TAM组相比,**P<0.05
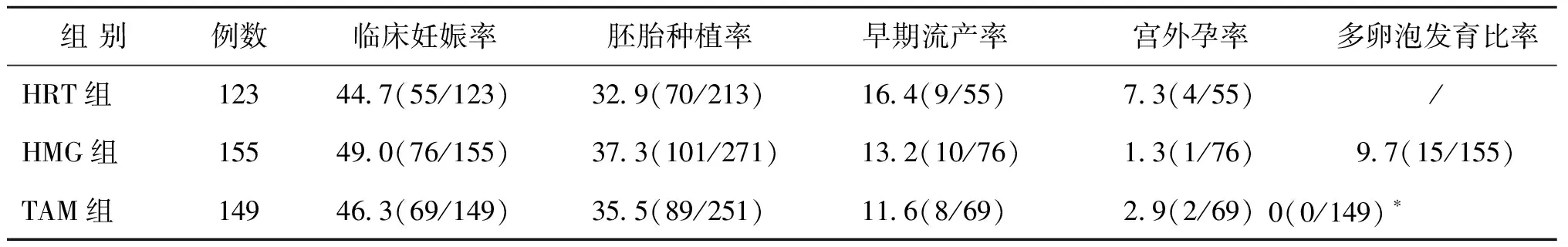
表2 薄型内膜HRT组、HMG组、他莫昔芬组冻融胚胎移植临床结局比较(%)
注:经Fisher精确检验,与HMG组相比,*P<0.05
讨 论
FET能提高胚胎利用率,增加累积妊娠率,降低卵巢过度刺激风险,减少患者再次取卵的风险及费用,是辅助生殖技术的重要组成部分。FET能否成功妊娠子宫内膜状态是关键因素之一。内膜厚度是反应内膜功能及环境的公认指标之一,与胚胎种植率密切相关,当子宫内膜厚度≥9 mm时容受状态较好[1,3]。当内膜厚度<8 mm时,妊娠率显著降低[1-2]。有部分患者表现为内膜厚度持续<7~8 mm,且对任何治疗均无反应,称为顽固性薄型子宫内膜。虽然目前对于薄型内膜的定义没有共识[4],但大多研究认为7~9 mm是内膜的临界状态[1-5]。文献报道薄型子宫内膜的发生率约为2.4%,妊娠率降低至25%以下[5]。在临床上较为棘手,给患者带来严重的心理压力及经济负担。
子宫内膜准备是FET成功妊娠的重要环节,内膜准备方案较多,临床上可根据患者病情,及工作安排灵活选择,主要包括自然周期,激素替代周期,刺激周期等。多项研究认为FET内膜准备方案中,尚无证据说明任何一种方案的优势[6-8];但以上并非针对薄型子宫内膜进行的研究。本研究回顾性比较了薄型子宫内膜患者常用的HRT,HMG及TAM三种方案的临床结果,拟探寻适合薄型子宫内膜患者的内膜准备方案。
雌孕激素是容受性子宫内膜所必需的[9]。子宫内膜准备方案的原理是通过内源性或外源性雌激素促进子宫内膜生长,后期在孕激素的作用下转化,模拟种植窗,使其具有容受胚胎的能力。HRT周期主要通过外源性雌孕激素达到促进内膜生长、转化的目的。因其使用方便,效果明显,且便于工作安排,在临床上广泛应用。口服及阴道内使用17-βE2较戊酸E2能显著提高薄型子宫内膜的内膜厚度及妊娠率;阴道内置17-βE2能避免肝脏的首过效应,使血清内及子宫内膜局部雌激素水平显著升高[10],因此本文HRT组患者使用芬吗通(17-βE2和地屈孕酮合剂)准备内膜。
刺激周期是子宫内膜生长所需雌激素的另一来源。HMG是FET周期内膜准备的经典药物[11-12]。HMG刺激后卵泡发育,卵泡颗粒细胞产生的雌激素能促进子宫内膜生长。TAM是一种人工合成的可与雌激素受体结合的非激素类制剂,可选择性调节雌激素受体,与雌激素受体结合后反馈性促使下丘脑和垂体分泌促性腺激素释放激素和促性腺激素,起到促排卵作用,同时刺激子宫内膜生长。TAM同HMG类似,都是利用成熟卵泡分泌的内源性雌激素刺激内膜生长。
本研究数据显示HMG组及TAM组的内膜厚度较HRT组显著增厚,较前一放弃周期的内膜亦明显增厚,均有统计学差异(P<0.05)。两组的临床妊娠和胚胎种植率略高于HRT组,以HMG组较明显。两组的宫外孕率及流产率略低于HRT组,其中HMG组宫外孕率最低,TAM组流产率最低。HRT组的宫外孕率较其余两组高5%~6%。上述结果虽无统计学差异但显示了HMG组、TAM组有优于HRT组的趋势。早期研究发现内膜<8 mm的宫外孕发生率可高达24.5%,而内膜≥8 mm的发生率仅为13.6%[13],本文数据与其相似。由此可见薄型子宫内膜是宫外孕的高危因素之一。曾有研究认为内膜厚度是预测宫内妊娠率,宫外孕率,自然流产率和出生率的重要且独立的因素[14]。内膜<8 mm不仅会导致妊娠率降低,亦是自然流产及异位妊娠的高危因素[14]。本研究发现HMG及TAM均能使薄型内膜有显著的增厚,提高种植率,降低宫外孕比例,或由于样本量较小,未显示出统计学差异。
本研究发现,HRT组的血清E2水平明显高于HMG组和TAM组,但内膜明显薄于这两组。雌激素是内膜生长的主要刺激因子,HRT组高雌激素作用下内膜的生长并不明显,推测可能存在以下原因:雌激素受体的缺乏;基因多态性改变[15-16]。在这种条件下,雌激素受体对外源性雌激素和内源性雌激素的反应可能是不一样的。此外,HMG和TAM在刺激卵泡产生雌激素的同时,可能还存在促进内膜生长的其它机制。动物实验发现HMG能促进内膜细胞胞饮突的形成,增加内膜的容受性[17]。尚有研究发现HMG刺激周期能改善卵泡期及黄体期的内膜状态,使其容受性增加[18]。一项对正常内膜厚度患者的FET周期随机对照试验(RCT)研究提示HMG促排卵周期的胚胎种植率,临床妊娠率及出生率较自然周期有提高的趋势[19]。HMG能改善子宫血流的灌注,降低血管阻力[20],而薄型子宫内膜的发生与血流阻力增加密切相关,阻力越大内膜越薄[21-22]。三组中HMG组的胚胎种植率最高,宫外孕率最低,可能和以上因素有关。
薄型子宫内膜中血管内皮生长因子(VEGF)表达量明显下降[21]。而TAM可以上调子宫内膜VEGF的表达,促进子宫内膜微血管的形成[23]。在改善微循环的同时,还可以通过促进内膜基质细胞旁分泌因子的增加,刺激子宫内膜上皮增殖[24];通过调节雌激素受体表达促进雌激素相关基因通路的活化刺激内膜细胞生长[25-27]。
研究发现相比HRT方案,HMG刺激周期会增加B超监测及血激素检查次数,增加患者就医次数[8]。HMG刺激周期需每日肌肉注射药物,不及HRT组及TAM组口服药物舒适、方便。同时,HMG组多卵泡发育(≥4个)周期的比例较TAM组明显增加(9.7% vs.0%),OHSS高风险患者应谨慎使用。
综上所述,相比HRT周期,HMG及TAM刺激周期使薄型子宫内膜厚度明显增加的同时,有增加胚胎种植率,降低宫外孕率及流产率的趋势,其中HMG效果较明显,但可能因样本量较小并无统计学差异。因此,临床上对顽固性薄型子宫内膜患者,HMG和TAM可尝试使用。此外HMG组的多卵泡发育率较高,OHSS高风险人群慎用。
[1] Lédée N.Uterine receptivity and the two and three dimensions of ultrasound[J].Ultrasound Obstet Gynecol,2005,26:695-698.
[2] 倪丰,张莹莹,姜宏.冻融胚胎在薄型子宫内膜患者的临床结局[J].生殖医学杂志,2014,23:805-808.
[3] Miyara M,Sakumoto T,Takamiyagi N,et al.Relationship between endometrial histology,morphometry and ultrasound texture in the follicular phase of infertile women with natural menstrual cycles[J].Hum Reprod,1996,11:1719-1723.
[4] Senturk LM,Erel CT.Thin endometrium in assisted reproductive technology[J].Curr Opin Obstet Gynecol,2008,20:221-228.
[5] Kasius A,Smit JG,Torrance HL,et al.Endometrial thickness and pregnancy rates after IVF:a systematic review and meta-analysis[J].Hum Reprod Update,2014,20:530-541.
[6] Ghobara T,Vandekerckhove P.Cycle regimens for frozen-thawed embryo transfer[DB].Cochrane Database Syst Rev,2008,1:CD003414.
[7] Ghobara T,Gelbaya TA,Ayeleke RO.Cycle regimens for frozen-thawed embryo transfer[DB].Cochrane Database Syst Rev,2017,7:CD003414.
[8] Groenewoud ER,Cantineau AE,Kollen BJ,et al.What is the optimal means of preparing the endometrium in frozen-thawed embryo transfer cycles? A systematic review and meta-analysis[J].Hum Reprod Update,2013,19:458-470.
[9] Paulson RJ,Hatch IE,Lobo RA,et al.Cumulative conception and live birth rates after oocyte donation:implications regarding endometrial receptivity[J].Hum Reprod,1997,12:835-839.
[10] 凌丹丹,施晓波.17β雌二醇及生长激素在薄型子宫内膜患者冷冻胚胎移植内膜准备中的作用[J].生殖医学杂志,2016,25:72-76.
[11] Van der Auwera I,Meuleman C,Koninckx PR.Human menopausal gonadotrophin increases pregnancy rate in comparison with clomiphene citrate during replacement cycles of frozen/thawed pronucleate ova[J].Hum Reprod,1994,9:1556-1560.
[12] Yu J,Ma Y,Wu Z,et al.Endometrial preparation protocol of the frozen-thawed embryo transfer in patients with polycystic ovary syndrome[J].Arch Gynecol Obstet,2015,291:201-211.
[13] Dart RG,Dart L,Mitchell P,et al.The predictive value of endometrial stripe thickness in patients with suspected ectopic pregnancy who have an empty uterus at ultrasonography[J].Acad Emerg Med,1999,6:602-608.
[14] Yuan X,Saravelos SH,Wang Q,et al.Endometrial thickness as a predictor of pregnancy outcomes in 10787 fresh IVF-ICSI cycles[J/OL].Reprod Biomed Online,2016,33:197-205.
[15] Mylonas I,Jeschke U,Shabani N,et al.Steroid receptors ERalpha,ER-beta,PR-A and PR-B are differentially expressed in normal and atrophic human endometrium[J].Histol Histopathol,2007,22:169-176.
[16] Le AW,Wang ZH,Yuan R,et al.Association of the estrogen receptor-β gene RsaI and AluI polymorphisms with human idiopathic thin endometrium[J].Genet Mol Res,2013,12:5978-5985.
[17] Rashidi B,Soleimani Rad JI,Roshangar L,et al.Evaluation of pinopodes expression on the mouse endometrium immediately before implantation by treatment with HMG/HCG and sildenafil citrate administration[J].Iran J Basic Med Sci,2012,15:1091-1096.
[18] Levi AJ,Drews MR,Bergh PA,et al.Controlled ovarian hyperstimulation does not adversely affect endometrial receptivity in in vitro fertilization cycles[J].Fertil Steril,2001,76:670-674.
[19] Peeraer K,Couck I,Debrock S,et al.Frozen-thawed embryo transfer in a natural or mildly hormonally stimulated cycle in women with regular ovulatory cycles:a RCT[J].Hum Reprod,2015,30:2552-2562.
[20] Tekay A,Martikainen H.Comparison of uterine blood flow characteristics between spontaneous and stimulated cycles before embryo transfer[J].Hum Reprod,1996,11:364-368.
[21] Miwa I,Tamura H,Takasaki A,et al.Pathophysiologic features of "thin" endombetrium[J].Fertil Steril,2009,91:998-1004.
[22] Mahajan N,Sharma S.The endometrium in assisted reproductive technology:How thin is thin? [J].J Hum Reprod Sci,2016,9:3-8.
[23] 杨保军,邢凤玲,冯力民,等.他莫昔芬对子宫内膜血管内皮生长因子表达的影响[J].首都医科大学学报,2007,28:412-414.
[24] Cooke PS,Buchanan DL,Young P,et al.Stromal estrogen receptors mediate mitogenic effects of estradiol on uterine epithelium[J].Proc Natl Acad Sci U S A,1997,94:6535-6540.
[25] Hu R,Hilakivi-Clarke L,Clarke R.Molecular mechanisms of tamoxifen-associated endometrial cancer (Review) [J].Oncol Lett,2015,9:1495-1501.
[26] Mourits MJ,Ten Hoor KA,van der Zee AG,et al.The effects of tamoxifen on proliferation and steroid receptor expression in postmenopausal endometrium[J].J Clin Pathol,2002,55:514-519.
[27] Elkas J,Armstrong A,Pohl J,et al.Modulation of endometrial steroid receptors and growth regulatory genes by tamoxifen[J].Obstet Gynecol,2000,95:697-703.
——MIYOTA薄型GL/N/M系列机心

