病毒性神经坏死病病毒核酸检测用标准物质的制备
段燕喻,陈 茹,吴晓薇,朱道中,林志雄,田纯见,刘志玲
(广东出入境检验检疫局检验检疫技术中心,广东省动植物与食品进出口技术措施研究重点实验室,广东广州 510623)
病毒性神经坏死病(Viral nervous necrosis,VNN)又称病毒性脑病和视网膜病(Viral encephalopathy and retinopathy,VER)[1]。 其 病原为神经坏死病病毒(Nervous necrosis virus,NNV),可感染多种石斑鱼(Epinephelus akaara、Epinephelus septemfasciatus、Epinephelus fuscogutatus)[2-4]、尖 吻 鲈鱼(Latescalcarife)[5]、大菱鲆[6]等40多种海水鱼类。该病在世界范围内广泛暴发,对仔鱼和幼鱼危害很大,感染后死亡率极高,严重的1周内死亡率可达100%[7-8]。病鱼主要表现为不同程度的神经异常和厌食,浮于水面旋转游动。组织学观察可见视网膜、脑中枢神经组织出现空泡。已有研究表明[3,9],该病已从海水鱼传播到淡水鱼,从幼鱼传播到成鱼,给各国海水养殖业造成巨大损失。VNN被世界动物卫生组织(OIE)、亚太水产养殖中心协作网(NACA)列入水生动物病害名录,被我国列为二类动物疫病。各国在进出境水生动物检疫中,将其作为重要的检疫项目。
目前国内外已报道的VNN检测方法大致可分为免疫学方法、分子生物学方法和细胞培养法3大类。其中:免疫学方法包括ELISA[10]、免疫荧光技术[11]、免疫组织化学方法等;分子生物学方法主要包括RT-PCR[12]、巢式RT-PCR[13]、实时荧光定量PCR[14]等。但由于细胞培养法耗时长,免疫学方法制备单克隆抗体难,因此这些方法在VNN临床检测中推广难度较大。分子生物学检测方法以检测快速、特异好和敏感性高等优点,在VNN检测中得到广泛应用。
国内外学者对VNN的RT-PCR检测,较多选取RNA2基因设计引物及探针[15-17]。OIE《水生动物疾病诊断手册》中推荐的VNN分子生物学方法也将RNA2基因作为目标基因。但由于缺少检验用的质控标准物质,影响了实验室间检测结果的比对和互认,且活病毒的流通存在生物安全风险,不利于质控样品的传递,因此开展VNN标准物质研究,对确保核酸检测阳性质控均一、安全有效具有重要意义。
本研究根据OIE《水生动物疾病诊断手册》推荐的VNN荧光RT-PCR检测方法,设计特异性引物,扩增NNV的RNA2基因片段,经克隆转录获取大量的cRNA,将其作为NNV阳性核酸物质,并从均一性、稳定性、定值和不确定度等几个方面进行了研究。
1 材料与方法
1.1 菌毒株及载体
NNV毒 株(Red-spotted grouper nervous necrosis virus,RGNNV)为深圳出入境检验检疫局动植食检测中心水生实验室赠送;pGEM-T Easy Vertor System II 载体为Promega公司产品;JM109大肠杆菌化学感受态细胞为北京天根生物技术有限公司产品。
1.2 主要仪器与试剂
7500FAST荧光PCR仪:ABI公司产品;NanoDrop1000紫外分光仪:ThermoFisher公司产品;冷冻干燥仪器:Christ公司产品;RNA 提取试剂盒、体外转录试剂盒:Promega公司产品;一步法RTPCR试剂盒、限制性内切酶Nde I:TAKARA公司产品;DNA胶回收试剂盒:Axygen 公司产品;质粒提取试剂盒、RNA纯化试剂盒:北京天根生物技术有限公司产品。
1.3 标准物质制备用毒株鉴定
RGNNV灭活病毒悬液由深圳出入境检验检疫局国家水生动物疫病检测重点实验室赠送。采用OIE《水生动物疫病诊断手册》(第2.3.11章)推荐的常规RT-PCR方法鉴定,将扩增产物进行序列测定后,与GenBank登录的NNV序列进行同源性比对,确认该毒株为NNV,可将其用于NNV核酸检测标准物质的研制。
1.4 标准物质制备
1.4.1 重组质粒构建 根据GenBank登录的NNV毒株序列,以及OIE《水生动物疫病诊断手册》中NNV检测方法推荐的引物,选择RNA2基因中相对保守区域,设计用于克隆NNV RNA2基因的特异性扩增引物(表1),并由Thermo Fisher公司合成。以病毒核酸为模板进行RT-PCR扩增后,对扩增产物进行序列测定。将序列正确的特异性基因片段连接于pGEM-Teasy载体,转化至JM109大肠杆菌感受态细胞;挑取白色菌落,经RT-PCR鉴定及序列测定鉴定为阳性后,用天根公司的高浓度质粒提取试剂盒进行质粒提取;将该重组质粒命名为pGEM-RNA2。

表1 NNV RNA2基因的扩增引物
1.4.2 NNV RNA2基因体外转录 选择重组质粒中位于NNV RNA2基因下游的Nde I限制性内切酶位点,对pGEM-RNA2进行单酶切,使其线性化后采用DNA 胶回收试剂盒纯化,用T7 RiboMAXTMLarge scale RNA production system进行体外转录。转录序列从pGEM-RNA2载体的启动子开始至Nde I酶切位点止。转录体系总体积为100 μL,包含以下组分:T7 Transcription 5×Buffer 20 μL、dNTPs(25 mmol/L)30 μL、线性化质粒5~10 μg、Enzyme Mix(T7)10 μL、ddH2O 40 μL。混匀后置37 ℃反应5 h,接着向体外转录产物中加入10 μL DNA酶,37 ℃反应15 min以去除DNA模板,最后用天根RNA纯化试剂盒提取纯化,去除体系中的杂质。将RNA沉淀溶于RNase-Free H2O中,即得到纯的RNA2-cRNA片段。
1.4.3 RNA2-cRNA纯度及初步定量 取制备的RNA2-cRNA做100倍稀释;用Nano Drop 1000紫外分光仪测定其在260 nm与280 nm处的OD值;根据OD260/OD280值分析溶液中的RNA纯度。OD260/OD280在1.8~2.0,说明 RNA的纯度较高;比值低于1.8,说明RNA样品有残余蛋白质存在;比值高于2.0,则表明RNA可能降解。同时根据单链RNA的相对分子质量(MW),按下式计算出RNA2-cRNA的拷贝数浓度。拷贝数(copies/μL)=(6.02×1023拷贝数 /mol)× 浓度(g/μL)/分子量(g/mol)。
1.4.4 RNA2-cRNA稀释与分装保存 将制备的RNA2-cRNA,用RNase-Free H2O系列稀释成108~104copies/μL;采用荧光 RT-PCR 方法测定各浓度Ct值,从而获得标准曲线,建立回归方程。将108copies/μL的样品混匀后分装入冻存管,每管1.0 mL,分装300管,分别保存于室温(20~25 ℃)、冷藏(2~8 ℃)和冷冻(-20 ℃)。每个温度下保存20支,剩余的保存于-80 ℃。
1.5 标准样品检测分析
1.5.1 均匀性检验 从-80 ℃保存的标准物质样品中,随机抽取10支,编号后用OIE《水生动物疫病诊断手册》第2.3.11章中的病毒性神经坏死病荧光RT-PCR方法检测Ct值,以此检验批间均匀性。从每管样品分别抽取10 μL混合,用荧光RT-PCR方法测定10次,用于检验批内均匀性。
1.5.2 稳定性检验 不同温度条件保存样品时间如下:室温(20~25 ℃)7 d;冷藏(2~8 ℃)1个月;冷冻(-20 ℃)6个月;冷冻(-80 ℃)长期保存。依次作为不同条件下的稳定性对照组。各温度条件保存期结束后,分别随机抽取4支,应用OIE推荐的荧光RT-PCR方法检测Ct值;采用双样本等方差假设的t检验,对数据进行统计分析,评价标准物质的稳定性。
1.5.3 定值检测与协作标定 本次定值采用测定标准物质浓度,根据片段长度换算拷贝数和协作标定的方式,联合7家权威实验室,对制备好的标准物质进行定值。
1.5.4 不确定度分析 本研究定值结果的不确定度主要包括设备、试剂和人员操作误差。应用A类评定方法进行不确定度评定。
2 结果
2.1 标准物质制备用毒株鉴定和筛选
备用毒株经OIE推荐的常规RT-PCR检测方法鉴定为阳性;测序所得序列经NCBI BLAST与GenBank登录的其他NNV毒株序列比,发现同源性达95%以上。结果表明,所选取的RNA2基因可以有效代表NNV的核苷酸序列,可用于核酸检测标准物质的研制。
2.2 RNA2基因片段扩增
提取NNV病毒RNA,采用表1中的引物,成功扩增RNA2基因序列;扩增产物长度为677 bp,片段大小符合预期(图1)。
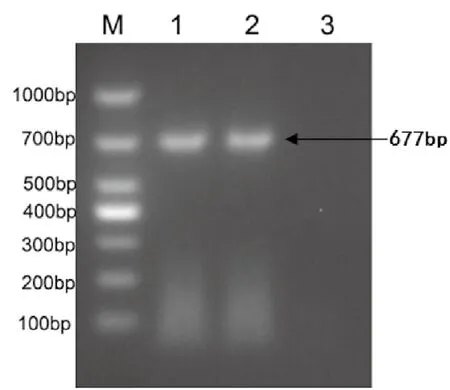
图1 NNV RNA2基因的RT-PCR扩增结果
2.3 RNA2-cRNA纯度及含量
测定RNA2-cRNA 260 nm与280 nm的吸光度值(OD)。OD260/OD280=1.92,表明所获得的cRNA纯度较高。pGEM-RNA2的摩尔质量为2.64×105g/mol;根据公式计算样品的拷贝浓度为8.41×1012copies/μL(表 2)。

表2 RNA2-cRNA纯度及含量
2.4 标准曲线
取稀释成8.41×108~8.41×104copies/μL各浓度梯度的标准物质,每个浓度设2个重复,进行实时荧光定量RT-PCR,测定Ct值。以标准物质拷贝数的对数值为横坐标,以Ct值为纵坐标,绘制标准曲线。由仪器自带软件得出标准曲线的回归方程为Y= -4.327X+52.125,R2=0.958(图2、图3)。
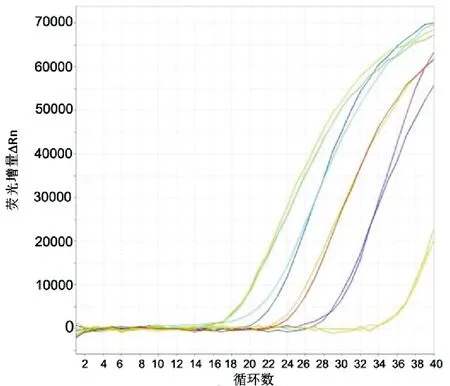
图2 不同稀释度标准物质的扩增曲线
2.5 均匀性检验
采用荧光定量RT-PCR方法,对随机抽取的10支标准样品与混合后的标准样品测定Ct值(图4),并将检测结果进行方差分析(F检验法),计算管间变异系数和批内均匀性。根据给定的显著性水平a与自由度,查表得临界的Fa值,再与两组数据计算所得的F值进行比较。结果显示F<Fa,表明分装的标准物质在组内与组间无明显结果差异,均匀性良好(表3)。
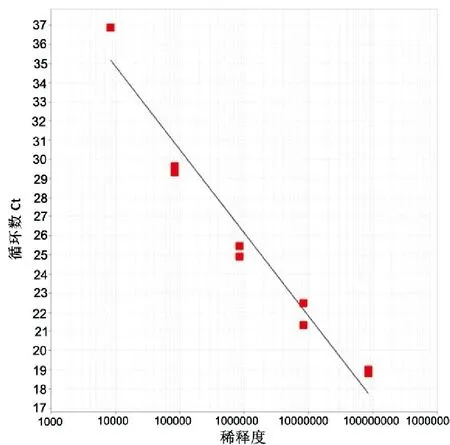
图3 不同稀释度标准物质的标准曲线

图4 RNA2-cRNA标准物质均匀性检验结果
2.6 标准物质稳定性试验
将-80 ℃储存的标准物质作为对照组,其他温度下保存的标准物质作为检测组,在不同温度保存期结束后,随机抽取4支进行荧光RT-PCR试验测定Ct值。将每组数据分别与对照组作“双样本等方差假设”的t检验。因各组P值均>0.05,故其结果差异均无统计学意义(表4),表明各检测组在稳定性监测期内是稳定的。

表3 RNA2-cRNA标准物质均匀性检验方差分析结果
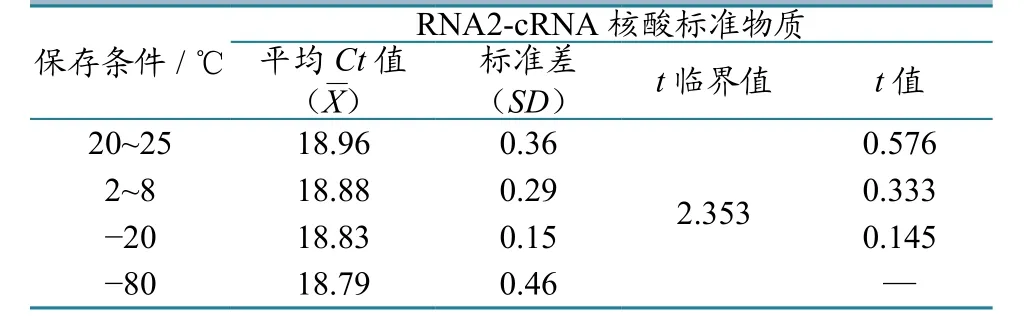
表4 RNA2-cRNA标准物质稳定性t检验统计结果
2.7 标准物质定值检测与协作标定
本次定值采用测定标准物质浓度,根据片段长度换算拷贝数和协作标定的方式,计算标准物质含量(copies/μL)。本研究中共有8家单位参加协作标定。参加单位采用统一的试验设计方案、实施方案和结果分析程序,分别取得3次独立的有效结果。最终取8家单位平均值作为定值结果(表5)。
2.8 标准物质不确定度
通过对实际检测过程进行分析,确定标准品的总不确定度,包括分析测定误差、RNA提取中的误差和样本不均匀性引起的误差。应用A类评定方法进行不确定度分析,经SPSS软件计算的RNA2-cRNA标准物质不确定度为0.068×108copies/μL,定值为(8.452±0.068)×108copies/μL(表5)。

表5 RNA2-cRNA标准物质定值结果
3 讨论
核酸标准物质属于生物分子水平标准物质的一种,是指用于核酸扩增技术的标准物质。世界卫生组织(WHO)1997年首次发布了用于核酸扩增技术的核酸标准物质——丙型肝炎核酸(HCV)、乙型肝炎核酸(HBV)国际标准物质。核酸标准物质在医学领域的某些疾病中应用较成熟。随着分子生物学技术的发展,核酸标准物质应用于动物检疫的报道也越来越多。张桂山等[18]制备了小尾寒羊瘦素长型受体基因实时荧光定量PCR标准品质粒;谷强等[19]对新城疫病毒病毒核酸检测标准物质进行了研究;吴亚琼等[20]和孙涛等[21]分别对亚洲Ⅰ型口蹄疫病毒和O型口蹄疫病毒核酸标准物质进行了制备和研究。核酸标准物质在促进病原核酸扩增检测方法标准化及提高检测一致性和准确性方面发挥了重要作用。
准确性、均匀性与稳定性是标准物质最重要的属性。本研究建立的RNA-cRNA标准物质可作为VNN准确诊断的阳性质控。均匀性检验表明其样品间与样品内无显著差异;稳定性检验表明该标准物质在监测内稳定性良好,符合标准物质要求。
普通RT-PCR和荧光定量RT-PCR是OIE《水生动物疫病诊断手册》中推荐的VNN快速诊断方法。本研究采用体外转录构建基于NNV RNA2基因的RNA标准物质,为VNN的特异性诊断设立了对照。在实际检测中,该标准物质可在扩增检测的逆转录和PCR扩增2个方面进行质量控制,符合RNA病毒检测标准物质的要求[22]。转录的RNA-cRNA片段无生物安全隐患,同时不易出现对实验环境和仪器造成交叉污染而导致的假阳性结果,具有良好的适用性。
4 小结
该定值RNA标准物质为我国VNN检测提供了技术支撑。同时,该标准物质使得VNN诊断中不同方法、设备、试剂、人员间具有了可比性与可溯源性。该标准物质可在我国各检验检疫实验室及各地方水产技术推广站推广应用,可推进我国VNN检测的标准化进程。
[1] YOSHIKOSHI K,INOUE K. Viral nervous necrosis in hatchery-reared larvae and juveniles of Japanese parrotfish,Oplegnathus fasciatus(Temminck &Schlegel)[J]. Journal of fish disease,1990,13:69-77.
[2] MORI K,NAKAI T,NAGAHARA M,et al. A viral disease in hatchery-reared larvae and juveniles of redspotted grouper [J]. Fish pathology,1991,26(4):209-210.
[3] FUKUDA Y,NGUYEN H,FURUHASHI M,et al. Mass mortality of cultured sevenband grouper,Epinephelus septemfasciatus,associated with viral nervous necrosis[J]. Fish pathology,1996,31(3):165-170.
[4] CHI S C,LO C F,KOU G H,et al. Mass mortalities associated with viral nervous necrosis(VNN)disease in two species of hatchery-reared grouper,Epinephelus fuscogutatus and Epinephelus akaara(Temminck &Schlegel)[J]. Journal of fish disease,1997,20(3):185-193.
[5] FRERICHS G N,TWEEDIE A,STARKEY W G,et al.Temperature,pH and electrolyte sensitivity,and heat,UV and disinfectant inactivation of sea bass(Dicentrarchus labrax)neuropathy nodavirus[J]. Aquaculture,2000,185:13-24.
[6] BLOCH B,GRAVNINGEN K,LARSEN J L,et al. Encephalomyelitis among turbot associated with a picornavirus-like agent[J]. Diseases of aquatic organisms,1991,10(1):65-70.
[7] MUNDAY B L,KWANG J,MOODY N,et al.Betanodavirus infections of teleost fish:a review[J].Journal of fish disease,2002,25(3):127-142.
[8] NAKAI T,MORI K,SUGAYA T,et al. Current knowledge on viral nervous necrosis(VNN)and its causative belanodaviruses[J]. Israeli journal of aquaculture-bamidgeh,2009,61(3):198-207.
[9] HEGDE A,TEH H C,LAM T J,et al. Nodavirus infection in freshwater ornamental fish,guppy,Poicelia reticulate-comparative characterization and pathogenicity studies[J]. Archives of virology,2003,148(3):575-586.
[10] WATANABE K,NISHIZAWA T,YOSHIMIZU M,et al.Selection of brood stock candidates of barfin flounder using an ELISA system with recombinant protein of barfin flounder nervous necrosis virus[J]. Diseases of aquatic organisms,2000,41(3):219-223.
[11] IWAMOTO T,YASUSHI O,KAZUYUKI M,et al.Identification of host-specificity determinants in betanodaviruses by using reassortants between striped jack nervous necrosis virus and sevenband grouper nervous necrosis virus[J]. Journal of virology,2004,78(3):1256-1262.
[12] 陈信忠,苏亚玲,龚艳清,等. 逆转录聚合酶链式反应(RT-PCR)检测5种养殖石斑鱼的神经坏死病毒[J]. 中国水产科学,2004,11(3):202-207.
[13] DALLA V,ZANELLA L,PATARNELLO P,et al.Development of a sensitive diagnostic assay for fish nervous necrosis virus based on RT-PCR plus nested PCR[J]. Journal of fish disease,2000,23(5):321-327.
[14] KUO H,WANG T,CHEN P,et al. Real-time quantitative PCR assay for monitoring of nervous necrosis virus infection in grouper aquaculture[J]. Journal of clinic microbiology,2011,49(3):1090-1096.
[15] PANZARIN V,PATARNELLO P,MORI A,et al.Development and validation of a real-time TaqMan PCR assay for the detection of betanodavirus in clinical specimens[J]. Archives of virology,2011,155(8):1193-1203.
[16] NISHIZAWA T,MORI K,NAKAI T,et al. Polymerase chain reaction(PCR)amplification of RNA of striped jack nervous necrosis virus(SJNNV)[J]. Disease of aquatic organisms,1994,18(2):103-107.
[17] GROTMOL S,NERLAND A H,BIERING E,et al. Characterisation of the capsid protein gene from a nodavirus strain affecting the Atlantic halibut Hippoglossus hippoglossus and design an optimal reversetranscriptase polymerase chain reaction(RT-PCR)detection assay[J]. Disease of aquatic organisms,2000,39(2):79-88.
[18] 张桂山,徐晶,娄玉杰,等.小尾寒羊瘦素长型受体基因实时荧光定量PCR标准品质粒和标准曲线的构建[J]. 中国畜牧兽医,2014,41(3):111-114.
[19] 谷强,张伟,高志强,等. 新城疫病毒核酸检测标准物质研究[J]. 中国动物检疫,2012,29(11):40-43.
[20] 吴亚琼,高志强,吴延功,等. 亚洲Ⅰ型口蹄疫病毒核酸检测标准物质的制备研究[J].中国兽医杂志,2012,48(8):8-12.
[21] 孙涛,梁成珠,邓明俊,等. O型口蹄疫病毒核酸检测标准样品的制备[J]. 动物医学进展,2014,35(2):45-50.
[22] 韩永志. 标准物质定值原则和统计学原理[M]. 北京:中国质检出版社,2011:9.

