我国部分主推小麦品种组织培养再生能力评价
张 伟 尹米琦 赵 佩 王 轲 杜丽璞 叶兴国,* 中国农业科学院作物科学研究所 / 农作物基因资源与遗传改良国家重大科学工程, 北京 0008; 广州甘蔗糖业研究所海南甘蔗育种场, 海南三亚 5705
基因工程技术和单倍体技术可以加速小麦新品种培育进程, 改良小麦产量、品质、抗病性和抗逆性等经济性状, 对小麦生产和国民经济发展具有重要意义[1-2]。高频率小麦组织培养再生体系是开展基因工程育种和细胞工程育种的基础[3]。小麦组织培养再生率受基因型、外植体、培养基成分、激素、其他培养条件、材料的生理状态等多个因素的影响[4-11]。其中, 基因型是影响小麦组织培养的内在因素, 对小麦组织培养效率至关重要[1,11-15]。外植体对小麦组织培养的作用仅次于基因型, 目前小麦组织培养中可以获得再生植株的外植体有幼胚、幼穗、成熟胚、花药和小孢子等[16-20]。
研究表明, 小麦花药培养、幼胚培养和成熟胚培养中胚状体形成及植株再生能力受核基因控制[21-23],存在显著的基因型差异, 并定位了几个与愈伤组织形成和胚状体发生关系密切的候选基因[24]。近几年通过花药培养和成熟胚培养, 结合培养技术改进,分别筛选到少数几个适宜花药培养和成熟胚培养的小麦基因型[2]。在花药培养中发现, 一些小麦基因型虽然培养力不高, 但作为亲本之一组配的 F1杂种普遍具有较好的愈伤组织诱导率, 即花药培养力的一般配合力较高[2,11]。综合国内外研究结果, Verry、Alondra、新春9号等小麦基因型具有较高的花药培养再生力, 建议在花培育种和 DH群体构建中选用花药培养再生力较高的基因型作为亲本之一[2,11]。Bobwhite、Fielder、Veery 5等小麦基因型幼胚培养的再生力较高, 所以这几个基因型在小麦遗传转化中被普遍应用[1,25-28]。据统计, 目前小麦遗传转化研究中超过40%的报道采用Bobwhite及其姐妹系作为受体材料[1], Bobwhite等模式小麦基因型虽然组织培养再生性能好, 但其农艺性状较差。例如, 利用Bobwhite为受体获得的抗草甘膦转基因小麦自2003年以来一直处在商业测试阶段[29-30]。另外, 小麦单倍体育种的效率一直非常低, 这与缺乏农艺性状优良、花药培养再生能力高的小麦品种有很大关系[2-3]。因此, 从商业化推广的小麦品种中筛选、评价高再生力的小麦基因型作为转基因育种和单倍体育种的起始材料具有现实性和必要性。
本研究以 2011—2012年全国大面积推广的 24个优良小麦品种和抗白粉病优良品系CB037为材料,连续2年进行花药培养养、幼胚培养和成熟胚培养,分析、评价其 3种外植体的组织培养再生性能, 以期为小麦基因工程育种和单倍体育种提供可以选择的优良基因型, 对于提高小麦基因工程育种效率及单倍体育种效率和加速育成品种的生产应用具有重要意义。
1 材料与方法
1.1 试验材料
选用2011—2012年全国大面积推广的部分优良小麦品种, 包括龙麦30、克丰10、克丰12、宁春4号、新春6号、邯6172、西农979、京冬8号、新冬20、科农199、轮选987、周麦18、周麦22、石4185、中麦 895、烟农 19、济麦 22、郑麦 366、郑麦9023、扬麦16、矮抗58、川麦42、鄂麦18、内麦836, 以及抗白粉病优良新品系CB037, 这些材料均由本课题组收集和保存, 连续 2年秋播种植在中国农业科学院作物科学研究所试验农场, 其中春性小麦品种越冬前覆膜, 除草、打药、灌溉等田间栽培技术措施由试验农场统一管理。
1.2 花药培养
在小麦孕穗期, 取处于单核靠边期的小麦幼穗,用塑料袋包好置4℃冰箱预处理3 d。接种前用70%酒精擦拭茎秆以表面消毒, 在洁净工作台中用镊子剥去颖壳, 取出花药接种在W14愈伤组织诱导培养基上(见附表1), 先在生化培养箱中30℃、黑暗条件下预培养3 d, 然后转到28℃、黑暗下培养30~45 d。将产生的直径 1 mm左右的愈伤组织转移到 1/2 MSNK 分化培养基(见附表 1)上, 在(25±1)℃、70µmol m–2s–1、16 h 光照条件下培养 20~25 d 分化植株[2, 11]。
1.3 幼胚培养
小麦开花授粉后14~15 d, 从田间采集适宜的小麦未成熟麦穗(幼胚发育处于盾片胚前期, 大小约1.0~1.2 mm), 剥取未成熟籽粒, 依次用 70%酒精表面消毒1 min, 15%次氯酸钠灭菌15~20 min, 无菌水冲洗4~5次。用灭过菌的解剖刀在籽粒上切去胚尖,将幼胚取出, 盾片朝上接种在SD2培养基(见附表1)上, 25℃、黑暗条件下培养20~25 d诱导愈伤组织。然后将愈伤组织转移到FHCK培养基(见附表1)上培养20~25 d[3]。分化条件同上。
1.4 成熟胚培养
将小麦干种子依次用70%酒精消毒15 min, 25%次氯酸钠灭菌25 min, 无菌水漂洗3~5次后加少许无菌水浸泡过夜, 第2天再用15%次氯酸钠灭菌15 min, 无菌水漂洗3~5次。无菌条件下用解剖刀将胚反复多次刮成碎片, 接种在 Adi愈伤组织诱导培养基(见附表 1)上, (25±1)℃生化培养箱中暗培养 1周左右, 然后转到IESDI2培养基(见附表1)上暗培养3周, 将产生的愈伤组织转移到 FHCK培养基上进行分化[14]。分化条件同上。
1.5 数据统计与分析
用Microsoft Excel整理数据, 计算不同基因型花药、幼胚、成熟胚的愈伤组织诱导率、愈伤组织分化率和植株再生率, 用LSD法进行基因型间差异显著性分析。利用SAS9.3软件对基因型与3种外植体组织培养特性间的关系, 以及不同外植体组织培养特性间的关系进行相关性分析, 计算Spearman相关系数。
愈伤组织诱导率 = 产生的愈伤组织数/接种外植体数×100; 愈伤组织分化率 = 分化绿芽的愈伤组织数/接种外植体数×100; 绿芽诱导率 = 再生的绿芽总数/接种外植体数×100; 白苗诱导率 = 再生的白芽总数/接种花药数×100。
2 结果与分析
2.1 不同小麦基因型花药培养再生性能评价
供试基因型花药愈伤组织诱导率0.38%~64.19%,愈伤组织分化率为0~39.72%, 绿苗诱导率0~41.75%,基因型间差异极显著(图1)。愈伤组织诱导率超过20%的基因型仅占24%, 其中, 周麦18愈伤组织诱导率最高(图2-A), 达64.19%, 其次为石麦4185(51.08%)、科农199 (39.19%)和 CB037 (30.21%)。愈伤组织分化率大于20%的基因型有 CB037(39.72%)、轮选987 (37.50%)、郑麦366 (29.09%)和川麦42 (25.00%)。
绝大部分基因型绿苗诱导率均小于 5.20%,CB037绿苗诱导率最高(图2-B), 为41.75%, 其次为石麦4185 (38.96%)和邯6172 (15.76%)。另外, 供试小麦基因型花药培养中白化现象严重, 矮抗 58、烟农19、中麦895和克丰10号等品种只分化白苗, 周麦18 (图2-C)、石麦 4185 (图2-D)和科农199等品种的再生白苗比再生绿苗多, 再生白苗率分别为31.24%、63.46%和26.25%。总的来看, CB037、石麦 4185和邯 6172的花药培养愈伤组织诱导率和植株分化率较高, 可作为小麦单倍体育种的亲本材料。
2.2 不同小麦基因型幼胚培养再生性能评价
供试小麦基因型幼胚培养愈伤组织诱导率41.42%~100.00%, 愈伤组织分化率 1.12%~74.6%,绿芽诱导率 2.25%~531.92%, 基因型间存在极显著差异(图3和表1)。除矮抗58外, 其余品种愈伤组织诱导率均大于77%。愈伤组织分化率大于50%的基因型占20%。其中, CB037最高, 其次是轮选987、内麦 836、科农 199和扬麦 16 (表 1)。大部分供试基因型绿苗诱导率大于 40%, 其中绿苗诱导率大于 80%的基因型约占 73%, 绿苗诱导率最高的基因型为CB037 (图3-A), 其次是轮选987、扬麦16 (图3-B)、内麦836、科农 199、新春6号和郑麦366, 极显著高于其他品种(表1)。另外, 郑9023 (图 3-C)、新冬 20、烟农 19和川麦 42绿苗诱导率也较高(81.44%~109.35%), 这些小麦基因型可作为受体材料用于幼胚培养和遗传转化。西农 979、济麦 22、石麦 4185 (图 3-D)虽然容易诱导愈伤, 但形成的愈伤组织质量很差, 绿苗诱导率均小于5%。
2.3 不同小麦基因型成熟胚培养再生性能评价
以成熟胚作为外植体, 供试基因型的愈伤组织分化率介于 5.03%~58.48%之间, 植株再生率介于3.24%~84.34%之间, 基因型间存在极显著差异(图4和表2)。新春6号成熟胚愈伤组织分化率最高, 达84.34%, 其次是科农 199、京冬 8号、CB037、石麦4185、周麦18和鄂麦18, 极显著高于其他基因型; 克丰 10号的愈伤组织分化率最低, 仅 5.03%(表 2)。44%的基因型其植株再生率大于 40%, 以CB037的植株再生率最高(图 4-A), 其次是新春 6号、京冬8号、石麦4185、科农19和轮选987 (图4-B), 而克丰 10号(图 4-C)、克丰 12 (图 4-D)、内麦 836、邯 6172和郑麦 9023再生率较低(表 2)。因此, 建议将CB037、新春6号、京冬8号、石麦4185、科农 199和轮选 987作为成熟胚的遗传转化受体材料。

图1 不同小麦基因型花药培养的愈伤组织诱导率、愈伤组织分化率、绿苗再生率和白化苗再生率Fig. 1 Callus induction rate, differential calli rate, green plantlet regeneration rate, and albino plantlet regeneration rate from anther culture in different wheat genotypes

图2 部分小麦基因型花药愈伤组织诱导和分化情况Fig. 2 Callus induction, differentiation and plantlet regeneration of anther culture of several wheat genotypes
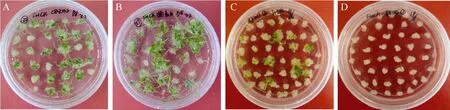
图3 小麦品种CB037 (A)、扬麦16 (B)、郑麦9023 (C)和石麦4185 (D)幼胚培养植株再生情况Fig. 3 Plant regeneration from immature embryos in wheat genotypes CB037 (A), Yangmai 16 (B), Zhengmai 9023 (C), and Shimai 4185 (D)

?
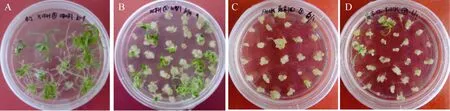
图4 小麦品种CB037 (A)、轮选987 (B)、克丰10 (C)和克丰12 (D)的成熟胚培养植株再生情况Fig. 4 Plant regeneration from the mature embryos of wheat genotypes CB037 (A), Lunxuan 987 (B), Kefeng 10 (C), and Kefeng 12 (D)

表2 不同小麦基因型成熟胚培养愈伤组织分化率和再生率比较Table 2 Callus differentiation and plantlet regeneration from mature embryo tissues in different wheat genotypes
2.4 基因型与3种外植体组织培养特性及不同外植体组织培养特性间的相关性分析
基因型与愈伤组织诱导率、愈伤组织分化率、植株再生率的相关系数分别为0.07、0.31和0.31, 均未达显著水平, 说明基因型与 3种外植体组织培养特性无相关性。不同外植体组织培养特性间, 也未发现显著相关(表3), 表明小麦不同外植体的组织培养再生能力并不对应。

表3 小麦不同外植体组织培养特性间的相关系数Table 3 Correlation coefficient between tissue culture traits of different wheat explants
3 讨论
本研究所用的济麦22、周麦22、西农979、矮抗 58、郑麦 9023、郑麦 366、烟农 19、新冬 20、扬麦16、邯6172等是我国近几年推广面积前15位的冬小麦新品种(年种植面积 26.7万公顷以上), 中麦 895等新品种的推广面积正在逐年扩大: 宁春 4号、新春6号、龙麦30等是推广面积前10位的春小麦新品种(年种植面积4万公顷以上), CB037高抗小麦白粉病、早熟、品质优良, 是小麦杂交育种的优良亲本。利用细胞工程和基因工程途径对这些生产上大面积推广的优良品种进行改良, 将大大加快小麦细胞工程育种和基因工程育种的效率。其中,组织培养再生性能是开展小麦生物技术育种的主要限制因素。
研究结果表明, 小麦各种外植体的组织培养效果主要与所用的基因型有关。107个国外小麦基因型花药培养和幼胚培养的结果证实, 基因型差异明显,花药培养的基因型差异更为显著[12]。3个中国小麦品种(系)不同外植体的再生结果表明, 幼胚培养的培养效率最高, 基因型间差异较小; 花药培养的培养效率其次, 但基因型间差异明显; 幼穗培养的培养效率最低, 分化植株较难[31]。本实验室早期曾对我国部分小麦基因型进行花药培养、幼胚培养和成熟胚培养发现, Verry、Alondra、新春9号、石麦4185、冀5418、百农3217、CA8694等基因型花药培养具有较高的再生率, Bobwhite、中国春、宛 7107、陕7859、宁春4号、京411等基因型花药培养效果较差[2,32]; 扬麦158、扬麦10号、扬麦6号、冀92-16、扬麦 18、科农 199、京冬 8、CB031、新春 9 号、CB037等基因型幼胚培养具有较高的再生率[3,32-33];CB037、轮选987、扬麦6号、邯6172等基因型成熟胚培养具有较高的再生率[14]。基因型在组织培养方面的巨大差异, 暗示离体培养的植株再生受遗传控制。事实上, 在植物中也鉴定了一些与组织培养再生性能相关的基因或蛋白, 如SERK、AGP、NiR、ABP1、LEC1、WUS、Sho等[34]。在小麦中虽然还未克隆到与植株再生关系密切的基因, 但已鉴定一些染色体或染色体区段与花药培养、幼胚培养的再生性状相关[24], 并定位了若干与成熟胚培养再生性能相关的QTL[24], 发现幼胚愈伤组织中过氧化氢酶基因的表达量与植株再生潜力关系密切[24]。另外, 母体植株生长的环境条件、培养方式和培养基添加物对小麦组织培养的影响很大, 母体植株较长的营养生长期, 以及孕穗期较高的温度和充足的光照条件, 有利于花药培养再生植株[2]; 而供体植株开花灌浆后适中的温度条件有利于小麦幼胚培养再生植株, 高温则严重降低幼胚培养后的植株再生[35]。小麦幼胚愈伤组织诱导阶段进行生长素中断处理培养方式明显提高植株再生率[24], 间隔培养方式明显提高培养力较差基因型的植株再生率[33]。在小麦幼胚培养愈伤组织诱导培养基中添加适宜浓度过氧化氢和阿拉伯葡聚糖蛋白, 显著提高了植株再生率[24,33]。
本研究对25个小麦基因型分别进行花药、幼胚、成熟胚培养, 培养效果在基因型间差异极显著, 与前人研究结果基本一致。CB037、石麦4185、邯6172花药培养植株再生率较高, 其中, 石麦4185花药培养再生率与我们之前的研究结果[2]一致, 这 3个小麦材料可作为单倍体育种的亲本之一用来配制杂交组合。国际上有利用小麦花药作为受体获得了转基因植株的成功报道[36], 可尝试将CB037、石麦4185和邯 6172的花药用作小麦遗传转化的受体材料。CB037、轮选987、新春6号、京冬8号、石麦4185、科农 199成熟胚培养植株再生率较高, 其中,CB037、轮选 987是我们之前研究中鉴定的成熟胚培养再生率较高的基因型[14], 其他小麦基因型为本研究新评价出的成熟胚培养再生率较高的基因型。小麦成熟胚取材方便, 不受季节和生理状态的限制,是小麦遗传转化中便利的外植体。利用小麦成熟胚作为遗传转化的外植体, 国内外都有成功的报道[37-38],所以, 本实验鉴定出的成熟胚再生能力较强的小麦材料可作为受体用于成熟胚培养和遗传转化。小麦幼胚的再生性能显著高于成熟胚和花药等外植体,因而在小麦转基因研究中普遍采用[1,28,38-40]。本研究发现, 轮选987、扬麦16、内麦836、科农199、新春6号、郑麦366、郑麦9023、新冬20、烟农19、川麦 42等商业品种和 CB037的幼胚培养比较容易获得再生植株胚, 可以在小麦转基因育种中加以利用。事实上, 最近我们利用轮选 987、扬麦 16、内麦836、科农199、郑麦366、郑麦9023和川麦42的幼胚进行农杆菌转化, 均成功获得了转基因植株,为商业化小麦品种基因工程改良的进一步发展奠定了基础[41]。
本研究还发现, CB037的花药、幼胚和成熟胚3种外植体的植株再生率在所有供试基因型中均为最高; 轮选987、科农199、新春6号, 其幼胚和成熟胚 2种外植体的植株再生率都比较高, 而其花药培养再生率比较低; 石麦4185其花药培养和成熟胚培养的再生率较高, 而幼胚培养的再生率较低; 邯6172仅花药培养再生率较高, 扬麦 16、内麦836、郑麦 366、郑麦 9023、新冬 20、烟农 19、川麦 42等仅幼胚培养再生率较高, 京冬 8号仅成熟胚培养再生率较高。相关分析结果证实, 小麦相同基因型不同外植体的组织培养再生能力不存在相关性。例如, 模式小麦基因型 Bobwhie的幼胚培养能力非常强, 但其花药培养的再生率非常低[2], 可能小麦不同外植体组织培养再生性能的遗传控制不同。
4 结论
小麦组织培养效率与基因型和外植体类型密切相关。25个小麦品种(系)中, CB037的花药、幼胚和成熟胚 3种外植体组织培养植株再生效率均最高;轮选987、扬麦16、内麦836、科农199、新春6号、郑麦366、郑麦9023、新冬20、烟农19和川麦42幼胚培养植株再生能力较强; 新春6号、京冬8号、石麦4185、科农199和轮选987成熟胚培养植株再生率较高; 石麦 4185和邯 6172花药培养绿苗诱导率较高。这些不同外植体再生率较高的小麦基因型可分别用于小麦转基因育种和单倍体育种。
[1]叶兴国, 徐惠君, 杜丽璞, 何光源, 王轲, 林志珊. 小麦规模化转基因技术体系构建及其应用. 中国农业科学, 2014, 47:4155–4171 Ye X G. Xu H J, Du L P, He G Y, Wang K, Lin Z S. Establishment
[2]韩晓峰, 陶丽莉, 殷桂香, 刘晓蕾, 杜丽璞, 魏亦勤, 晏月明,叶兴国. 基因型和环境条件对小麦花药培养效果的影响. 作物学报, 2010, 36: 1209–1215 Han X F, Tao L L, Yin G X, Liu X L, Du L P, Wei Y Q, Yan Y M,Ye X G. Effect of genotype and growing environment on anther culture in wheat. Acta Agron Sin,2010, 36: 1209–1215 (in Chinese with English abstract)
[3]She M Y, Yin G X, Li J R, Li X, Du L P, Ma W J, Ye X G. Efficient Regeneration potential is closely related to auxin exposure time and catalase metabolism during the somatic embryogenesis of immature embryos in Triticum aestivum L. Mol Biotechnol,2013, 54: 451–460
[4]Mathias R J, Fukui K, Law C. Cytoplasmic effects on the tissue culture response of wheat (Triticum aestivum) callus. Theor Appl Genet, 1986, 72: 70–75
[5]He D, Yang Y, Scott K. A comparison of scutellum callus and epiblast callus induction in wheat: the effect of genotype, embryo age and medium. Plant Sci, 1988, 57: 225–233
[6]Stober A, Hessu D. Spike pretreatments, anther culture conditions,and anther culture response of 17 German varieties of spring wheat (Triticum aestivum L.). Plant Breed, 1997, 116: 443–447
[7]Mendoza M G, Kaeppler H F. Auxin and sugar effects on callus induction and plant regeneration frequencies from mature embryos of wheat (Triticum aestivum L.). In Vitro Cell Dev-Pl, 2002,38: 39–45
[8]Varshney A, Altpeter F. Stable transformation and tissue culture response in current European winter wheats (Triticum aestivum L.). Mol Breed, 2002, 8: 295–309
[9]Turhan H, Baser I. Callus induction from mature embryo of winter wheat (Triticum aestivum L.). Asian J Plant Sci, 2004, 3:17–19
[10]Sharma V, Hänsch R, Mendel R, Schulze J. Influence of picloram and thidiazuron on high frequency plant regeneration in elite cultivars of wheat with long term retention of morphogenecity using meristematic shoot segments. Plant Breed, 2005, 124:242–246
[11]叶兴国, 徐惠君, 徐琼芳, 杜丽璞, 李志武. 小麦花药培养力的基因型差异和配合力分析. 中国农业科学, 1997, 30(6):49–54 Ye X G, Xu H J, Xu Q F, Du L P, Li Z W. Genetic analysis and combining ability evaluation of the anther culture response in common wheat. Sci Agric Sin, 1997, 30(6): 49–54 (in Chinese with English abstract)
[12]Machii H, Mizuno H, Hirabayashi T, Li H, Hagio T. Screening wheat genotypes for high callus induction and regeneration capability from anther and immature embryo cultures. Plant Cell, Tiss Org, 1998, 53: 67–74
[13]Shah M, Khalid Q, Khan U, Shah S, Shah S, Hassan A, Pervez A,Oliveira V, Caxito F, Gomes K. Variation in genotypic responses and biochemical analysis of callus induction in cultivated wheat.Genet Mol Res, 2009, 8: 783–793
[14]Yin G X, Wang Y L, She M Y, Du L P, Xu H J, Ma J X, Ye X G.Establishment of a highly efficient regeneration system for the and application of large-scale transformation systems in wheat.Sci Agric Sin, 2014, 47: 4155–4171 (in Chinese with English abstract)

