计算机模拟和光谱法研究头孢他美酯与胃蛋白酶的结合机理
刘保生, 王金菊, 陈 丽, 李志云, 马丽花, 王春丹
(河北大学 化学与环境科学学院, 河北省分析科学技术重点实验室, 国家级化学实验教学示范中心(河北大学), 河北 保定 071002)
1 引 言
头孢他美酯(Cefetamet pivoxil,CFP)为第三代半合成头孢类抗生菌素,对多种β-内酰胺酶稳定,对革兰阳性及阴性菌均有广谱抗菌作用[1]。临床上主要用于各种敏感菌所致的感染,如耳鼻喉、下呼吸道、尿路、皮肤和软组织等[2]。
胃蛋白酶(Pepsin,PEP)分子量大约为35000,是Theodor Schwann在1836年发现的第一个动物酶,属于天冬氨酸蛋白酶之一,是一种消化性蛋白酶[3]。PEP主要由生物体胃粘膜主细胞分泌,能有效地将食物中的蛋白质分解为小的肽片段[4]。PEP可以作为助消化药物,也可以用于蛋白质结构分析。PEP作为人体消化系统中一个重要的蛋白酶,研究药物小分子对PEP结构的影响,对于医学和生物化学均具有重要意义。目前,PEP与药物的相互作用已有文献报道[5-6],但未见研究PEP与CFP之间作用机理的报道。因此,本文采用多种光谱法结合计算机模拟技术研究了不同温度下PEP与CFP之间的结合机理,为CFP的药理活性变化提供了理论依据。本研究有利于在分子层面探讨药物小分子与PEP的相互作用机制,进一步了解PEP的结构和功能关系,为药理毒性、药效的深入研究提供必要数据支持。
2 实 验
2.1 仪器与试剂
仪器:RF-5301PC荧光分光光度计;UV-3600紫外可见分光光度计(日本,岛津);pHS-3C型精密酸度计(上海雷磁仪器厂);MOS-450/SFM300圆二色光谱仪(法国,Bio-Logic公司);SYC-15B型超级恒温水浴(南京桑力电子设备厂)。
试剂:头孢他美酯标准品(CAS#,64485-93-4),分子结构式见图1,配成浓度为1.0×10-3mol/L的水溶液,用时稀释至所需浓度;胃蛋白酶(PEP纯度≥99%,Sigma公司),配成浓度为1.0×10-4mol/L的水溶液;Tris-HCl缓冲溶液(内含0.15mol/L NaCl,pH=7.40)。实验用水为二次石英蒸馏水,溶液均在4℃下避光保存。
实验所测荧光强度均采用内滤光效应公式[7]校正:
Fcor=Fobs×e(Aex+Aem)/2,
(1)
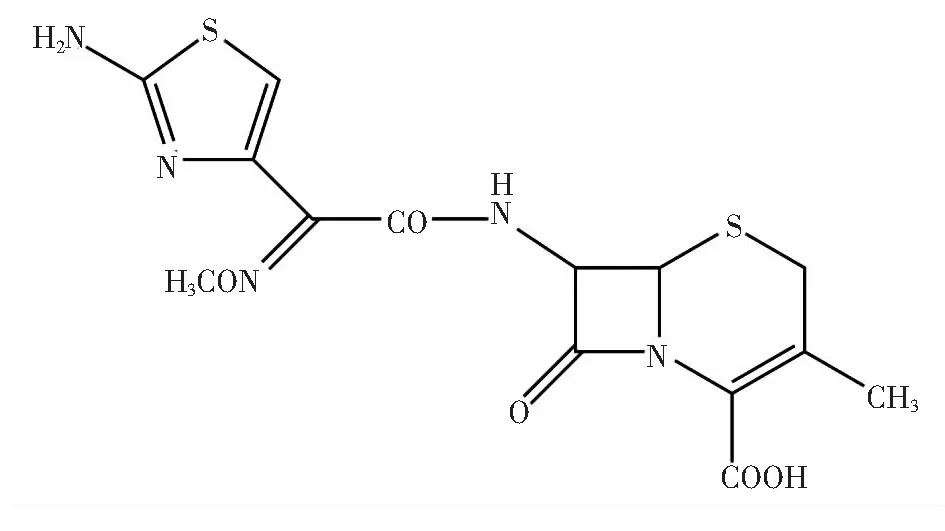
图1 头孢他美酯结构式
式中,Fobs为观察到的PEP-CFP体系荧光强度,Fcor为校正后的PEP-CFP体系荧光强度,Aex为CFP在激发波长处的吸光度值;Aem为CFP在发射波长处的吸光度值。
2.2 实验方法
2.2.1紫外吸收光谱法
在298K温度下,于10mL的比色管中依次加入1.0mL Tris-HCl缓冲溶液、2.0mL1.0×10-5mol/L的PEP溶液和不同体积的CFP溶液,用二次蒸馏水定容至5.0mL,恒温水浴静置30min(体系稳定时间25~60min),用相应浓度的CFP溶液作参比,测定PEP-CFP体系的吸光度,并绘制体系的紫外吸光度谱图。
2.2.2荧光猝灭法与同步荧光法
在298,303,310K下,于一系列10mL比色管中依次加入1.0mL Tris-HCl缓冲溶液、1.0mL1.0×10-5mol/L的PEP溶液及不同体积的CFP溶液,用二次蒸馏水定容至5.0mL,在恒温水浴中放置30min。将配好的溶液置于1cm石英荧光池中,设定激发与发射狭缝宽度为5nm,固定激发波长λex=280nm或295nm,分别扫描PEP-CFP体系的荧光光谱。同步荧光法按以上操作方法,固定波长差Δλ=15,60nm记录PEP-CFP体系的同步荧光光谱。
2.2.3圆二色谱法
在298K温度下,将1.0mL Tris-HCl缓冲溶液、1.0mL1.0×10-4mol/L的PEP和不同浓度的CFP溶液依次加入10mL比色管中,用二次蒸馏水定容至5.0mL,摇匀,在恒温水浴静置30min,使用1mm石英池,记录190~300nm范围内的PEP-CFP体系的圆二色谱图。
2.2.4分子模拟
PEP的晶体结构(PDB ID:5PEP)来自蛋白数据库(Protein data bank),CFP的结构式在ChemDraw Pro14.0软件中绘制,同时在ChemBio3D Ultra14.0软件中对其三维结构进行能量最小化。最后使用AutoDock4.2.6软件对CFP和PEP进行分子对接,采用遗传算法来计算与蛋白质结合的药物分子的可能构象[8]。
3 结果与讨论
3.1 PEP-CFP体系的紫外光谱
图2为PEP-CFP体系的紫外光谱图,PEP在205nm和280nm处有两个吸收峰,205nm处的吸收峰是n-π*跃迁导致的,280nm处的吸收峰主要是由PEP中氨基酸残基芳杂环π-π*跃迁所引起的[9]。由图2可知,随着药物CFP的浓度增加,205nm处的吸收峰降低并发生红移,280nm处吸收峰增加且发生蓝移,这说明CFP的加入改变了PEP的构象,PEP与药物CFP间形成了新的复合物。
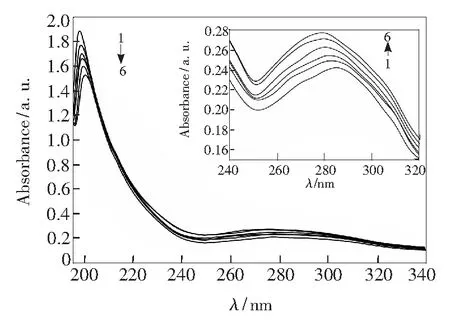
CPEP=4.0×10-6mol/L,1~6:CCFP=(0,1.0,4.0,6.0,10.0,20.0)×10-5mol/L
图2PEP-CFP体系的紫外吸收光谱 (T=298K )
Fig.2Absorption spectra of PEP-CFP system (T=298K)
3.2 PEP-CFP体系的荧光光谱
298K时CFP对PEP荧光光谱的影响见图3(a)(λex=295nm时的荧光光谱与其类似),图3(b)为PEP的激发光谱图,由图3(a)可知溶液中CFP浓度的不断增加使PEP在340nm左右的荧光逐渐减弱,表明CFP与PEP之间存在相互作用。将猝灭数据按Stern-Volmer方程[10]处理:
I0/I=1+Kqτ0[L]=1+Ksv[L] ,
(2)
式中,I0、I分别为PEP溶液加入CFP前后的荧光强度,Kq为猝灭速率常数,[L]为猝灭剂的浓度,τ0为PEP分子荧光平均寿命(约为10-8s),Ksv为Stern-Volmer猝灭常数。计算结果见表1。由表1可知,Kq值在不同温度下均大于2.0×1010L·mol-1·s-1,且随温度升高,Ksv减小,表明PEP-CFP体系的结合过程是静态猝灭过程[11]。用方程(3)[12]计算结合常数Ka和结合位点数n:
(3)
其中,[Dt]为CFP的总浓度,[Bt]为PEP的总浓度。以lg(I0/I-1)对lg{[Dt]-n[Bt](1-I/I0)}作图,根据曲线截距、斜率,得到体系的Ka以及n,结果见表1。由表1可知,n值均约为1,且温度升高,Ka随之减小,进一步诠释了CFP与PEP的作用属于静态猝灭[13]。当λex=280nm时,可同时激发色氨酸(Trp)和酪氨酸(Tyr)残基的荧光;当λex=295nm时,仅激发Trp残基的荧光。由表1数据可以看出,同一温度下,λex=280nm时的Ka值明显大于λex=295nm时的Ka值,说明PEP与CFP间的结合位点来源于Tyr和Trp残基。

CPEP=2.0×10-6mol/L,1~10:CCFP= (0,0.2,0.4,0.6,2.0,3.0,4.0,5.0,6.0,8.0)×10-5mol/L
图3PEP-CFP的(λex=280nm)发射光谱(a)与PEP的激发光谱(b)
Fig.3Fluorescence emission spectra of PEP-CFP (λex=280nm) (a) and fluorescence excitation spectrum of PEP (b)
3.3 PEP-CFP体系的构象研究
同步荧光光谱能够提供蛋白质荧光团的微环境信息,可以更加简单有效地来测量荧光猝灭和最大发射波长可能发生的变化[14]。当Δλ=15,60nm时,同步荧光光谱分别反映出Tyr残基、Trp残基的光谱信息[15]。图4为298K时的PEP-CFP

表1 不同温度下CFP-PEP体系的猝灭反应参数
r1为方程I0/I~[L]的线性相关系数;r2为方程lg[(I0-I)/I]~lg{[Dt]-n[Bt](I0-I)/I0}的线性相关系数。
体系的同步荧光光谱,由图4可知,随着CFP浓度的不断增大,Tyr残基和Trp残基的荧光均被猝灭,荧光峰明显发生红移。峰位置的改变说明CFP与PEP的相互作用改变了Trp和Tyr所在的微环境[16]。由于Trp和Tyr微环境的改变使得PEP腔内疏水环境的极性增强,疏水性减弱,导致肽链变得松散,最终导致PEP的构象发生了改变。

CPEP=2.0×10-6mol/L, 1~10:CCFP= (0, 0.2, 0.4, 0.6, 2.0, 3.0, 4.0, 5.0, 6.0, 8.0)×10-5mol/L
图4 PEP-CFP体系的同步荧光光谱。(a)Δλ=15 nm; (b)Δλ=60 nm。
Fig.4 Fluorescence spectrum of PEP-CFP system. (a)Δλ=15 nm. (b)Δλ=60 nm.
圆二色谱法(CD)被广泛用来测定蛋白质二级结构。PEP-CFP体系的CD谱如图5所示。由图5可知,在205 nm处有一个负的特征峰,为PEP中α-螺旋结构的特征峰[17]。当PEP与CFP的浓度比为1∶4和1∶8时,负峰逐渐减弱但峰位置和峰形没有明显变化,表明PEP二级结构中的α-螺旋结构逐渐减少。通过计算可知,CFP的加入使得PEP的α-螺旋结构从15.37%降低到12.83%。以上结果表明在CFP作用下,PEP中的α-螺旋结构变得松散且蛋白的二级结构也随之发生改变,从而使得PEP荧光被猝灭,但是α-螺旋结构仍占主导地位[18]。
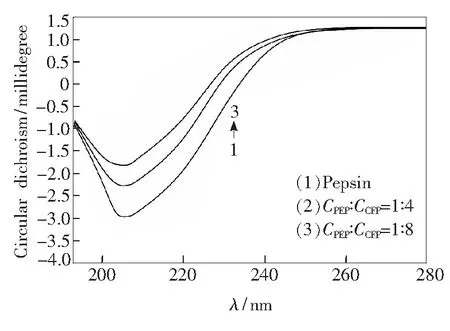
CPEP = 2.0×10-5 mol/L; CCFP = (0.8, 1.6)×10-4 mol/L
Fig.5 Circular dichroism spectra of PEP-CFP system (T=298 K)
3.4 PEP-CFP体系的作用力类型及体系的结合距离
CFP和PEP结合反应的作用力类型可以根据CFP与PEP相互作用的热力学参数进行推断,ΔG、ΔS、ΔH等热力学参数可由以下公式[19-20]得出:
RlnK=ΔS-ΔH/T,
(4)
ΔG=ΔH-TΔS,
(5)
计算结果见表2。由表2可知,ΔG<0,说明CFP对PEP的猝灭反应能自发进行;ΔH<0,ΔS>0,表明CFP与PEP间以静电引力方式相互结合形成CFP-PEP复合物[21]。

表2 不同温度下CFP-PEP体系的热力学参数(λex=280 nm)
根据Förster非辐射能量转移理论[22],PEP与CFP之间的结合距离r、能量转移效率E以及临界能量转移距离R0(对应E=50%)三者的计算方程如下[23]:
(6)
(7)
(8)
其中,F0为PEP的荧光强度,F为PEP和CFP浓度为1∶1时的荧光强度;K2为取向因子,取PEP与CFP各向随机分布的平均值2/3;N是溶剂的折射率,取水和有机物的平均值1.336;Φ为当无CFP存在时PEP的荧光量子产率,取PEP中色氨酸残基的量子产率0.118[24];J为PEP的荧光发射光谱和CFP的紫外吸收光谱的重叠积分;F(λ)、ε(λ)分别为在波长λ处PEP的荧光强度和CFP的摩尔吸光系数。计算所得PEP-CFP体系的结合参数见表3。从表3可以看出:r<7 nm,说明CFP与PEP间存在非辐射能量转移,使得PEP与CFP更容易发生能量传递[25]。此外,随着温度的升高,E值逐渐降低且r值逐渐增大,导致了PEP-CFP体系的结合稳定性降低,结合常数减小,更进一步说明CFP与PEP之间存在静态猝灭方式的相互作用。
表3不同温度下PEP-CFP体系之间的结合参数
Tab.3 Binding parameters between PEP-CFP system at different temperatures

T/KE/%J/(cm3·L·mol-1)R0/nmr/nm2984.516.31×10-152.333.893034.176.18×10-152.323.913103.636.04×10-152.313.99
3.5 CFP的蛋白结合率
当蛋白与药物结合达到平衡时,溶液中的蛋白主要有两种存在形式:一部分以结合型蛋白存在,另一部分以游离型蛋白存在。在结合位点数n=1时,CFP的蛋白结合率(W)公式如下[26]:
W=
(9)
KaR[B0]W2-(KaR[B0]+Ka[B0]+1)W+
Ka[B0]=0,
(10)
式中,R为CFP与蛋白总浓度的比值。其中,蛋白浓度约为1.0×10-3mol/L,CFP浓度在1.0×10-7~1.0×10-3mol/L之间。利用实验所得的Ka值和公式(9)分别计算λex=280 nm时,298,303,310 K温度下CFP的蛋白结合率,结果分别为77.03%~93.60%、76.24%~93.11%、74.73%~92.13%。根据方程(10)绘制了结合率W与浓度比R的曲线图,如图6所示。
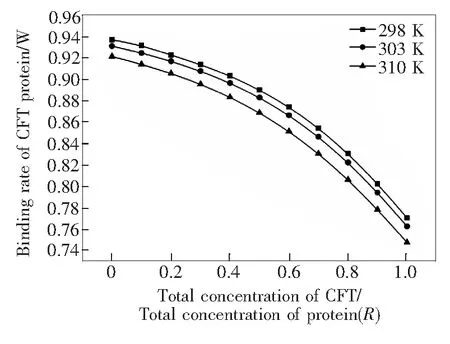
图6 不同温度下的CFP蛋白结合率(λex=280 nm)
Fig.6 Binding rate of CFP to protein in different temperature (λex=280 nm)
对310 K时的曲线进行非线性拟合得到方程:y=-0.13798x2-0.03236x+0.91914,r=0.999 3,即W=-0.13798R2-0.03236R+0.91914。
由图6和上述方程可知,当体系中的蛋白浓度恒定不变时,随药物CFP的浓度不断增大,其蛋白结合率逐渐降低。该研究为临床合理用药提供了重要的参考价值。
3.6 计算机模拟
计算机模拟技术广泛地应用于分析蛋白与配体之间的相互作用,其目的主要是寻找底物分子和受体分子间的最佳结合位置[27]。PEP由327个氨基酸残基组成,在结构上,因含有Tyr、Trp和苯丙氨酸(Phe)而具有内源荧光[28]。PEP的二级结构有4个能明显区分的区域,其中第一个区域是由6条反向平行链所组成的β-折叠结构,从而形成了分子的骨架。β-折叠的形成进一步确立了PEP的催化活性位点[29]。通过分子对接软件选取了PEP与药物CFP最佳的结合位置,将对接数据处理可知,CFP与PEP的结合能ΔG为-23.88kJ/mol,这一结果与实验所得的热力学参数ΔG=-23.76 kJ/mol非常接近,从而更进一步证明CFP与PEP之间的相互作用。
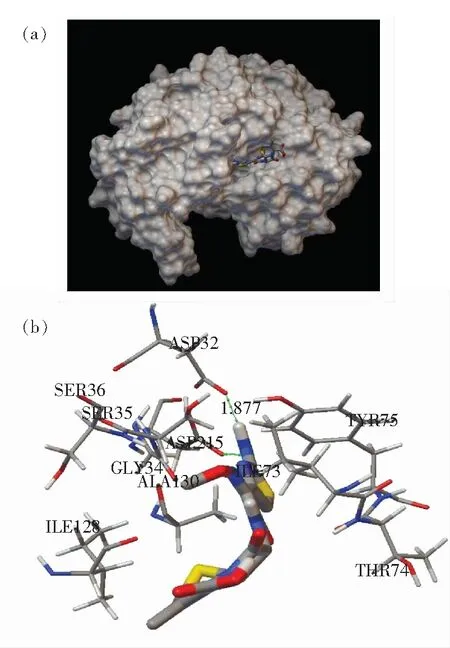
图7 CFP与PEP相互作用的分子对接图。 (a) CFP与PEP发生作用区域;(b) CFP与PEP活化中心发生作用的氨基酸残基。
Fig.7 Computation docking model of the interaction between CFP and PEP. (a)Binding site in the PEP cavity. (b) Detailed illustration of the amino acid residues lining the binding sitein the PEP cavity.
图7为CFP与PEP分子对接最佳构象图,呈现出CFP药物分子周围的各种氨基酸残基,CFP分子被氨基酸残基Ser36、Asp215、Ile128、Ser35、Ile73、Asp32、Tyr75、Gly34、Thr74和Ala130所包围。这一结果表明,CFP与PEP之间的作用力主要以静电引力为主。这些氨基酸残基中含有发色基团(Tyr75),当CFP进入到PEP的疏水腔时,此时发色基团的微环境必然会受到影响,进一步说明CFP能有效地猝灭PEP的内源荧光。
由图7还可发现,CFP与Asp32和Asp215形成氢键,键长分别为0.187 7 nm和0.219 5 nm,表明CFP与PEP之间还存在氢键作用力。因此,计算机模拟建立的分子对接结果说明CFP与PEP之间主要是静电引力作用同时还存在氢键作用力,CFP进入到PEP的疏水腔中改变了其周围氨基酸残基的微环境,因而造成PEP的荧光猝灭。
3.7 PEP与CFP相互作用的标准曲线
按照实验方法,在298 K时加入不同浓度的CFP,考察体系荧光强度差值ΔF(ΔF=F0-F,其中F0、F分别为PEP、CFP-PEP体系的荧光强度值)与CFP浓度c的关系。结果表明:CFP浓度在2.0×10-6~ 8.0×10-5mol/L范围内与ΔF呈现良好的线性关系,线性回归方程为ΔF=4.41×106c(mol/L)+27.3,相关系数r=0.997 4。按3σ/K求得该方法的检出限为1.86×10-7mol/L(n=11),表明利用CFP对PEP的荧光猝灭反应,可以实现对实际药品中CFP含量的快速测定。
4 结 论
通过多种光谱法以及计算机模拟技术对CFP与PEP的相互作用进行了详细的研究。结果表明,CFP和PEP结合使PEP内源荧光发生有规律的静态猝灭,且该过程伴有非辐射能量转移发生。CD谱图显示CFP可以改变PEP的微环境,使其二级结构发生改变。热力学方程得到的热力学参数与分子对接结果相符,进一步表明CFP与PEP的结合模式主要是静电引力作用。该研究为药物的研究发展提供了理论依据。
[1] WANG W, ZHU X M, WANG C M,etal.. Pharmacokinetics and pharmacodynamics of oral and intravenous cefetamet in dog [J].Eur.J.DrugMetab.Pharmacok., 2015, 40(4):401-407.
[2] NOH K, KIM E, KANG W. Quantitative determination of cefetamet in human plasma by liquid chromatography-mass spectrometry [J].Biomed.Chromatog., 2011, 25(7):779-782.
[3] ASZMANN O C. The life and work of theodore schwann [J].J.Reconstrut.Microsurg., 2000, 16(4):291-295.
[4] GOLE A, DASH C, RAO M,etal.. Encapsulation and biocatalytic activity of the enzyme pepsin in fatty lipid films by selective electrostatic interactions [J].Chem.Commun., 2000, 16(4):297-298.
[5] 王艺润, 方庆, 郭晨辉, 等. 光谱法和分子对接模拟技术研究托拉塞米与胃蛋白酶和胰蛋白酶的相互作用 [J]. 光谱学与光谱分析, 2016, 36(10):3414-3421.
WANG Y R, FANG Q, GUO C H,etal.. Probing the binding of torasemide to pepsin and trypsin by spectroscopic and molecular docking methods [J].Spectrosc.Spect.Anal., 2016, 36(10):3414-3421. (in Chinese)
[6] 廉淑芹, 杨冬芝, 郑笑笑, 等. 应用荧光光度法研究加替沙星与胃蛋白酶的相互作用 [J]. 理化检验:化学分册, 2013, 49(3):253-255.
LIAN S Q, YANG D Z, ZHENG X X,etal.. Study on interaction of gatifloxacin with pepsin by fluorospectrophotometry [J].PTCA(Part B:Chem.Anal.), 2013, 49(3):253-255. (in Chinese)
[7] WANG Q, HE J W, YAN J,etal.. Spectroscopy and docking simulations of the interaction between lochnericine and bovine serum albumin [J].Luminescence, 2015, 30(2):240-246.
[8] 王公轲, 闫长领, 卢秀敏, 等. 盐酸环丙沙星与胰蛋白酶相互作用的光谱和分子模拟研究 [J]. 化学学报, 2009, 67(17):1967-1972.
WANG G K, YAN C L, LU X M,etal.. Study on the interaction of ciprofloxacin hydrochloride with trypsin by spectroscopic and molecular modeling methods [J].ActaChim.Sinica, 2009, 67(17):1967-1972. (in Chinese)
[9] ZHU S Z, LIU Y. Spectroscopic analyses on interaction of naphazoline hydrochloride with bovine serum albumin [J].Spectrochim.ActaA, 2012, 98:142-147.
[10] LIU Y Y, ZHANG G W, LIAO Y J,etal.. Binding characteristics of psoralen with trypsin: Insights from spectroscopic and molecular modeling studies [J].Spectrochim.ActaA, 2015, 151:498-505.
[11] TIAN Z Y, ZANG F L, LUO W,etal.. Spectroscopic study on the interaction between mononaphthalimide spermidine (MINS) and bovine serum albumin(BSA) [J].J.Photochem.Photobiol. B, 2015, 142:103-109.
[12] BI S Y, DING L, TIAN Y,etal.. Investigation of the interaction between flavonoids and human serum albumin [J].J.Mol.Struct., 2004, 703(1-3):37-45.
[13] 亓培培, 訾言勤. 头孢他啶与胃蛋白酶相互作用的研究 [J]. 分析化学进展, 2017, 7(1):39-47.
QI P P, ZI Y Q. Investigation on interaction of ceftazidime with pepsin [J].Anal.Chem.Adv., 2017, 7(1):39-47. (in Chinese)
[14] ZHANG H M, CAO J, FEI Z H,etal.. Investigation on the interaction behavior between bisphenol A and pepsin by spectral and docking studies [J].J.Mol.Struct., 2012, 1021(4):34-39.
[15] ZHANG G W, CHEN X X, GUO J B,etal.. Spectroscopic investigation of the interaction between chrysin and bovine serum albumin [J].J.Mol.Struct., 2009, 921(1-3):346-351.
[16] QU L B, CHEN X L, YANG R,etal.. Investigation of the interaction between isoflavonoids and bovine serum albumin by fluorescence spectroscopy [J].Chin.J.Chem., 2007, 25(8):1151-1155.
[17] ZENG H J, YANG D, HU G Z,etal.. Studies on the binding of pepsin with three pyrethroid insecticides by multi-spectroscopic approaches and molecular docking [J].J.Mol.Recognit., 2016, 29(10):476-484.
[18] 崔萌萌, 刘保生, 李彤彤, 等. 头孢噻肟钠、转铁蛋白相互作用的光谱特征 [J]. 发光学报, 2016, 37(11):1415-1421.
CUI M M, LIU B S, LI T T,etal.. Spectral properties of the interaction between transferrin and cefotaxime sodium [J].Chin.J.Lumin., 2016, 37(11):1415-1421. (in Chinese)
[19] MOMENI L, SHAREGHI B, SABOURY A A,etal.. A spectroscopic and thermal stability study on the interaction between putrescine and bovine trypsin [J].Int.J.Biol.Macromol., 2017, 94:145-153.
[20] 陆从文, 兰秀风, 张林, 等. 依巴斯汀与牛血清蛋白相互作用的荧光光谱研究 [J]. 光子学报, 2015, 44(10):1030004-1030009.
LU C W, LAN X F, ZHANG L,etal.. Interaction between ebastine and bovine serum albumin by fluorescence spectroscopy [J].ActaPhoton.Sinica, 2015, 44(10):1030004-1030009. (in Chinese)
[21] ZENG H J, LIANG H L, YOU J,etal.. Study on the binding of chlorogenic acid to pepsin by spectral and molecular docking [J].Luminescence, 2014, 29(7):715-721.
[22] KABOUDIN B, MORADI K, FAGHIHI M R,etal.. The fluorescence spectroscopic studies on the interaction of novel aminophosphinic acids with bovine serum albumin [J].J.Lumin., 2013, 139(7):104-112.
[23] ZHAO X C, LIU R T, TENG Y,etal.. The interaction between Ag+and bovine serum albumin: a spectroscopic investigation [J].Sci.TotalEnviron., 2011, 409(5):892-897.
[24] LI Z, LI Z G, YANG L L,etal.. investigation of the binding between pepsin and nucleoside analogs by spectroscopy and molecular simulation [J].J.Fluoresc., 2015, 25(2):451-463.
[25] SHEN L L, XU H, HUANG F W,etal.. Investigation on interaction between ligupurpuroside A and pepsin by spectroscopic and docking methods [J].Spectrochim.ActaA, 2015, 135(7):256-263.
[26] MATSUI H, OKUDA T. Penetration of cefpiramide and cefazolin into peritoneal capsular fluid in rabbits [J].Antimicrob.Agents.Chemother., 1988, 32(1):33-36.
[27] 贾悦, 杨洪芹, 郭刘奇, 等. 头孢克肟与胃蛋白酶相互作用的光谱法研究 [J]. 化学研究与应用, 2016, 28(5):673-680.
JIA Y, YANG H Q, GUO L Q,etal.. Investigation of interaction between cefixime and pepsin by spectroscopic methods [J].Chem.Res.App., 2016, 28(5):673-680. (in Chinese)
[28] 曾华金, 李梦婷, 李晴, 等. 光谱法结合分子模拟技术研究左氧氟沙星与胃蛋白酶的相互作用机理 [J]. 发光学报, 2016, 37(4):481-486.
ZENG H J, LI M T, LI Q,etal.. Mechanism of interaction between levofloxacin and pepsin by spectroscopic and molecular docking methods [J].Chin.J.Lumin., 2016, 37(4):481-486. (in Chinese)
[29] ZHANG H M, CAO J, FEI Z H,etal.. Investigation on the interaction behavior between bisphenol A and pepsin by spectral and docking studies [J].J.Mol.Struct., 2012, 1021(4):34-39.

