长期摄入NDMA超标腊肠对大鼠肝脏损害的研究
容敏贤,邱月升,王佩,王艺苑,邓红
(南方医科大学公共卫生学院营养与食品卫生学系,广东广州510515)
腊肠、咸鱼等动物性腌制食品是我国居民喜食的一类加工肉制品,但其食用安全性越来越引起人们的关注。2016年中国膳食指南提出[1]少吃烟熏和腌制肉制品的建议。2015年10月26日,国际癌症研究机构发表声明[2],将红肉和加工肉制品分别列为很可能的致癌物(2A类)和致癌物(1类)。大量的流行病学调查发现[3-7],经常吃动物性腌制食品会增加肝癌、食管癌、胃癌、结肠直肠癌等消化系统肿瘤的风险,并分析很可能与 N-亚硝基化合物(N-nitroso compounds,NOCS)及其前体物、苯并芘(BaP)等致癌物质摄入增加有关。早在1956年,Magee等[8]将二甲基亚硝胺(N-nitrosodimethylamine,NDMA)含量为 50 mg/kg的饲料喂养大鼠一年,几乎全部发生肝癌,揭示了亚硝胺类物质的致癌性;Nichols等[9]用NDMA超标的咸鱼喂养大鼠2年,发现实验组肝癌发病率显著高于喂食普通饲料组。
近年来,我国加强了对腌肉制品中NOCS及其前体物污染的监测,有调查发现,我国市售腊肠及腌肉制品 NDMA 检出率较高[10-13],且含量超标(>3 μg/kg)现象不容忽视[13];参照美国农业部关于肉制品总挥发性亚硝胺限量标准(≤10 μg/kg),我国腌肉制品中总挥发性亚硝胺超标也不容忽视[12-13]。目前,有关腌肉制品中NOCS及其前体物的研究主要集中在相关污染物的检测方法建立、含量检测及降低污染等方面,而NOCS及其前体物污染食品摄入后对机体健康危害报道很少,主要是流行病学研究结果,如Yun Zhu等的病例对照研究显示,腌肉品中NDMA与结直肠癌的发生相关[14];多项动物毒理学实验证明,NDMA作用靶器官是肝脏、有强烈的肝脏毒性[15-16],但长期摄入NOCS及其前体物污染腌肉制品对健康的危害尤其是肝脏的潜在危害报道很少。本研究采用长期腊肠喂养动物实验,利用饮水中含NDMA建立长期低剂量摄入NDMA致大鼠肝脏损害模型(肝炎-肝纤维化-肝硬化-肝癌),比较同期摄入NDMA超标与不超标腊肠的大鼠肝脏损害情况,旨在研究长期摄入不同数量、不同NDMA污染程度腊肠对机体肝脏的损害,探索其损害机制,为我国腌制食品安全监管以及膳食指导提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
SPF级雄性SD大鼠购于南方医科大学实验动物中心(许可证号:SCXK(粤)2011-0015),平均体重(200.8±23.9)g。
1.1.2 主要试剂与仪器
二甲基亚硝胺(N-nitrosodimethylamine,NDMA,99.0%分子式C2H6N20):TCl(Tokoyo)公司;4%多聚甲醛:北京索莱宝(Solarbio)科技有限公司;水合氯醛(分析纯);血清总蛋白(Total protein,TP)、白蛋白(Albumin,ALB)、天门冬氨基转移酶(Aspartate aminotransferase,AST)、丙氨酶氨基转移酶(Alanine aminotransferase,ALT)、碱性磷酸酶(Alkaline phosphatase,ALP):南京建成生物工程研究所;TGL-16MS台式高速冷冻离心机:上海卢湘仪离心机仪器有限公司;Epoch2微孔 板 分 光 光 度 计 :BioTek Instruments,Inc.USA;UV752(UV752N)紫外可见分光光度计:上海佑科仪器仪表有限公司;OLYMPUSVANOX PM-10AD型显微照相仪:日本OLYMPUS公司。
1.2 方法
1.2.1 实验动物分组及饲养
207只雄性SD大鼠饲养在SPF级动物实验室中,12 h昼夜循环,室温(20±2)℃,相对湿度 40%~60%,3只/标准饲养笼。适应性喂养2周后,实验动物随机分为三大组:普通饲料对照组(control group,CON)33只,NDMA造模组75只和腊肠组(Sausage,S)99只。腊肠组又分为3个亚组,分别为18%普通腊肠对照组(S1组)、18%腊肠NDMA超标组(S2组)和36%腊肠NDMA超标组(S3组),每组各33只。除采血和处死前12小时禁食外,大鼠自由获取食物和饮水。
1.2.2 饲料配制
在综合考虑营养成分以及加工方式具有可比性的基础上,选择两种腊肠NDMA的含量分别为7.37 μg/kg(超过我国食品安全卫生标准3 μg/kg[17])和1.13 μg/kg(未超标)制作大鼠饲料。根据文献[18],用含1.13 μg/kg NDMA的腊肠加工制作了含18%腊肠的1号饲料,用含7.37 μg/kg NDMA的腊肠分别制作了含18%腊肠的2号饲料和含36%腊肠的3号饲料。这3种饲料与AIN-93G饲料在营养成分上无明显差别(表1)。饲料委托广东省医学实验动物中心制作,真空包装,钴60辐照灭菌,4℃避光冷藏保存。实验过程中,CON组和NDMA组给予AIN-93G标准饲料,S1组、S2组、S3组分别给予1、2、3号饲料,连续饲养33周,每天记录大鼠的饮水量,每周称量体重和摄食量,并做好记录。
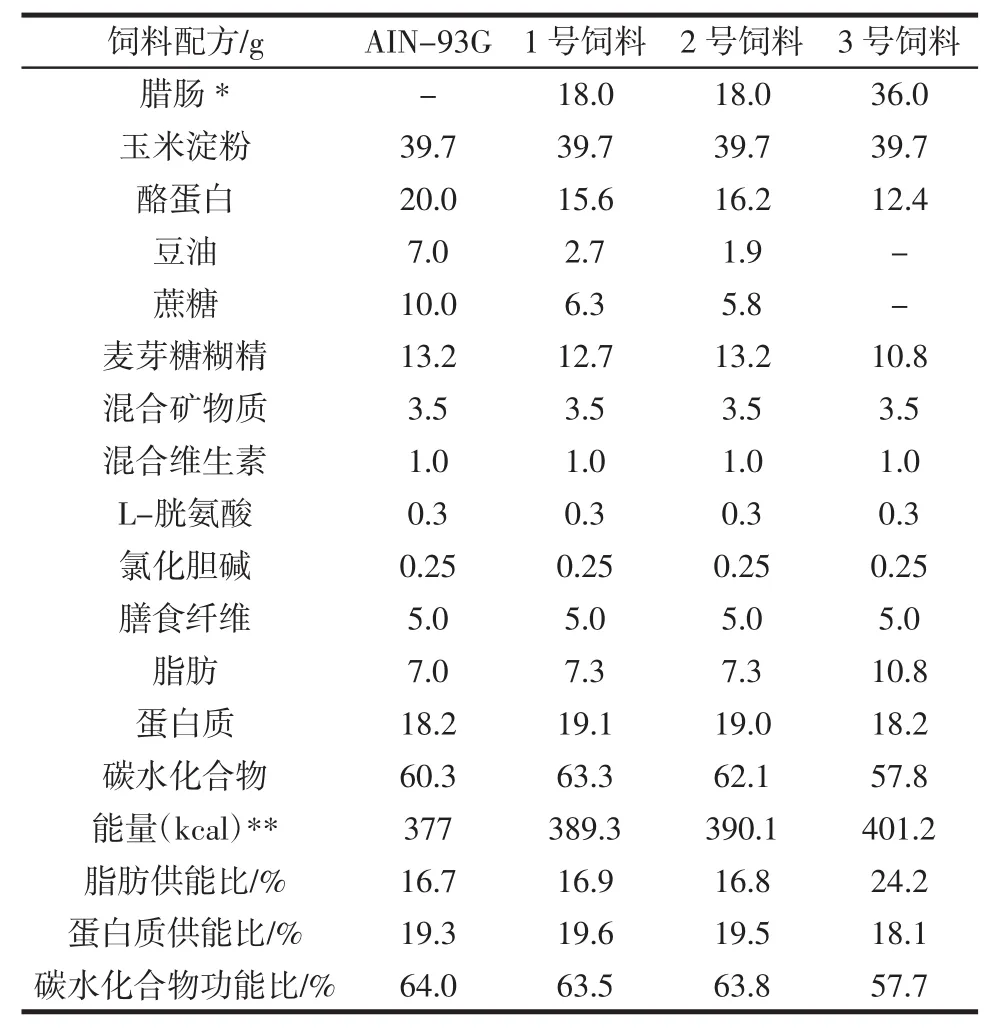
表1 大鼠饲料配方/100 gTable 1 Ingredients of rat diets per 100 g
1.2.3 NDMA造模及实验大鼠肝脏损害研究
NDMA造模组利用饮用含NDMA的饮用水,建立实验大鼠肝脏损害模型。根据预实验,给予含30 μg/kg的NDMA饮用水,成功建立实验大鼠从肝炎、肝纤维化、肝硬化直至肝癌的动物模型。
腊肠组和CON组整个实验过程均给予灭菌自来水;NDMA组给予含30 μg/kg NDMA饮用水,任其自由饮用12周后改为灭菌自来水。NDMA组分别在2、4、6、8、10、12、16、20、24、28、32 周时各处死 3 只大鼠,进行病理检查并根据病理结果,在NDMA组大鼠出现肝炎-肝纤维化-肝硬化-肝癌时(图2),分别立即处死同期饲养的腊肠组和CON组大鼠各8只,收集肝脏组织检查。
1.2.4 肝功能生化指标检测
在实验过程中,分别在第7、17、25、33周时每组各处死大鼠8只。大鼠空腹12h,在10%水合氯醛(0.4mL/100g体重)麻醉下经腹主动脉采血,室温静置1 h~2 h后,3 500 r/min离心15 min,取上清于EP管-80℃保存备用。TP、ALB、AST、ALT、ALP 肝功能生化指标根据试剂盒说明进行测定,其中球蛋白(GLB)含量=TP-ALB。
1.2.5 病理学检查
摘取肝脏组织,肉眼观察肝脏有无颜色变化、充血、水肿、硬化、癌结节等病变,并进行肝脏称重;剪取肝组织及肿瘤样本1 cm×1 cm大小块置于4%的多聚甲醛溶液中,固定24 h,石蜡包埋,制备5 μm切片,HE染色,光镜下观察大鼠肝脏组织病理变化。参照史黛丝·E·米尔斯等[19]编写的病理医生实用组织学(第四版)里面的病理诊断标准进行半定量定性分析。
1.2.6 数据分析
利用Excel建立数据库,计量数据以均数±标准差。采用SPSS 20.0软件进行统计学分析。多组间比较采用单因素方差分析,进行组间两两比较,方差齐时采用LSD-T检验法,P<0.05差异有统计学意义。
2 结果与分析
2.1 大鼠一般情况
实验期间,除NDMA组,CON组和各腊肠组大鼠的饮水、摄食正常,无脱毛、上呼吸道感染等不良状况。NDMA组大鼠在实验期间摄食量、饮水量及体重变化较其他4组不同,3周之后,其饮水量低于其他各组,差异有统计学意义(P<0.05),在31周之后,其摄食量显著低于其他各组(P<0.05)(结果未列出)。喂养至第16周,NDMA组大鼠的体重显著低于CON组和各腊肠组(P<0.01);CON组和各腊肠组大鼠在整个喂养期间体重增长符合规律,各组体重无差异(图1),说明喂食腊肠饲料对大鼠的体重影响不大。
2.2 NDMA造模组肝脏检查结果

图1 不同时间段各实验组大鼠的体重Fig.1 Body weights of rats were measured during the experiment
在NDMA组大鼠病理检查出现典型肝炎(7周)、肝纤维化(17周)、肝硬化(25周)以及肝癌阶段(33周)。肉眼观察肝脏,分别为表面光滑、色红、质地稍硬见图2 A-1;肝脏肿大、色暗红、质地变硬见图2 A-2;出现数量不等、大小不一的小米粒大小黄白色斑点样病灶图2 A-3以及在肝癌(33周)阶段可见散在大小不等的灰白色癌结节,直径大小约为1 cm~1.5 cm图2 A-4。
大鼠肝脏典型病理切片结果见图2 B。肝炎期(7周)汇管区及肝小叶内较多淋巴细胞浸润,少量肝细胞溶解性坏死(图2 B-1);肝纤维化期(17周)可见多个肝细胞嗜酸性及溶解性坏死,汇管区及肝小叶内较大量淋巴细胞浸润并可见纤维组织增生(图2 B-2);肝硬化期(25周)形成肝细胞增生结节,结节内肝细胞异型性较小,有典型假小叶结构,伴有肝细胞索排列紊乱,肝细胞变性、坏死,小叶中央静脉缺如(图2 B-3);肝癌期(33周)可见出现癌细胞分化较好,呈梁索状或团块型排列,边界不清,向周围肝组织浸润,部分区域出血、坏死,癌细胞呈现多形性,异型性明显(图2 B-4)。病理结果显示NDMA诱导肝脏损伤模型造模成功。

图2 不同时间段NDMA模型组大鼠肝脏大体观察及病理切片图Fig.2 General observation and pathological section of liver tissue of NDMA model rats at different time
2.3 长期摄入腊肠对大鼠肝脏组织的影响
2.3.1 肝功能生化指标分析
血清中 TP、ALB、AST、ALT、ALP 等指标是衡量肝功能重要指标。ALB主要由肝细胞合成,血清ALB含量降低提示可能存在肝功能受损;由于肝脏有很强的代偿能力以及ALB半衰期较长等原因,只有当肝脏损害达到一定程度时才能并发血清TP、ALB的变化,因此血清TP和ALB检测大都用在反映慢性肝损害,并可反映肝实质细胞的储备功能见图3。

图3 各实验组大鼠血清生化指标水平Fig.3 The level of different serum chemistry parameters of each group during the experiment
由图3可知,与同期喂养的CON组相比,S2、S3、NDMA 组大鼠血清ALB显著下降(P<0.05),NDMA组显著TP下降(P<0.001);而随腊肠喂养时间延长,同组大鼠血清TP表现为下降趋势,但差异无统计学意义(P>0.05)。
AST、ALT、ALP 均是细胞中的胞质酶,AST、ALT主要存在于肝细胞内,ALP来源广泛,以肝细胞中最多。当肝细胞受损时,AST、ALT、ALP释放到血液里中,导致AST、ALT、ALP水平升高,尤其ALT水平,可以比较敏感地监测到肝脏是否受到损害。由图3可知,与同期喂养的CON组相比,腊肠喂养组AST、ALT呈增加趋势,且7周,S3大鼠血清AST、ALT显著增加(P<0.05);在第 33 周,大鼠血清 AST、ALT、ALP 从 CON→S1→S2→S3依次升高,但差异不显著(P>0.05);各检测时间点NDMA组的AST、ALT、ALP均显著增加(P<0.05)。以上结果提示肝细胞可能存在一定程度的损伤,尤其是NDMA组,肝细胞受损严重,该结果与后面的病理结果相一致。
2.3.2 肝脏指数及大体标本观察
动物脏器指数反映受试动物的营养状况和内脏变化情况。与CON组相比,NDMA组大鼠的肝脏指数在肝炎(7周)、肝纤维化阶段(17周)变化不大,但进入肝硬化(25周)和肝癌期(33周)显著低于其他四组,且随着喂养时间延长,肝脏指数减小,提示NDMA对大鼠肝脏的损害加重;各腊肠组大鼠的肝脏指数与CON组相比无明显差异见表2。
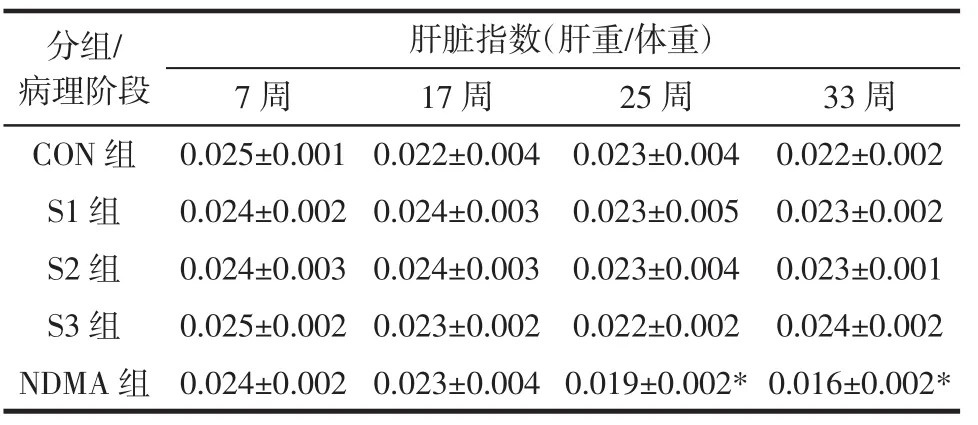
表2 各实验组大鼠肝脏指数变化Table 2 The liver coefficients of each group during the experiment
肝脏肉眼观察,CON组及S1组在整个实验期间肝脏颜色和形态正常;随着喂养时间延长,S2组、S3组大鼠肝脏体积增大,饱满圆钝,质地稍硬;第25周观察到S2组肝脏质地变硬,色暗红,且S3组变化较S2组明显。提示S2组、S3组大鼠肝脏可能存在损害,具体情况需进一步病理检查。
2.3.3 病理检查结果
2.3.3.1 肝脏病理切片光镜观察
显微镜检结果显示,CON组肝组织形态均基本正常,仅在第33周出现部分肝小叶少量淋巴细胞浸润(图4 A)。而NDMA组随着实验进程,肝脏出现相应的病理改变(具体结果见2.2及图2 B)。
腊肠喂养组大鼠的肝脏病理改变与腊肠喂养时间、腊肠中NDMA的污染程度及摄入NDMA量等有关。S1组在第7周、17周未见病理改变(图4 B-1、B-2),在第25周出现轻微炎症改变,肝血窦轻微扩张,汇管区及肝小叶内极少量淋巴细胞浸润(图4 B-3);同期的S2组大鼠肝脏病理改变比S1组严重,出现了典型的肝炎,肝血窦中度扩张,汇管区及肝小叶内少量淋巴细胞浸润,个别细胞水肿(图4 C-3),而S3病理改变更重,出现了肝细胞脂肪变性、汇管区及肝小叶周围纤维组织增生(图4 D-3)。进入第33周,S3组肝脏病理损害进一步加重,出现大量肝细胞脂肪变性和汇管区、肝小叶淋巴细胞浸润,大量汇管区及肝小叶周围纤维组织增生(图4 D-4),但整个实验周期(33周)未观察到肝癌病理改变。

图4 各组在不同实验阶段大鼠肝病理学观察(光镜下),HE染色(×400)Fig.4 Pathological observation of each group at different experimental stages(light microscope),HE staining(×400)
2.3.3.2 肝脏组织病理切片评分
根据病理诊断标准[19]进一步对肝脏病理结果进行半定量定性分析,肝炎评分、肝纤维化评分越高,肝脏受损程度越严重。从表3可以看出,从S1组→S2组→S3组→NDMA组,同期肝炎评分增加,并随实验时间增加而增高;S2、S3、NDMA组从第7周开始,各个时间点的肝炎评分显著高于同期的CON组(P<0.05)(表3)。S1组仅在第33周稍高于CON组,差异有统计学意义(表3),提示尽管S1组大鼠饲料中添加腊肠中NDMA不超标,但腊肠在腌制、烟熏或者高温加热过程中还可能产生亚硝胺之外的其他有害物质,如苯并芘(BaP)、杂环胺、过氧化物[20]等,也可能导致机体尤其是肝脏损害,因此,腌肉制品不宜长期食用。NDMA组肝纤维化评分最高,自第17周显著高于CON组;腊肠组仅S3组呈增高趋势,在第33周高于CON组 (P<0.05);S1、S2组在整个实验间肝纤维化评分接近0分(P>0.05)。
肝炎、肝纤维化评分结果提示,腊肠喂养时间、腊肠中NDMA的污染程度、NDMA摄入量与大鼠的肝脏损伤密切相关。长期腊肠摄入对大鼠肝脏造成损伤主要由于摄入过量的NDMA所致,随着NDMA污染腊肠摄入时间的延长,大鼠肝脏的损害加重。
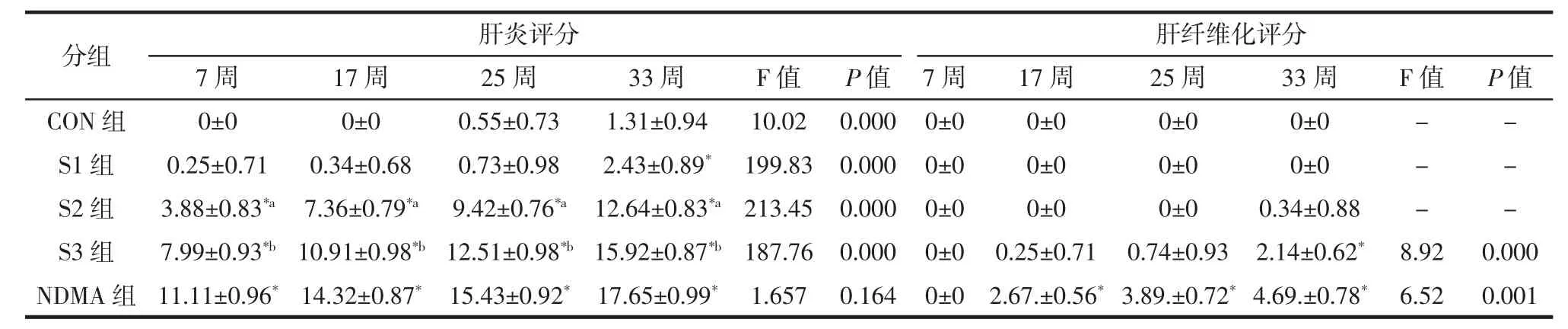
表3 第7、17、25、33周各组大鼠肝组织病理切片评分情况Table 3 Pathological score of rat liver tissue of each group after feeding 7,17,25,33 weeks
3 结论
本研究采用长期喂养大鼠NDMA含量不同的3种腊肠饲料33周,观察长期摄入腊肠对大鼠肝脏的病理损害。结果显示,NDMA造模组分别在第7、17、25、33周观察到大鼠肝炎、肝纤维化、肝硬化、肝癌的肝脏损伤特征,提示NDMA诱导肝脏损伤模型成功。长期腊肠摄入对大鼠一般状况以及肝脏指数影响不大,但对血清 TP、ALB,AST、ALT、ALP 水平有一定影响,并与同期肝脏病理检查结果基本一致。整个33周实验期间S1组肝脏病理改变不明显,但第25周S2组出现了典型的肝炎病变,而同期S3组出现了肝纤维化病变,至第33周S3组肝脏病理损害进一步加重。肝炎评分从S1组→S2组→S3组→NDMA组增高,且各组的肝炎评分随实验时间增加而增高,S2、S3组从第7周开始,各个时间点的肝炎评分显著高于同期的CON组。
本研究结果提示,长期摄入NDMA污染腊肠导致大鼠肝脏损害,损害程度与腊肠中NDMA是否超标及喂养时间有关,该结果与国内外相关研究报道一致,应加强对腌肉制品中NOCs污染的安全监管。本研究为进一步探索腌制食品与肝损伤机制提供了实验依据。
[1] 中国营养学会.中国居民膳食指南(2016版)[M].北京:人民卫生出版社,2016:11,87-92
[2] IARC.IARC Monographs evaluate consumption of red meat and processed meat[R].cm World Health organization,2015
[3] LARSSON S C,NICOLA O.Red Meat and Processed Meat Consumption and All-Cause Mortality:A Meta-Analysis[J].American Journal of Epidemiology,2014,179(3):179,282-289
[4] LI F,DUAN F,ZHAO X,et al.Red Meat and Processed Meat Consumption and Nasopharyngeal Carcinoma Risk:A Dose-response Meta-analysis of Observational Studies[J].Nutr Cancer,2016,68(6):1034-1043
[5]De STEFANI E,BOFFETTA P,RONCO A L,et al.Processed meat consumption and squamous cell carcinoma of the oesophagus in a large case-control study in Uruguay[J].Asian Pac J Cancer Prev,2014,15(14):5829-5833
[6]MCCULLOUGH M L,GAPSTUR S M,SHAH R,et al.Association between red and processed meat intake and mortality among colorectal cancer survivors[J].J Clin Oncol,2013,31(22):2773-2782
[7]FEDIRKO V,TRICHOPOLOU A,BAMIA C,et al.Consumption of fish and meats and risk of hepatocellular carcinoma:the European Prospective Investigation into Cancer and Nutrition (EPIC)[J].Annals of Oncology,2013,24(8):2166-2173
[8] MAGEE P N,BARNES J M.The production of malignant primary hepatic tumours in the rat by feeding dimethylnitrosamine[J].Br J Cancer,1956,10(1):114-122
[9] YU M C,NICHOLS P W,ZOU X N,et al.Induction of malignant nasal cavity tumours in Wistar rats fed Chinese salted fish[J].Br J Cancer,1989,60(2):198-201
[10]魏法山,徐幸莲,周光宏.如皋火腿中挥发性N-亚硝胺种类和含量分析[J].食品科学,2008,29(5):400-404
[11]LI L,WANG P,XU X,et al.Influence of various cooking methods on the concentrations of volatile N-nitrosamines and biogenic amines in dry-cured sausages[J].J Food Sci,2012,77(5):560-565
[12]李玲,徐幸莲,周光宏.气质联用检测传统中式香肠中的9种挥发性亚硝胺[J].食品科学,2013,34(14):241-244
[13]Pei W,Weijun Y,Q Y,et al.Levels of Nine Volatile N-Nitrosamines in Chinese-Style Sausages as Determined by Quechers-Based Gas Chromatography-Tandem Mass Spectrometry[J].Ann Public Health Res,2016,3(4):1049
[14]ZHU Y,WANG P P,ZHAO J,et al.Dietary N-nitroso compounds and risk of colorectal cancer:a case-control study in Newfoundland and Labrador and Ontario,Canada[J].Br J Nutr,2014,111(6):1109-1117
[15]RAJEWSKY M F,DAUBER W,FRANKENBERG H.Liver carcinogenesis by diethylnitrosamine in the rat[J].Science,1966,152(3718):83-85
[16]BAKIRIL,WAGNEREF.Mousemodelsfor liver cancer[J].Mol Oncol,2013,7(2):206-223
[17]中华人民共和国卫生部.GB2762-2012中华人民共和国国家标准食品安全国家标准食品中污染物限量[S].北京:中国标准出版社,2012
[18]YU M C,NICHOLS P W,ZOU X N,et al.Induction of malignant nasal cavity tumours in Wistar rats fed Chinese salted fish[J].Br J Cancer,1989,60(2):198-201
[19]史黛丝.E.米尔斯,薛德彬,陈健,等.病理医生实用组织学(第四版)[M].北京:北京科学技术出版社,2017:928-929
[20]郭晏同,冷希圣,赵景明,等.过氧化物酶体增殖物激活受体γ配体对诱导大鼠肝癌的抑制作用[J].中华肝脏病杂志,2005,13(2):145-146

