半胱氨酸/纳米金修饰电极差分脉冲伏安法测定芦丁
黄玉斌,严春荣,王齐
(1.玉溪市质量技术监督综合检测中心,云南玉溪653100;2.昆明理工大学分析测试研究中心,云南昆明650000;3.云南省分析测试中心,云南昆明650000)
芦丁(Rutin)又名芸香苷,普遍存在于植物的根、茎、叶、花、果实、种子中,是一种具有生物活性的重要黄酮类物质[1]。其分子中的α、β不饱和吡喃酮是各种生物活性的关键基团,而A、B、C三环的各种取代基则决定了其特定的药效作用,从而决定了其不同生物活性。经过大量的研究表明,芦丁具有抗炎、抗病毒、镇痛、抗氧化、抗癌抗肿瘤、抑制醛糖还原酶活性和治疗毛细血管通透性增高引起的出血症等功效,并且对器官缺血损伤也有保护与修复作用[2]。芦丁的以上性质,使其成为许多中成药试剂或保健食品的重要性指标组分,因此研究简便、快捷、高效、准确的检测方法具有实际意义。芦丁分子结构式见图1。
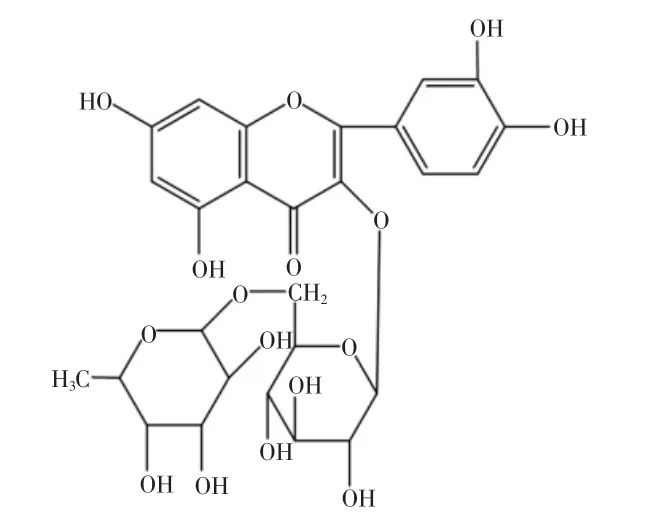
图1 芦丁分子结构式Fig.1 Chemical structure of rutin
目前芦丁的检测方法主要是高效液相色谱法和分光光度法,其中高效液相色谱法是一种比较准确的分离、定量测定方法[3-4],但是其具有庞大的色谱分离系统、较高仪器与试剂成本的缺点;而紫外分光光度法在实际样品测定中,经常会受到共存还原性组分或样品自身空白的影响,使测定结果比实际含量偏高30%~100%以上[5]。如何简便、高效地对复杂体系中芦丁含量进行定量分析,成为分析工作者的难题。近十年来,电化学分析法利用物质在特定电极上氧化还原电位的不同,建立起了多种测定微、痕量物质的方法,如循环伏安法、差分脉冲伏安法、溶出伏安法等[6-10],在未对物质进行预分离的情况下,这些方法对复杂体系中某一组分的定量测定有很好的效果。
本研究利用半胱氨酸分子在金表面和金纳米的自组装性质,制备了一种多层结构的修饰电极,研究了芦丁分子在修饰电极上的电化学性质,并利用芦丁分子在修饰电极上的差分脉冲伏安响应信号,建立了一种高灵敏度测定芦丁含量的方法。
1 材料与方法
1.1 仪器与试剂
CHI660C电化学工作站、电化学测量采用三电极体系、金圆盘电极(φ=2mm)、饱和甘汞参比电极、铂丝辅助电极:美国CHI公司;Milli-Q Element超纯水系统:美国Millipore公司;SK3300H超声波清洗仪:中国科导公司。
L-半胱氨酸(>98.5%)、氯金酸(HAuCl4,99%):Aldrich公司;甲醇、柠檬酸、磷酸、浓硫酸(均为分析纯):Aladdin公司。
1.2 Au纳米微粒的制备
Au纳米微粒的制备采用简单的Frens法[11-13],即在100 mL沸水中加入30 mg柠檬酸,在搅拌加热下缓慢滴加入2 mL 0.5 mg/mL HAuCl4,反应30 min后立即用冰水浴冷却至室温后4℃保存。
1.3 修饰电极的制备
电极的预处理:将金圆盘电极在金相砂纸上打磨,再依次用 0.3、0.1、0.05 μm Al2O3粉抛光,用水超声清洗数分钟后取出清洗;再置于0.5 mol/L稀H2SO4溶液中以10 V/s扫描速度在-0.5 V~2.0 V的电位范围内进行循环伏安扫描10 min,即为裸金电极(NAu)。
修饰电极的自组装过程:将预处理好的NAu电极置于0.01 mol/L L-半胱氨酸水溶液中进行自组装6 h后取出、用水超声清洗5 min,为L-半胱氨酸修饰电极(NAu/C);制备好的NAu/C电极再次放入Au纳米微粒溶液中自组装6 h后取出、用水清洗,为金纳米微粒修饰电极(NAu/C/Au);将NAu/C/Au电极再次放入0.01 mol/L L-半胱氨酸水溶液中进行自组装6 h后取出用水清洗,为二次L-半胱氨酸修饰电极(NAu/C/Au/C)。制备的修饰电极浸泡在水中4℃保存。
1.4 标准溶液和样品的制备
准确称取芦丁标准品10.0 mg,用适量甲醇及pH 6.8的磷酸缓冲溶液溶解定容至50 mL,得200.0 μg/mL芦丁标准储备液,再分别吸取若干用pH 6.8的磷酸缓冲溶液定容至 50mL,得到浓度分别为 6.0、8.0、10.0、12.0、14.0、16.0、18.0、20.0 μg/mL 的芦丁标准工作溶液。
准确称取约0.10 g精制苦荞茶用适量甲醇及pH 6.8的磷酸缓冲溶液超声溶解,经滤纸过滤定容于250 mL容量瓶中,待测。
1.5 试验方法
以修饰电极为工作电极,记录-0.2 V~0.6 V范围内的差分脉冲伏安(Differential Pulse Voltammetry,DPV)信号,其试验参数为:脉冲幅度50mV、脉冲宽度0.05 s、采样宽度0.016 s、脉冲周期0.2 s、静置时间为2 s。
2 结果与讨论
2.1 修饰电极的自组装过程
本试验所制备的Au纳米微粒为酒红色胶体溶液,其紫外可见吸收见图2,吸收峰波长约为530 nm,与文献报道相一致[11];经高分辨TEM(图2)表征发现,Au纳米微粒为球型微粒,纳米微粒半径为(8±2)nm,且能观察到清晰的晶格线条纹,说明本试验所制备的Au纳米微粒晶体生长较完整。
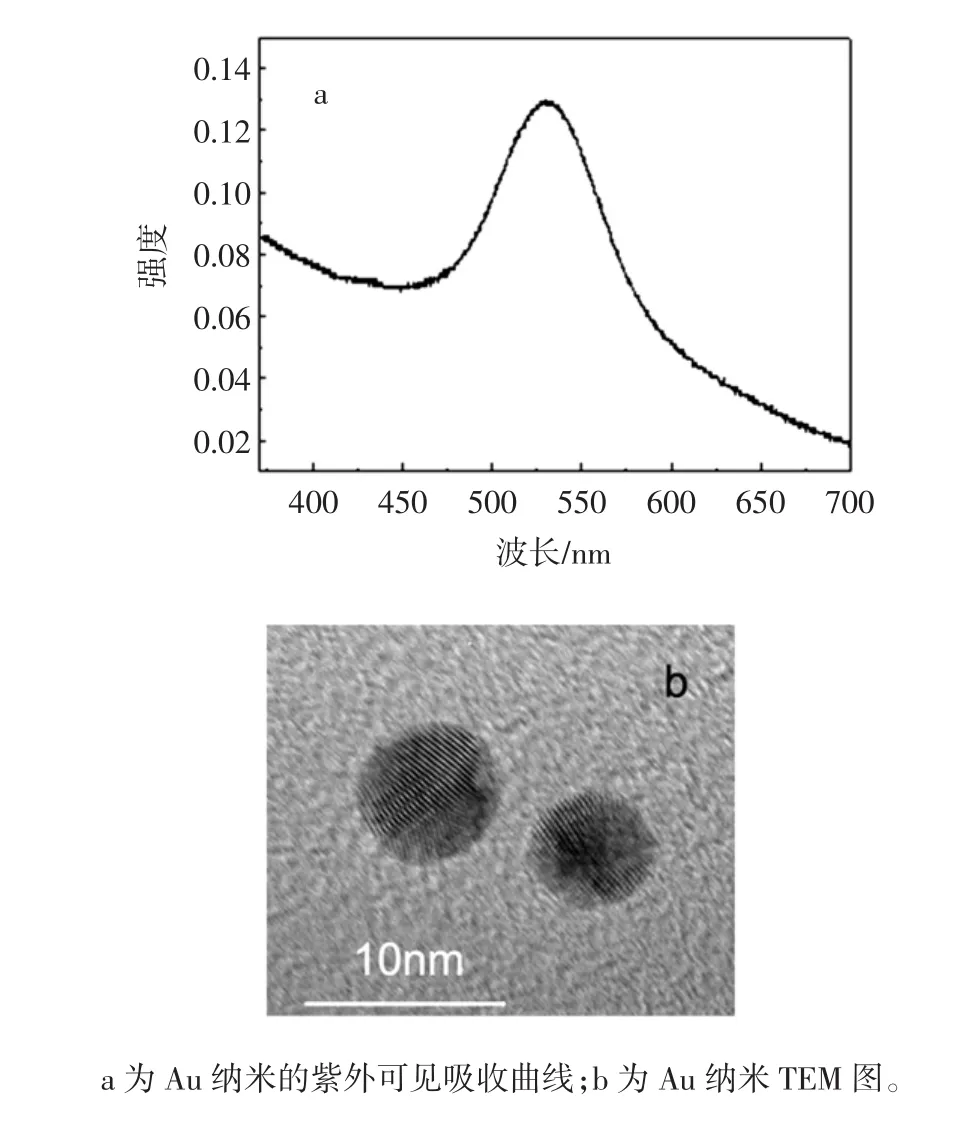
图2 Au纳米微粒的光学与形貌表征Fig.2 The optical characteristic and morphology of Au nanoparticles
在电极的自组装过程中,半胱氨酸分子首先通过巯基与裸Au电极表面的相互作用,定向自组装在裸Au电极的表面;半胱氨酸分子的氨基再通过静电作用力与表面带负电荷的Au纳米微粒相互作用,使Au纳米微粒自组装在半胱氨酸分子表面;最终半胱氨酸分子再通过巯基自组装于Au纳米微粒表面,形成一种典型的多层结构修饰电极,其组装示意图见图3。
2.2 芦丁在修饰电极上的电化学行为
图4为芦丁分子在NAu/C修饰电极上的循环伏安曲线图。
在0.1 V~0.4 V之间出现一对明显的氧化还原峰。芦丁是一种重要的黄酮类物质,其抗氧化活性成分主要来源于芦丁分子结构上苯环羟基。在pH 6.8的磷酸缓冲溶液中,扫描循环伏安过程时,芦丁分子B环上的3’,4’-取代羟基发生两电子两质子氧化还原反应,进一步发生电子重排[9-10,13],此氧化还原反应对应于循环伏安曲线中的0.21 V还原电位峰和0.26 V氧化电位峰。
然而,芦丁分子在NAu/C修饰电极上的循环伏安氧化还原电位峰很弱,对芦丁的信号响应灵敏度很低。为了提高响应灵敏度,继续考察了芦丁分子在修饰电极上的差分脉冲伏安(DPV)信号响应,结果见图5。

图3 修饰电极的自组装示意图Fig.3 Schematic illustration of the modified electrode fabrication process

图4 芦丁分子在NAu/C修饰电极上的循环伏安曲线图Fig.4 Cyclic vohammograms of rutin on the NAu/C modified electrode
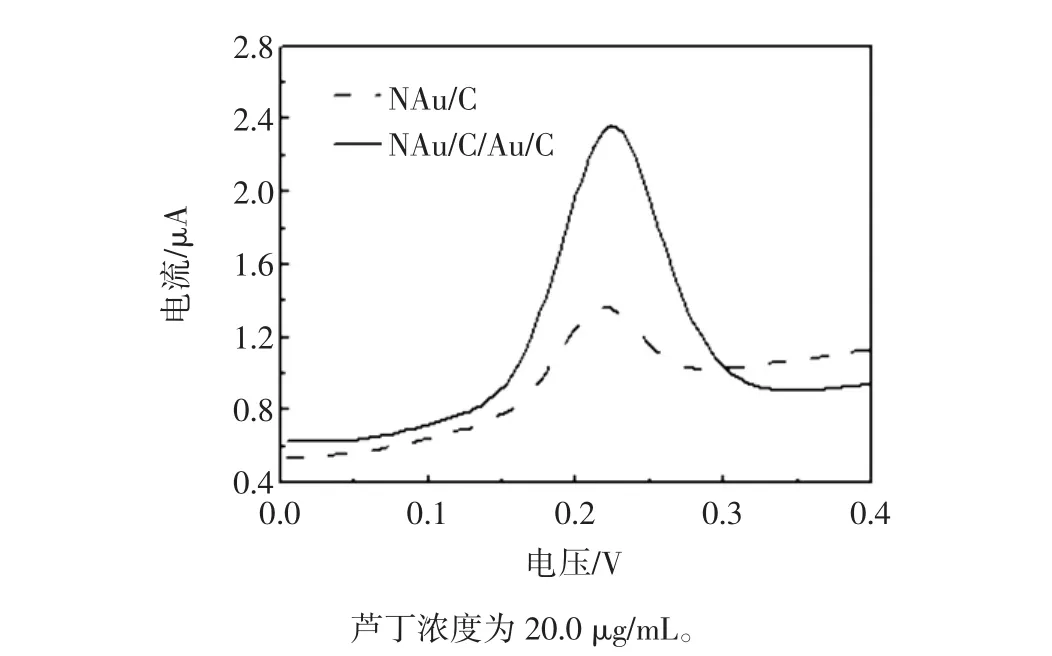
图5 芦丁分子在NAu/C和NAu/C/Au/C修饰电极上的差分脉冲伏安图Fig.5 DPV of the NAu/C and NAu/C/Au/C modified electrode
在pH 6.8的磷酸缓冲溶液中,芦丁分子在NAu/C修饰电极上通过差分脉冲伏安扫描出现了位于0.23 V处的氧化峰,并且随着电极的进一步修饰,在NAu/C/Au/C多层修饰电极上,0.23 V处的氧化峰信号进一步增强。这是由于具有大比表面积Au纳米微粒对电极的多层修饰,增加了氧化还原反应位点,提高了修饰电极对芦丁分子响应灵敏度。
2.3 差分脉冲伏安法对芦丁的定量测定
在pH 6.8的磷酸缓冲溶液中,对不同浓度的芦丁采集了DPV电化学信号如图6所示。
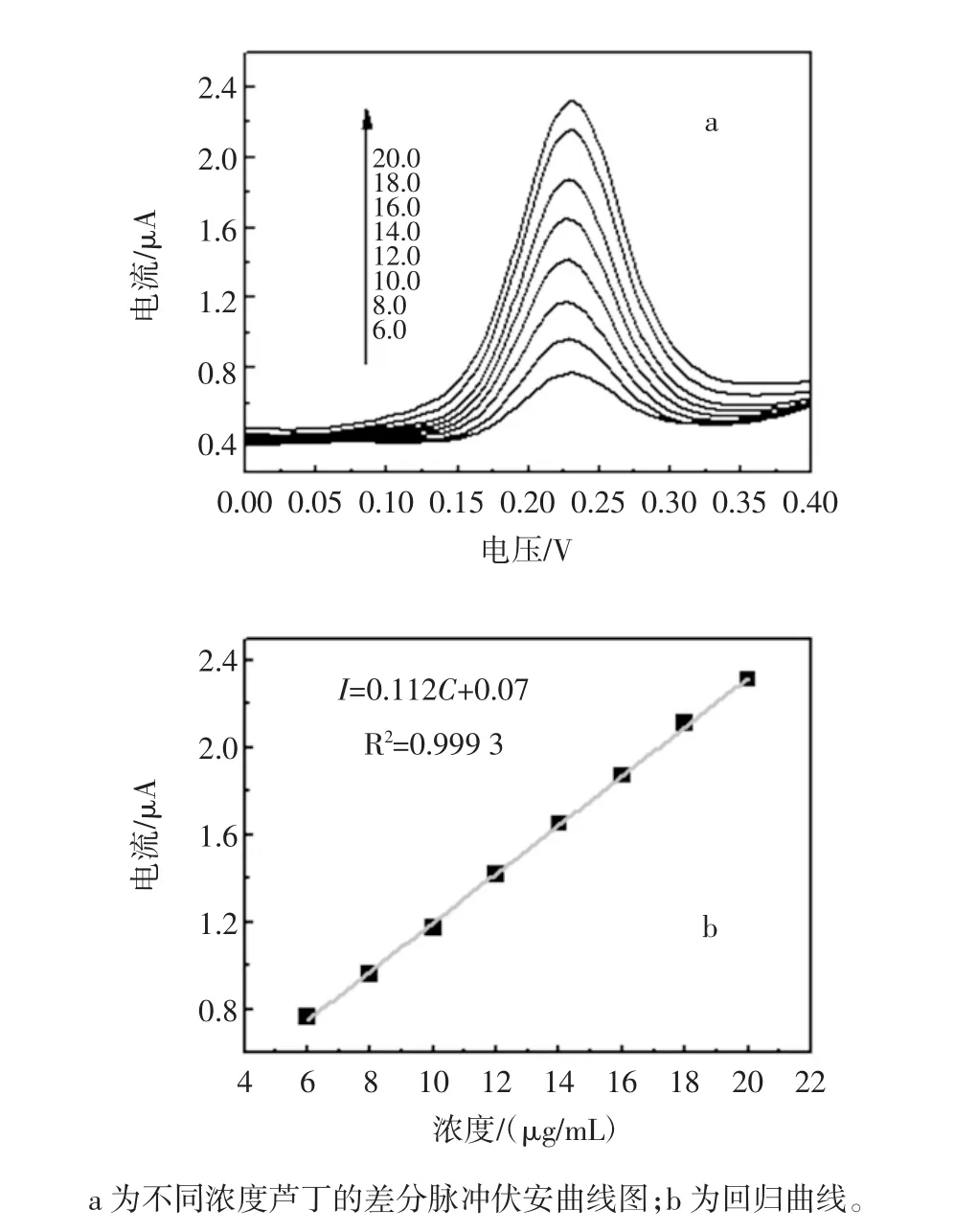
图6 芦丁差分脉冲伏安测定信号的线性关系Fig.6 The linear relationship of DPV signals on rutin
随着芦丁浓度的增加,DPV在0.23V处的信号峰也随之增加,其峰电流与芦丁的浓度呈线性变化关系,线性回归方程为 I(μA)=0.112C(μg/mL)+0.07,相关系数 R2=0.999 3,仪器检出限(3S/N)为 0.024 μg/mL,结果见表1。

表1 不同仪器方法测定芦丁的灵敏度比较Table 1 Different methods of determination of rutin
分析方法检出限为6.0 mg/100 g。重复10次测定芦丁,其RSD为1.70%,方法重复性满足定量测定要求。
2.4 实际样品中芦丁的测定
用差分脉冲伏安法对精制苦荞茶样液中的芦丁含量进行了测定,并且用紫外可见分光光度法[14]和高效液相色谱法[3]对样品做了方法比对试验,测定结果如表2所示。
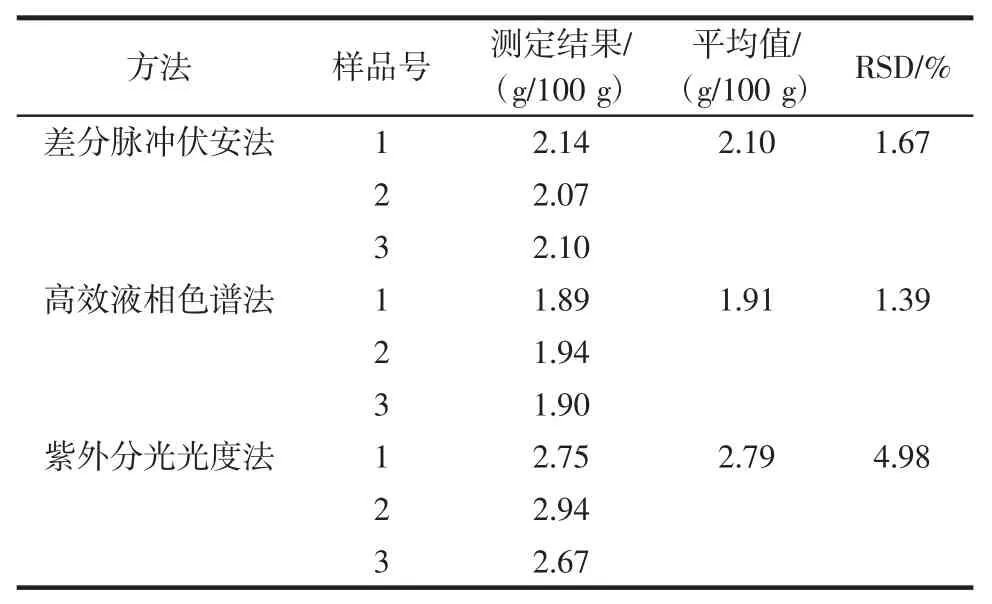
表2 不同方法测定苦荞茶样品中芦丁的结果比较Table 2 Measurement result of rutin in Buckwheat tea with different methods
从表2中可以看出,本方法对实际样品中的芦丁含量测定的3次平行性结果为2.10 g/100 g(RSD值小于5.0%),与高效液相色谱法结果相比略高7.3%,而相比紫外分光光度法而言,结果低了近30%。结果表明,本法可以通过DPV测定电位的不同将其他具有类似酚羟基结构分子的杂质物质对芦丁组分的测定干扰进行有效的降低,但是仍然有约7%的干扰,但此结果在可接受范围之内。
同时,试验了实际样品的回收率,以1号样品溶液20 mL 为母液(10.91 μg/mL),分别加入 0.2、0.5、0.7 mL 200.0 μg/mL的标准储备液,制得3组标准加入样品,分别测定回收率,结果如表3所示。
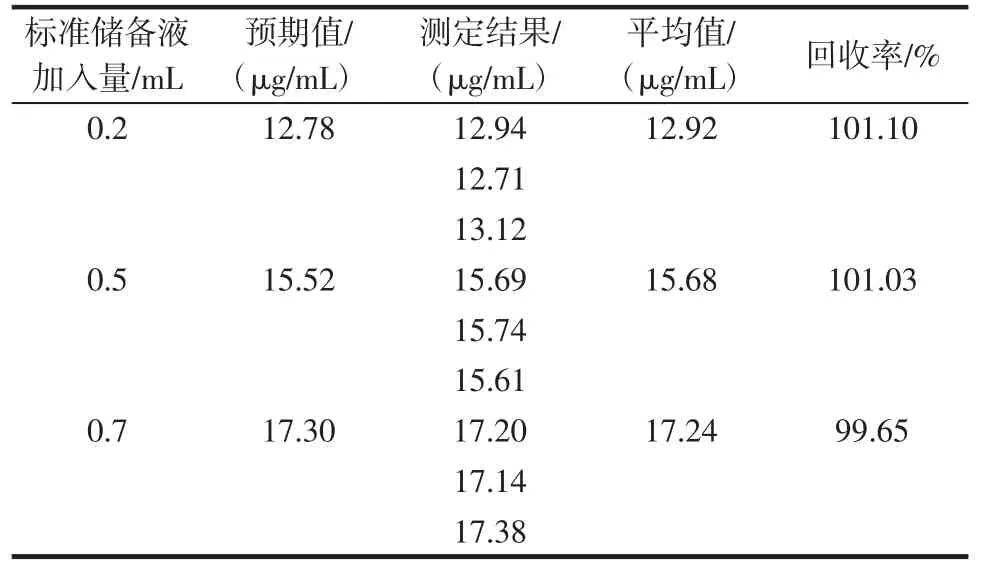
表3 苦荞茶样品中芦丁加标回收试验结果Table 3 Measurement result of Recovery experiments in Buckwheat tea
回收率在99.65%~101.10%之间,表明此方法用于试剂样品中芦丁含量的测定具有较高的准确性。
3 结论
本文以半胱氨酸与Au的静电吸附自组装原理,制备了一种多层结构的半胱氨酸/纳米金修饰电极。在此修饰电极上研究了芦丁分子的电化学行为,利用芦丁分子在修饰电极上的两电子两质子氧化还原反应所产生的位于0.23 V处差分脉冲伏安信号,建立了一种芦丁定量分析方法。该方法线性回归方程为I(μA)=0.112C(μg/mL)+0.07,相关系数 R2=0.999 3,且具有较低的检出限,重复10次测定芦丁,其RSD为1.70%,方法重复性满足定量测定要求,与高效液相方法和紫外分光光度法比较,该方法能够简便、快速、高效地适应于复杂体系中芦丁含量的测定。
[1] 龙全江,杨韬.芦丁的研究概况及展望[J].中国中医药信息杂志,2002,9(4):39-42
[2] 牛小花,陈洪源,曹晓钢,等.芦丁的研究新进展[J].天然产物研究与开发,2008(b5):156-159
[3] 黄兴富,黎其万,刘宏程,等.高效液相色谱法同时测定苦荞中芦丁、槲皮素和山柰酚的含量[J].中成药,2011,33(2):345-347
[4] Court W A.High-performance reversed-phase liquid chromatography of naturally occurring phenolic compounds[J].Journal of Chromatography A,1977,130:287-291
[5] 文平,陈进红.荞麦芦丁的研究进展[J].中国粮油学报,2006,21(3):107-111
[6] Barthus R C,Mazo L H,Poppi R J.Simultaneous determination of vitamins C,B6 and PP in pharmaceutics using differential pulse voltammetry with a glassy carbon electrode and multivariate calibration tools[J].Journal of Pharmaceutical&Biomedical Analysis,2005,38(1):94-99
[7] Ozkan S A,Kauffmann J M,Zuman P.Electrochemical Biosensors for Drug Analysis[M].Berlin Heidelberg:Springer-Verlag,2015:141-186
[8]Kang Jing-wan,Lu Xiao-quan,Zeng Hongjuan,et al.INVESTIGATION ON THE ELECTROCHEMISTRY OF RUTIN AND ITS ANALYTICAL APPLICATION[J].Analytical Letters,2002,35(4):677-686
[9] Ghica M E,Brett A.Electrochemical Oxidation of Rutin[J].Electroanalysis,2010,17(4):313-318
[10]徐青,王荣,陆秋艳,等.氨基乙硫醇修饰金电极直接测定芦丁含量的研究[J].分析化学,2006,34(7):971-974
[11]蒋治良,冯忠伟,李廷盛,等.金纳米粒子的共振散射光谱[J].中国科学:化学,2001,31(2):183-188
[12]Hendrickson H P,Sahafayen M,Bell M A,et al.Relationship of flavonoid oxidation potential and effect on rat hepatic microsomal metabolism of benzene and phenol[J].Journal of Pharmaceutical&Biomedical Analysis,1994,12(3):335-41
[13]邓光辉,王士伟,王辉,等.毛细管电泳安培法测定田基黄中的芦丁与槲皮素[J].分析试验室,2014(4):424-427
[14]张宏志,管正学.分光光度法测定荞麦中芦丁含量[J].光谱实验室,1996(3):24-27

