肝癌患者外周血Th17/Treg细胞和相关细胞因子的表达及IL-17对肝癌细胞侵袭的影响
刘 勇 周 彪 曾 金 刘华宝
(重庆市中医院肝病科,重庆 400020)
虽然肝癌发病的分子机制目前尚不清楚,但已有研究表明免疫细胞及细胞因子在肝癌发病中发挥重要作用〔1〕。辅助性T细胞(Th)17和调节性T细胞(Treg)同属于CD4+T细胞亚群,CD4+T细胞在白细胞介素(IL)-6和转化生长因子(TGF)-β的共同诱导下分化为Th17细胞,Th17细胞可特异性分泌IL-17因子,通过与其受体结合进而发挥促炎症作用〔2〕。CD4+T细胞在TGF-β的诱导下可分化为Treg细胞,Treg细胞通过分泌IL-10和TGF-β发挥免疫抑制作用〔3〕。Th17细胞和Treg细胞在分化过程中关系密切,在肿瘤患者中,Th17细胞和Treg细胞存在失衡现象〔4,5〕。目前关于Th17/Treg细胞及相关细胞因子的失衡在肝癌中的研究较少报道,因此本研究检测Th17/Treg细胞及IL-17、IL-10、IL-6和TGF-β细胞因子在肝癌患者及正常对照人群血浆中的表达,并在肝癌细胞系中探讨IL-17对肝癌细胞侵袭能力的影响及其作用机制。
1 资料与方法
1.1临床资料 选取住院的40例肝癌患者作为观察组,其中男23例,女17例,年龄31~72〔平均(57.1±2.3)〕岁。选取同期进行健康体检的40例正常人作为对照组,其中男21例,女19例,年龄32~74〔平均(57.9±2.5)〕岁。两组患者在年龄和性别分布上差异无统计学意义(P>0.05)有可比性。
1.2流式细胞术检测外周血中Th17和Treg细胞比例 吸取1 ml外周血,与等量的RPMI1640培养基混合均匀,然后加入佛波酯(50 ng/ml)、离子霉素(1 μg/ml)和莫能霉素(2 μg/L),置于37℃,5%CO2的培养箱中刺激4 h。PBS洗涤后加入CD4单抗(江苏凯基生物技术股份有限公司),混匀后室温避光孵育30 min。PBS洗涤,每管混合液加入2 ml溶血素,室温避光孵育10 min以裂解红细胞,PBS洗涤后离心弃上清液。加入破膜缓冲液,室温避光孵育10 min,离心弃上清。Th17细胞加入抗人IL-17单抗(eBioscience公司),Treg细胞加入抗人Foxp3单抗(eBioscience公司),室温避光孵育30 min,PBS洗涤2次,加入500 μl PBS重悬细胞,上机检测。
1.3酶联免疫吸附(ELISA)法检测细胞因子表达水平 将空腹抽取的1 ml外周血置于EDTA抗凝管中,然后离心(3 000 r/min,5 min),分离血浆,置于-80℃冰箱待用。IL-17,IL-10,IL-6和TGF-β ELISA检测试剂盒购于江苏凯基生物技术股份有限公司(IL-17:KGEHC170;IL-10:KGEHC009(H);IL-6:KGEHC007-1;TGF-β:KGEHC107B),实验步骤严格按照说明书进行操作,将待检血清按1∶10进行稀释后加入已包被的反应孔中,37℃孵育1 h后洗涤,加入100 μl酶标抗体,37℃孵育1 h后洗涤,加入酶标二抗,37℃孵育1 h后洗涤,加入显色液避光孵育30 min,待反应终止后用BioRad酶标仪检测在450 nm处的吸光值。
1.4细胞转染 人肝癌细胞系SMMC7721购自上海中科院细胞库(上海,中国),细胞培养液包含RPMI1640培养基(Gibco-BRL,NY,USA),10%胎牛血清,100 U/ml青霉素和链霉素(Gibco-BRL)。细胞培养于37℃,5% CO2,95%湿度的培养箱中。转染前一天取对数生长期的细胞,胰酶(Gibco-BRL)消化并吹打成单个细胞,接种至6孔板,每孔约1×105个细胞,培养过夜,观察细胞汇合率,在70%~90%时,采取Lipofectamine 2000(Thermo Fisher Scientific,MA,UAS)转染IL-17 siRNA(5′-CCTCAAAGCTCAGCGTGTC-3′)及阴性对照(5′-UAGCGACU AAACACAUCAAUU-3′)(上海吉玛制药技术有限公司,上海,中国),6 h后换液,48 h后提取RNA和蛋白质,检测沉默效率。
1.5实时荧光定量PCR检测细胞因子表达(qRT-PCR) 使用Trizol(Thermo Fisher Scientific)裂解转染后的SMMC7721细胞,提取总RNA,定量后将1 μg RNA逆转录(Takara,大连,中国)为cDNA,产物保存于-20℃冰箱备用。引物序列:IL-17,正链5′-TCAACCGTTCCACGTCACCCTGGAC-3′,负链5′-TCAGCATTCAACTTGAGCTCTCATGC-3′〔6〕;基质金属蛋白酶(MMP)-2:正链5′-AAGTCTGAA-GAGCGTGAAGTTTGG A-3′,负链5′-TGAGGGTTGGTGGGATTGGAG-3′;MMP-9:正链5′-AGTCCACCCTTGTGCTCTTCCC-3′,负链5′-TCTGCCACCCGAGTGTAACCAT-3′;β-actin,正链5′-AAAGACCTGTACGCCAACAC-3′,负链5′-GTCATA CTCCTGCTTGCTGAT-3′〔7〕。以β-actin作为内参。基因相对表达量采用2-ΔΔCt法进行计算。所有qRT-PCR实验n=3。
1.6免疫印迹(Western blot)检测蛋白水平 将转染48 h后的细胞置于细胞裂解液裂解10 min,13 000 r/min 离心5 min后吸取上清。聚丙烯酰胺凝胶电泳30 μg 蛋白,后250 mA转膜1 h,将蛋白置于聚偏氟丙烯(PVDF)膜上,用5%脱脂奶粉室温封闭1 h后加入一抗:IL-17(1∶1 000,CST公司,MA,USA),MMP-2(1∶500,CST公司),MMP-9(1∶500,CST公司),β-actin(1∶8 000,sigma公司,MO,USA)。4℃孵育过夜,TBST洗涤6×10 min后加入HRP标记的二抗(1∶2 000,中杉金桥,北京,中国),室温孵育2 h,TBST洗涤9×10 min后,电化学发光法(ECL)显色,暗室压片后在洗片机上曝光显影。
1.7Transwell法检测细胞侵袭能力 细胞转染24 h后,用无血清RPMI1640培养基饥饿培养8 h。消化细胞,配成无血清细胞悬液;基质胶用无血清RPMI1640培养基1∶5稀释,加入上层小室,置于37℃培养箱使之凝固。然后将Transwell小室置于24孔板内,每个小室加入100 μl无血清细胞悬液(约3×105个细胞),下室加入600 μl完全RPMI1640培养基,将培养板置于37℃培养箱中培养40 h,取出Transwell小室,PBS清洗后用棉棒擦去小室上层的细胞,PBS再次清洗以去除上层细胞;在小室的下层加入600 μl 0.1%的结晶紫染液,染色10 min,洗涤后风干,使用UFX-ⅡA型显微镜(日本Olympus)拍照,在高倍镜下随选取10个视野计数。
1.8统计学方法 应用SPSS17.0软件进行t检验。
2 结 果
2.1两组外周血中Th17/Treg细胞变化 观察组外周血中Th17 细胞和Treg细胞比例显著高于对照组,Th17/Treg比例显著低于对照组(P<0.05)。见表1。
2.2两组外周血中IL-17、IL-10、IL-6和TGF-β细胞因子变化 观察组外周血中IL-17、IL-10、IL-6和TGF-β表达水平均显著高于对照组(均P<0.05)。见表2。
2.3IL-17沉默效果检测 转染IL-22 siRNA后SMMC7721细胞系分泌的IL-17及细胞内表达的IL-17水平较阴性对照组显著降低(P<0.05)。见表3、图1。
2.4沉默表达IL-17对肝癌侵袭能力的影响 Transwell结果显示,沉默IL-17后SMMC7721细胞侵袭能力(0.19±0.03)与阴性对照组(1.00±0.01)相比显著降低(t=62.742,P<0.05)。见图2。
2.5干扰IL-17对肝癌细胞MMP-2和MMP-9表达影响 沉默IL-17后,MMP-2和MMP-9表达明显降低(P<0.05),见表4、图3。

表1 两组外周血Th17/Treg细胞比例
表2 两组外周血中细胞因子的表达
表3 沉默IL-17后表达水平比较
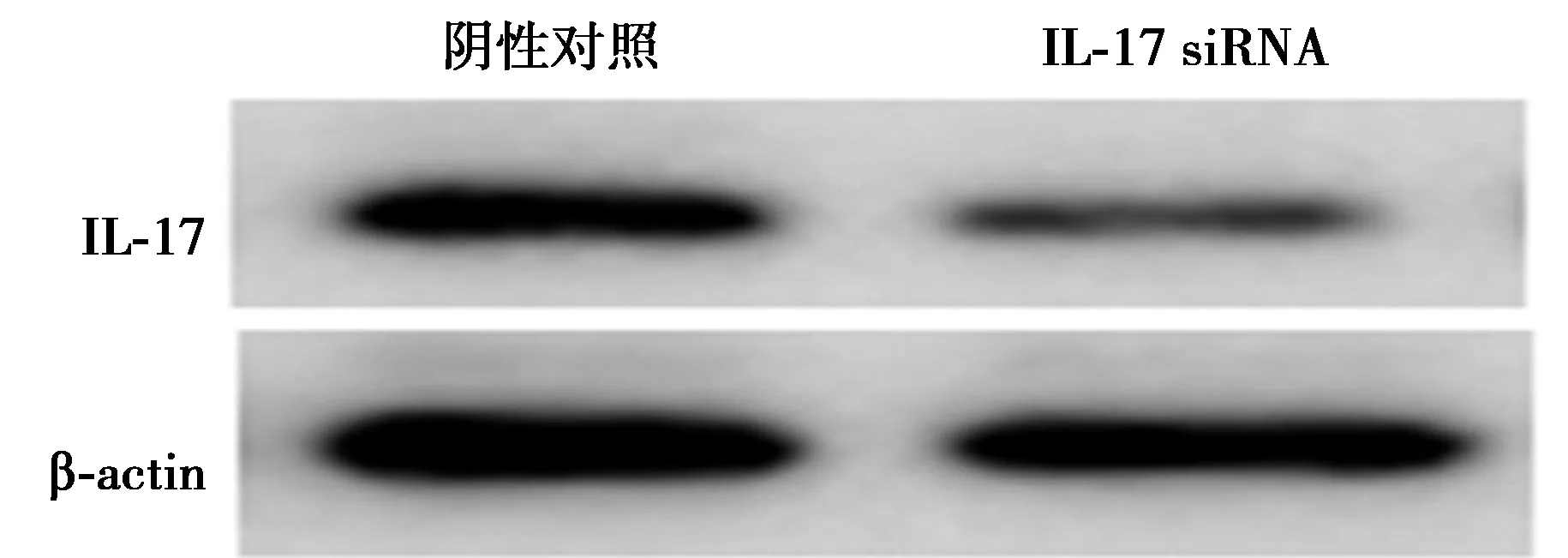
图1 沉默IL-17后表达水平检测

图2 沉默IL-17后肝癌侵袭能力检测(Transwell法)
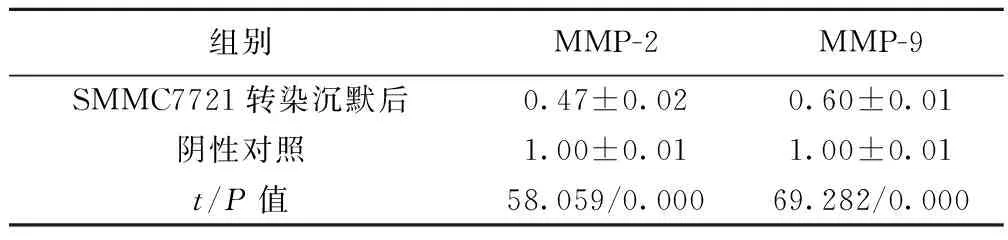
组别MMP-2MMP-9SMMC7721转染沉默后0.47±0.020.60±0.01阴性对照1.00±0.011.00±0.01t/P值58.059/0.00069.282/0.000
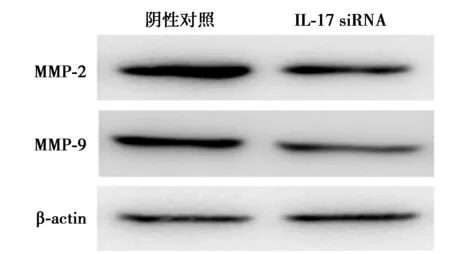
图3 沉默IL-17后MMP-2和MMP-9表达水平检测
3 讨 论
乙型肝炎病毒感染是导致肝癌产生的主要危险因素,机体感染乙肝病毒后,免疫系统产生抗病毒反应,清除病毒的同时引起了肝细胞损伤,肝细胞反复的坏死和再生导致肝癌的发展〔6,7〕。乙型肝炎病毒感染引起的慢性炎症反应是导致肝癌发生和发展的主要因素〔8〕。尽管乙肝病毒感染与肝癌的发展之间的因果关系已经确定,但乙肝病毒诱发肝癌发生过程中免疫细胞和细胞因子的作用机制目前尚不明确。前期研究表明,在急性乙肝患者外周血中,Th17 细胞和Treg细胞比例升高且其水平与肝功能有相关性〔9〕。而在肝癌中,有研究报道Th17/Treg 平衡与患者预后密切相关〔10〕。原发性肝癌患者手术后外周血中高水平的IL-17可增加患者早期复发的风险〔11〕。
本研究结果显示,肝癌患者外周血中Th17 细胞和Treg细胞较正常人群上升,Th17/Treg比例较正常人群下降同时IL-17、IL-10、IL-6和TGF-β表达水平均高于正常人群。这一结果表明这些细胞因子的共同作用可能诱导Th17 细胞和Treg细胞的分化并导致了Th17/Treg的失衡。Th17/Treg失衡将无法控制机体免疫反应,从而导致相应的免疫性损害。同时Th17 细胞比例增加导致其分泌的细胞因子IL-17增加,IL-17可促进某些血管源性细胞因子表达以及肿瘤微血管生成,与肿瘤的生长、转移和浸润存在关系〔12〕。异常增加的Treg细胞则可破坏CD8+T细胞的抗肿瘤效应,同时其分泌的细胞因子可以破坏其他免疫杀伤机制,导致肝癌细胞增加〔13〕。本研究表明Th17/Treg及细胞因子失衡与肝癌发生发展有一定的联系。
本研究还显示IL-17在RNA水平及蛋白水平显著下降。Transwell实验结果表明,沉默IL-17后细胞侵袭能力明显下降,提示IL-17可能参与肝癌的发展过程。沉默IL-17抑制了MMP-2和MMP-9的表达,表明IL-17可能通过调控MMP-2和MMP-9进而影响肝癌细胞的侵袭能力。
1杨晓霞,刘翔宁,刘明成,等.肝癌患者体液免疫和细胞免疫的变化情况〔J〕.现代生物医学进展,2016;16(22):4367-9.
2Kleinewietfeld M,Hafler DA.The plasticity of human Treg and Th17 cells and its role in autoimmunity〔J〕.Semin Immunol,2013;25(4):305-12.
3黄刚哲,姜 华.肝癌大鼠体内TH17/Treg失衡及意义〔J〕.中国老年学杂志,2016;36(8):1828-9.
4Duan MC,Han W,Jin PW,etal.Disturbed Th17/Treg Balance in Patients with Non-small Cell Lung Cancer〔J〕.Inflammation,2015;38(6):2156-65.
5Wang X,Wang L,Mo Q,etal.Changes of Th17/Treg cell and related cytokines in pancreatic cancer patients〔J〕.Int J Clin Exp Pathol,2015;8(5):5702-8.
6刘立国,吴健雄.乙肝病毒因素对肝癌肝切除及肝移植术后复发的影响〔J〕.中华肝胆外科杂志,2012;18(5):398-400.
7刘 辉,王凤梅,骆 莹,等.乙肝病毒促进肝癌细胞系的转移侵袭力〔J〕.基础医学与临床,2016;36(10):1393-9.
8Sukowati CH,El-Khobar KE,Ie SI,etal.Significance of hepatitis virus infection in the oncogenic initiation of hepatocellular carcinoma〔J〕.World J Gastroenterol,2016;22(4):1497-12.
9Feng H,Yin J,Han YP,etal.Regulatory T cells and IL-17(+) T helper cells enhanced in patients with chronic hepatitis B virus infection〔J〕.Int J Clin Exp Med,2015;8(6):8674-85.
10Liao Y,Wang B,Huang ZL,etal.Increased circulating Th17 cells after transarterial chemoembolization correlate with improved survival in stage III hepatocellular carcinoma:a prospective study〔J〕.PLoS One,2013;8(4):e60444.
11Wu J,Du J,Liu L,etal.Elevated pretherapy serum IL17 in primary hepatocellular carcinoma patients correlate to increased risk of early recurrence after curative hepatectomy〔J〕.PLoS One,2012;7(12):e50035.
12Huber M,Heink S,Grothe H,etal.A Th17-like developmental process leads to CD8(+) Tc17 cells with reduced cytotoxic activity〔J〕.Eur J Immunol,2009;39(7):1716-25.
13Takata Y,Nakamoto Y,Nakada A,etal.Frequency of CD45RO+ subset in CD4+CD25(high) regulatory T cells associated with progression of hepatocellular carcinoma〔J〕.Cancer Lett,2011;307(2):165-73.

