c-Myc在胆管癌细胞抵抗接触抑制中的作用
肖 斌 张春燕 罗国松 赵晓芳 余文静 成 鹰 段春燕 王进举 冯春红 夏先明 代荣阳
(西南医科大学生物化学与分子生物学教研室,四川 泸州 646000)
细胞接触抑制是正常细胞生长的关键特性〔1,2〕。然而,癌细胞通常丧失接触抑制,使之能够无限制增殖〔3〕。原癌基因c-Myc在多种组织细胞中广泛表达,对细胞生长和增殖起重要调节作用〔4〕。据统计,c-Myc在几乎近一半的人类肿瘤中表达失调〔5~7〕。胆管癌(CCA)恶性程度极高,预后较差〔8〕。研究显示c-Myc在CCA中具有重要调控作用,在胆汁淤积性肝损伤和CCA形成过程中可诱导c-Myc表达,并且c-Myc基因敲除后能抑制CCA的进展〔9〕。已有研究指出雷帕霉素靶蛋白(mTOR)参与调节细胞接触抑制,且mTOR信号通路在CCA细胞的生长和存活中发挥重要作用〔10〕。YAP参与调控细胞接触抑制、肿瘤发生等过程,Merlin是YAP上游的关键抑制分子〔11〕。本实验旨在探讨c-Myc在CCA细胞抵抗接触抑制中的作用和机制。
1 材料与方法
1.1材料 c-Myc抑制剂10058-F4(F4)和YAP抑制剂verteporfin(VP)购自Selleck Chemicals公司;mTOR抑制剂rapamycin购自Tocris Bioscience公司;抗细胞周期蛋白(Cyclin)D1、p27、c-Myc、p-p70S6K、p70S6K、p-S6、p-YAP(ser127)、YAP、p-Merlin和Merlin一抗均购自Cell Signaling Technology公司;抗甘油醛-3-磷酸脱氢酶(GAPDH)一抗、人c-Myc siRNA和对照siRNA购自Santa Cruz公司。
1.2方法
1.2.1细胞培养及处理 人正常胆管上皮细胞HIBEC、CCA细胞QBC939和RBE用含有10%胎牛血清和1%青霉素/链霉素的RPMI-1640培养基培养于5% CO2,37℃孵箱内培养。细胞以不同的密度铺板,细胞实现低密度(约50%汇合度)和高密度(100%汇合度)。
1.2.2Western印迹分析 十二烷基硫酸钠-聚丙烯凝胶(SDS-PAGE)电泳分离蛋白质后,采用半干式电转移将蛋白分子转移到硝酸纤维素(NC)膜,电转移结束后NC膜用Tris盐酸缓冲液(TBST)洗涤3次(5 min/次),封阻缓冲液(5% BSA)在室温下密闭轻摇动封阻1 h。TBST洗涤3次(5 min/次)后,NC膜与一抗稀释液室温下轻摇动孵育2 h,TBST洗涤3次(5 min/次)。NC膜与荧光二抗稀释液于室温下轻摇动孵育1 h,TBST洗涤3次(5 min/次)。Odyssey扫描显色。
1.2.3流式细胞术 将细胞固定过夜,重悬于磷酸盐缓冲液(PBS)中,并在暗盒中用碘化丙啶(PI)染色30 min。在Becton-Dickinson FAC Scan流式细胞仪系统上测量DNA含量。
1.2.4RNA干扰 细胞接种于35 mm皿,将10 μl浓度为20 μmol/L的siRNA储存液与100 μl DMEM混合,同时将8 μl Lipofectamine 2000与100 μl DMEM混合,然后将两种溶液混匀并加入正常培养的细胞中。培养6 h后更换新鲜的完全培养基。
1.3统计学方法 应用SPSS19.0软件进行t检验。
2 结 果
2.1低、高密度培养时HIBEC、QBC939和RBE细胞周期分布情况 如图1流式细胞术结果显示,高密度培养的HIBEC细胞出现接触抑制,其细胞周期停滞在G0/G1期,而QBC939和RBE细胞在高密度时仍有较强的增殖能力(图1A)。Western印迹结果显示,高密度培养的HIBEC细胞中CyclinD1蛋白水平比低密度时显著下调,而p27蛋白表达上调。高密度培养的QBC939和RBE细胞中CyclinD1持续高表达且未见p27表达明显诱导(图1B)。
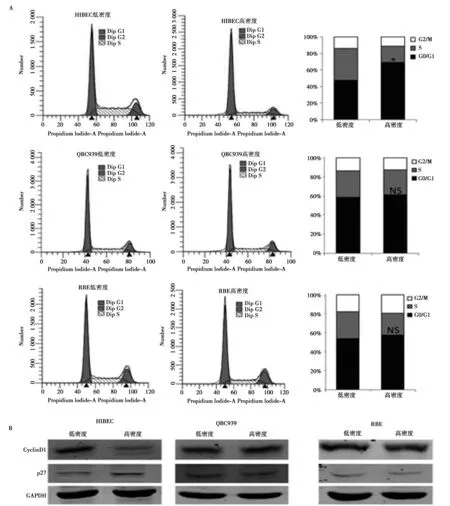
图1 CCA细胞抵抗接触抑制
2.2Western印迹检测HIBEC、QBC939和RBE细胞在低、高密度时c-Myc的蛋白水平 与低密度相比,高密度培养的HIBEC细胞中c-Myc蛋白明显下降(P<0.05),而QBC939和RBE细胞在低、高密度培养时c-Myc蛋白水平差异无统计学意义(P>0.05)。Western印迹结果表明,10058-F4处理显著下调QBC939和RBE细胞中c-Myc的蛋白表达,同时抑制CyclinD1表达。流式细胞术结果证实10058-F4可诱导高密度的QBC939和RBE细胞周期停滞在G0/G1期。见图2,图3。
2.3c-Myc通过mTOR信号通路促进人QBC939抵抗接触抑制 在HIBEC细胞中,p70S6K和S6的磷酸化水平在高密度时受到显著抑制,而在QBC939和RBE细胞中无显著变化(图4A)。采用c-Myc抑制剂10058-F4处理高密度QBC939和RBE细胞后,p70S6K和S6的磷酸化水平明显减弱(图4B)。siRNA干扰c-Myc表达结果显示干扰c-Myc不仅能够下调磷酸化p70S6K和S6,还显著抑制了CyclinD1的表达(图4C)。rapamycin处理的高密度QBC939和RBE细胞周期停滞在G0/G1期。见图5。
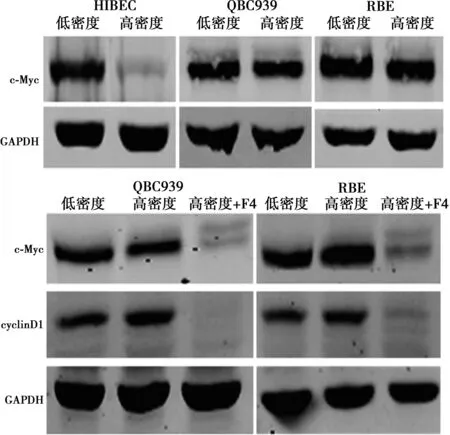
图2 c-Myc在高密度胆管癌细胞中的表达及其对CyclinD1表达的影响

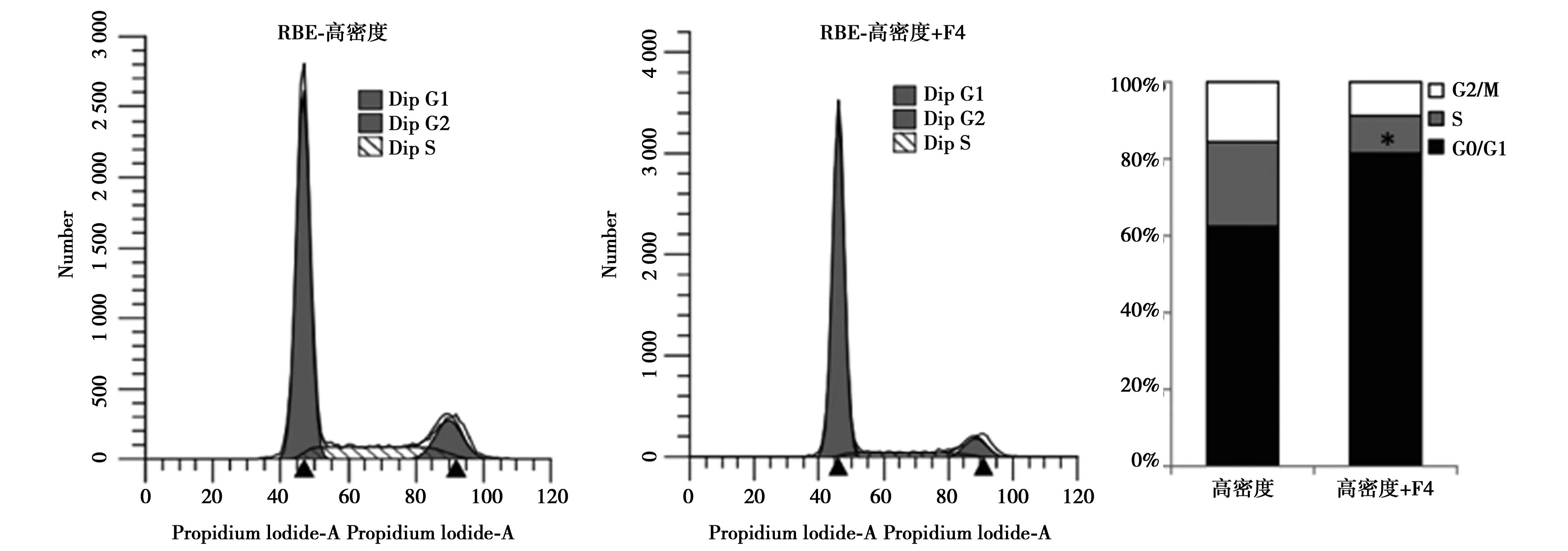
图3 c-Myc调控CCA细胞抵抗接触抑制
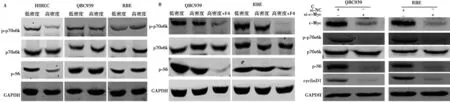
图4 c-Myc通过mTOR信号通路促进CCA细胞抵抗接触抑制
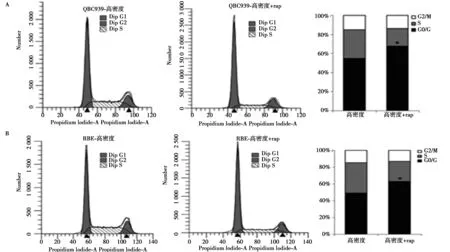
图5 抑制mTOR恢复CCA细胞接触抑制
2.4YAP调控c-Myc在高密度CCA细胞中的异常高表达 在高密度HIBEC细胞中,YAP磷酸化水平显著上调,而在高密度QBC939和RBE细胞中无显著改变(图6A)。Western印迹分析提示,在高密度QBC939和RBE细胞用verteporfin抑制YAP活性不仅下调了c-Myc蛋白水平,还抑制了CyclinD1表达(图6B)。
免疫印迹结果提示,在HIBEC细胞中,Merlin磷酸化在高密度时受到抑制,表明Merlin活性上调,而在高密度QBC939和RBE细胞中Merlin磷酸化水平反而上调,说明Merlin活性受到抑制(图6C)。
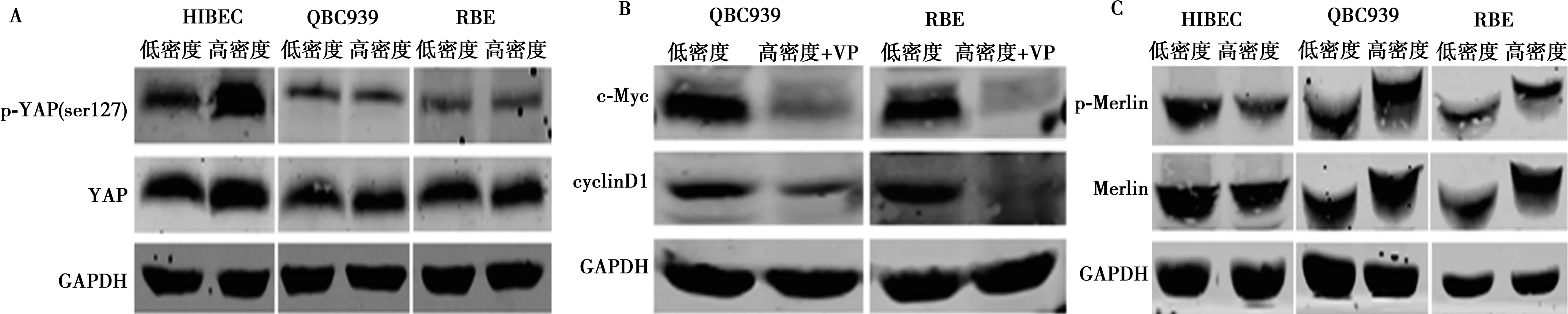
图6 Merlin/YAP调控c-Myc介导的CCA细胞抵抗接触抑制
3 讨 论
接触抑制是指正常细胞在生长培养过程中,当细胞相互接触汇合时,细胞的增殖能力受到抑制,出现生长停滞。接触抑制的丢失是大多数肿瘤细胞的一大标志〔3〕,失去接触抑制调控的肿瘤细胞获得了无限增殖的潜能。本实验结果显示,正常胆管上皮细胞在高密度时出现接触抑制现象,而CCA细胞抵抗接触抑制。有许多信号分子参与调控细胞接触抑制的发生〔11〕,但肿瘤细胞抵抗接触抑制的具体机制仍有待阐明。
研究证实,c-Myc调控CCA的发生发展〔12〕,而c-Myc在胆管癌进展中的具体分子机制仍不清楚。本研究显示c-Myc在增殖状态下的正常胆管上皮细胞中高表达,而在细胞发生接触抑制时受到显著抑制。c-Myc在高低密度不同培养状态下的人CCA细胞中始终保持高水平表达,因而推测c-Myc可能参与调控CCA细胞接触抑制的丢失。此假设在后续实验得到了证实,抑制c-Myc活性或干扰c-Myc表达均可恢复CCA细胞的接触抑制。这表明c-Myc能够通过促进CCA细胞逃避细胞接触抑制促进CCA的进程。
mTOR是哺乳动物组织和细胞中广泛存在的丝/苏氨酸蛋白激酶,广泛参与正常细胞代谢、细胞运动、细胞存活和血管生成等过程〔13〕。mTOR信号通路在肿瘤细胞中通常呈过度激活状态,与肿瘤细胞的增生、分化、凋亡、转移和侵袭有关,在许多恶性肿瘤中起重要作用〔14〕。研究表明,mTOR信号失活是细胞接触抑制的重要分子事件〔10〕。本实验发现在发生接触抑制的正常胆管上皮细胞中mTOR活性受到显著抑制。研究表明,mTOR信号通路参与CCA的发生发展,并且抑制mTOR后能抑制CCA细胞增殖〔10〕,但mTOR是否参与调控CCA细胞接触抑制未见报道。本研究结果发现mTOR在CCA细胞低、高密度中均保持高度活化状态,而rapamycin抑制mTOR后使得CCA细胞恢复接触抑制,并且10058-F4抑制c-Myc后显著降低了高密度CCA细胞中mTOR的活性。这些结果表明c-Myc可通过mTOR促进胆管癌细胞接触抑制。
本实验发现,在发生接触抑制的正常胆管上皮细胞中YAP活性受到抑制,而在高密度培养的胆管癌细胞中YAP仍保持高活性水平。抑制YAP活性显著降低高密度培养的胆管癌细胞中c-Myc和CyclinD1表达,表明c-Myc在高密度胆管癌细胞中的表达失调受YAP信号调控。此外,本研究结果提示,YAP/c-Myc在高密度胆管癌细胞中的失调与肿瘤抑制蛋白Merlin功能失调紧密相关。Merlin/YAP/c-Myc/mTOR信号在CCA细胞逃避接触抑制中的重要作用,对该通路在CCA抵抗接触抑制中的进一步研究不仅有助于胆管癌分子机制的阐明,也可能为CCA的防治提供新思路。
1Eagle H,Levine EM.Growth regulatory effects of cellular interaction〔J〕.Nature,1967;213(5081):1102-6.
2Carter SB.Tissue homeostasis and the biological basis of cancer〔J〕.Nature,1968;220(5171):970-4.
3Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation〔J〕.Cell,2011;144(5):646-74.
4Brodeur GM,Seeger RC,Schwab M,etal.Amplification of N-myc in untreated human neuroblastomas correlates with advanced disease stage〔J〕.Science,1984;224(4653):1121-4.
5Vogelstein B,Papadopoulos N,Velculescu VE,etal.Cancer genome landscapes〔J〕.Science,2013;339(6127):1546-58.
6Kaposi-Novak P,Libbrecht L,Woo HG,etal.Central role of c-Myc during malignant conversion in human hepatocarcinogenesis〔J〕.Cancer Res,2009;69(22):2775-82.
7Yang H,Liu T,Wang J,etal.Deregulated methionine adenosyltransferase alpha1,c-Myc,and Maf proteins together promote cholangiocarcinoma growth in mice and humans(double dagger)〔J〕.Hepatology,2016;64(2):439-55.
8Blechacz BR,Gores GJ.Cholangiocarcinoma〔J〕.Clin Liver Dis,2008;12(1):131-50.
9Yang H,Li TW,Peng J,etal.A mouse model of cholestasis-associated cholangiocarcinoma and transcription factors involved in progression〔J〕.Gastroenterology,2011;141(4):378-88.
10Zhao X,Zhang C,Zhou H,etal.Synergistic antitumor activity of the combination of salubrinal and rapamycin against human cholangiocarcinoma cells〔J〕.Oncotarget,2016;7(51):85492-501.
11Zeng Q,Hong W.The emerging role of the hippo pathway in cell contact inhibition,organ size control,and cancer development in mammals〔J〕.Cancer Cell,2008;13(3):188-92.
12Berasain C,Fernandez-Barrena MG,Avila MA.New molecular interactions of c-Myc in cholangiocarcinoma may open new therapeutic opportunities〔J〕.Hepatology,2016;64(2):336-9.
13Li X,Wu C,Chen N,etal.PI3K/Akt/mTOR signaling pathway and targeted therapy for glioblastoma〔J〕.Oncotarget,2016;7(22):33440-50.
14Kim LC,Cook RS,Chen J.mTORC1 and mTORC2 in cancer and the tumor microenvironment〔J〕.Oncogene,2017;36(16):2191-201.

