老年非小细胞肺癌患者支气管肺泡灌洗液中视黄酸受体-β基因甲基化与P53突变的相关性
龚子龙 喻婉贤 姜 燕 范惠君
(武汉市第五医院呼吸内科,湖北 武汉 430050)
支气管肺泡灌洗液是指临床通过利用支气管镜对老年患者支气管以下肺段进行生理盐水的灌洗并回收得到的具有诊断价值的灌洗液〔1〕。通过对回收的灌洗液进行检测与分析,可以得知老年患者体内呼吸道的病变情况,其在肺癌中诊断中有临床应用价值〔2~5〕。视黄酸受体(RAR)-β基因是编码视黄酸β受体蛋白,其基因启动子区及5′端第一个转录翻译区富含CpG,在基因组上形成CpG岛〔6〕。当RAR-β基因编码区及启动子区被高甲基化,基因表达沉默,从而导致细胞的生长和增殖不受控制,进而促进恶性肿瘤的发生,在正常人中,RAR-β基因的甲基化水平较低〔7〕。P53基因是人体普遍存在的一类抑癌基因,其突变的发生往往和肿瘤形成相关〔8〕。本研究分析肺癌老年患者支气管肺泡灌洗液中RAR-β基因的甲基化水平及P53基因突变的发生率,旨在探讨其在肿瘤发生发展过程中的作用及两者相互关系。
1 材料与方法
1.1一般资料 2014年4月至2016年4月武汉市第五医院呼吸科就诊的97例经病理确诊为非小细胞肺癌老年患者为癌症组,同时选取89例非肺癌老年患者为对照组。癌症组男58例,女39例,年龄63~82岁,平均(75.7±8.6)岁;对照组男53例,女36例,年龄61~85岁,平均(74.3±9.2)岁。两组年龄及性别分布差异无统计学意义(P>0.05)。癌症组按照2009年国际TNM分期标准进行分期,其中Ⅰ期和Ⅱ期45例,Ⅲ期和Ⅳ期52例。
1.2主要试剂与仪器 全基因组DNA提取试剂盒,购自北京全式金生物(EasyPure Genomic DNA Kit,货号EE101);Mastercycler nexus聚合酶链反应(PCR)扩增仪,购自Eppendorf公司;Tanon4200 SF全自动荧光/化学发光图像分析系统,购自天能生物公司;2×TransTaq High Fidelity(HiFi) PCR SuperMix购自北京全式金生物(货号AS131);BisulFlashDNA甲基化修饰试剂盒购自Epigentek公司(货号P-1026-050);甲基化RAR-β特异的PCR扩增引物,未甲基化RAR-β特异的PCR扩增引物,P53基因的Exon5,Exon6,Exon7,Exon8特异的PCR扩增引物均由Invitrogen公司合成,引物序列信息见表1。

表1 引物信息
1.3样本收集与DNA提取 首先对参与研究的老年患者进行支气管镜检,以确定其病发部位;然后将镜头置入支气管镜头于老年患者病发部位上游,采用多次灌洗,每次20 ml 37℃的生理盐水进行冲洗,灌洗5次,然后通过负压吸取支气管肺泡灌洗液;对收集的灌洗液显示采用双层医疗纱布过滤后在4℃低温,3 000 r/min离心10 min;取出离心管,弃去上清液体,回收离心得到的细胞残渣,备用。严格按照使用操作说明书,完成对灌洗液细胞残渣的基因组DNA的抽提。对提取得到的DNA,采用NanoDrop对DNA的总量及纯度进行初步检测,A260/A280比值在1.8~2.0,表明样本纯度较高。
1.4RAR-β基因甲基化检测 对于由支气管肺泡灌洗液中提取得到的DNA样品,首先按照Bisul Flash DNA甲基化修饰试剂盒的操作说明,对DNA进行亚硫酸氢钠处理后采用甲基化引物进行甲基化特异PCR,以区分RAR-β基因是否发生甲基化,步骤如下:PCR反应总体积20 μl,其中2×TransTaq High Fidelity(HiFi) PCR SuperMix 10 μl,甲基化特异的PCR 正向和反向引物各 1 μl,修饰后的DNA模板2 μl,加入6 μl ddH2O将反应体系补至20 μl;PCR扩增条件为:预变性:95℃ 2 min;扩增(36个循环):94℃变性30 s,60℃退火30 s,72℃延伸30 s。对于PCR扩增的结果,采用凝胶电泳进行检测,其中利用甲基化特异的引物进行PCR扩增,并且检测到目的条带,则表明RAR-β基因是被甲基化的;若是PCR完成后,只有非甲基化特异的引物有目的条带扩增,则RAR-β基因未被甲基化。
1.5P53基因突变的检测 以从灌洗液中得到的DNA样品为模板,采用特异性PCR引物,分别对P53基因的Exon5,Exon6,Exon7,Exon8进行扩增。PCR体系配制如下:采用50 μl PCR体系,其中 2×TransTaq High Fidelity(HiFi) PCR SuperMix 25 μl,基因特异的PCR正向和反向引物各2 μl,提取的基因组DNA样品4 μl,加入17 μl ddH2O将反应体系补至50 μl;PCR扩增条件:预变性:95℃ 2 min;扩增(36个循环):94℃变性30 s,60℃退火30 s,72℃延伸30 s。回收PCR扩增产物,并送生工生物进行PCR扩增片段的双向测序,验证P53各个外显子的突变情况。
1.6统计学方法 采用SPSS21.0统计软件进行χ2检验或Fisher精准检验、Spearman相关分析。
2 结 果
2.1肺癌组RAR-β基因甲基化检测 对PCR扩增的产物,采用2%的凝胶电泳进行电泳分离,并在凝胶成像仪上进行检测,部分结果见图1。
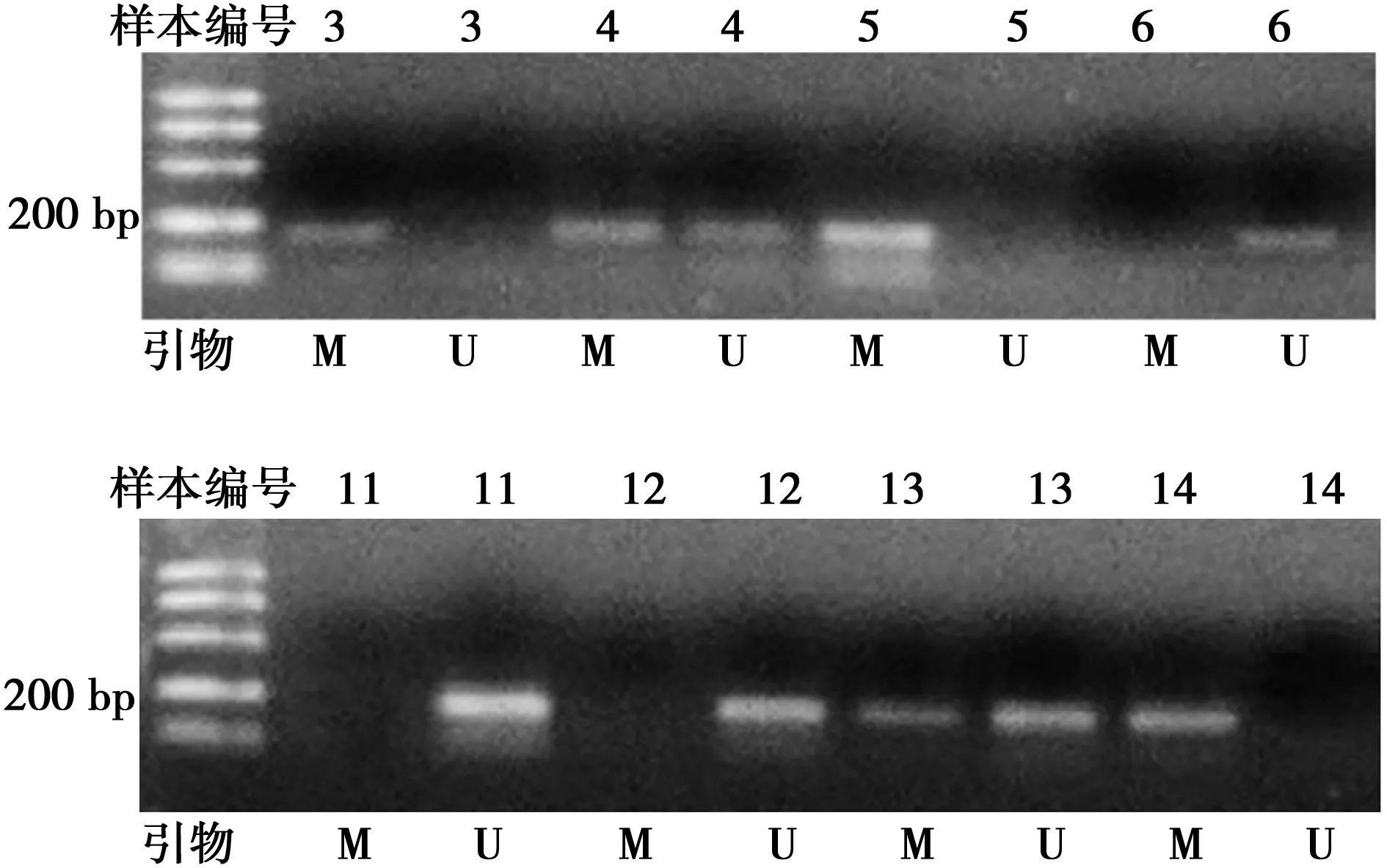
3、4、5.检测到RAR-β基因甲基化;6.未检测到RAR-β基因甲基化;11、12.未检测到RAR-β基因甲基化;13、14.检测到RAR-β基因甲基化;M.甲基化引物扩增结果;U.未甲基化引物扩增结果图1 肺癌老年患者支气管肺泡灌液中RAR-β基因甲基化检测结果
2.2两组RAR-β基因甲基化及P53基因突变比较 癌症组RAR-β基因甲基化发生率(53.61%)与正常组(17.98%)差异有统计学意义(χ2=25.41,P<0.05);测序分析结果显示,P53在肺癌灌洗液中突变率(43.30%)较对照组(7.87%)明显高(χ2=30.03,P<0.05)。
2.3不同临床分期的肺癌老年患者中RAR-β基因的甲基化及P53基因的突变比较 Ⅰ、Ⅱ期肺癌老年患者支气管肺泡灌洗液中RAR-β基因的甲基化阳性率为42.22%(19/45),Ⅲ、Ⅳ期甲基化阳性率显著升高为63.46%(33/52),差异有统计学意义(χ2=4.38,P<0.05);Ⅰ、Ⅱ期的肺癌老年患者支气管肺泡灌洗液中P53基因的突变率为22.22%(10/45),Ⅲ、Ⅳ期P53基因的突变率则显著升高为61.54%(32/52),差异有统计学意义(χ2=15.19,P<0.05),Ⅰ、Ⅱ期支气管肺泡灌洗液中,RAR-β基因甲基化和P53基因的突变检出率差异有统计学意义(P<0.05)。
2.4RAR-β基因甲基化与P53基因突变的相互关系 RAR-β基因甲基化发生时,P53基因突变率为67.31%(35/52),而当RAR-β 基因甲基化未发生时,P53基因突变率仅为15.56%(7/45),差异有统计学意义(P<0.05);同样的,当P53基因突变发生时,肺癌老年患者RAR-β 基因甲基化的发生率为83.33%(35/42),而在P53基因未发生突变组,肺癌老年患者RAR-β 基因甲基化的发生率降低为30.91%(17/55),差异有统计学意义(χ2=26.32,P<0.05)。RAR-β基因甲基化水平与P53基因突变呈正相关(r=0.521,P<0.05)。
3 讨 论
老年患者被确诊为肺癌时,多数已属于肺癌晚期,因此肺癌的早期诊断及治疗对提高老年患者的生存率及预后有重要意义〔2〕。对于肺癌的诊断,先前主要是通过侵入性摘取患者肺部组织,进行组织病理学分析进行确诊〔8〕。近些年来随着支气管肺泡灌洗术的临床应用,通过对灌洗液中脱落的组织细胞及相关基因进行筛选已成为肺癌辅助诊断的重要手段〔9〕。但是由于灌洗液中脱落的细胞不稳定、易降解等特点,导致实际的检出率较低〔10〕。随着生物技术的进步,PCR技术在扩增目的DNA时,具有高灵敏度和高特异性,被引入到该类检测反应中,从而有助于提高对肺癌灌洗液中相关基因表达和突变的检测等〔11〕。
RAR-β基因编码的视黄酸β受体蛋白,能够介导与视黄酸的结合,从而参与调控相关靶基因的转录过程,达到抑制癌症发生发展的效应〔12〕。肿瘤组织中RAR-β基因的启动子区存在异常高水平的甲基化,或许是其表达沉默的主要原因〔13〕;肺癌发生的早期阶段,检测到大量的抑癌基因启动子区域的高甲基化,表明RAR-β基因的甲基化可能与肺癌的早期形成密切相关,暗示着其或许能作为肺癌发生的肿瘤标志物〔14,15〕。而P53基因是人体普遍存在的一类抑癌基因,在多数肿瘤组织中均能检测到其突变〔16,17〕。
本研究表明RAR-β甲基化及P53基因突变与癌症的发生密切相关,与部分学者的研究结果较为一致〔18〕;本文表明随着肺癌的发展,RAR-β基因的甲基化水平越高,P53基因的突变发生检出率越明显,提示RAR-β基因及P53 基因可能参与了肺癌的发展过程;两者在肺癌的发展过程中可能存在着相互协同的效果;肺癌发展的前期,对老年患者RAR-β基因甲基化水平检测的临床诊断价值要高于P53基因突变。
1崔显念.支气管肺泡灌洗液中3种肿瘤标志物的检测在肺癌诊断及病情评估中的价值〔J〕.中国医药科学,2015;5(9):130-2.
2汤晓梅,易向军.支气管肺泡灌洗液和血清中肿瘤标志物检测在肺癌诊断中的临床价值〔J〕.当代医学,2016;22(21):69-70.
3周继红,柳广南,黄斯明,等.表面增强激光解析电离飞行时间质谱法筛选肺癌患者血清和肺泡灌洗液中标志蛋白的研究〔J〕.中华结核和呼吸杂志,2011;34(4):274-7.
4徐 健,周道银,俞靖龙,等.支气管肺泡灌洗液常规细胞形态学检查的临床应用价值评价〔J〕.检验医学,2012;27(3):221-4.
5Ciebiada M,Gorski P,Antczak A.Eicosanoids in exhaled breath condensate and bronchoalveolar lavage fluid of patients with primary lung cancer〔J〕.Dis Marker,2012;32(5):329-35.
6白晓敏,杨小岗.支气管肺泡灌洗液和血清肿瘤标志物检测在肺癌诊断中的应用〔J〕.中国医药导报,2015;12(6):40-3,47.
7Moison C,Senamaud-Beaufort C,Fourriere L,etal.DNA methylation associated with polycomb repression in retinoic acid receptor β silencing〔J〕.FASEB J,2013;27(4):1468-78.
8Zhao X,Wang N,Zhang M,etal.Detection of methylation of the RAR-β gene in patients with non-small cell lung cancer〔J〕.Oncol Lett,2012;3(3):654-8.
9李海燕,任美英.支气管肺泡灌洗术、纤支镜刷片及痰脱落细胞学联合检测在肺癌诊断中的应用价值〔J〕.中国实用医药,2016;11(34):67-8.
10Ines FM,Valeria GC,Lis SM,etal.Retinoic acid reduces migration of human breast cancer cells:role of retinoic acid receptor beta〔J〕.J Cell Mol Med,2014;18(6):1113-23.
11黎银燕,曾婉明,Chen Hong,等.肺癌及癌前病变组织中P53基因突变蛋白检测〔J〕.中国公共卫生,2008;24(7):795-7.
12李 琪,肖贵华,程长浩,等.非小细胞肺癌BALF中RAR-β基因甲基化与p53突变检测及相关性研究〔J〕.重庆医学,2015;44(23):3206-9.
13谭 聪,金永堂,徐鹤云,等.非小细胞肺癌RARβ基因启动子CpG岛甲基化与P53基因突变的关系〔J〕.中华医学遗传学杂志,2012;29(2):131-6.
14Kim H,Kwon YM,Kim JS,etal.Tumor-specific methylation in bronchial lavage for the early detection of non-small cell lung cancer〔J〕.J Clin Oncol,2004;22(12):2363-70.
15万玲玲,贺宇彤,李玉雪,等.P16基因甲基化和P53抗体在非小细胞肺癌血清中的表达〔J〕.河北医药,2017;39(12):1783-7.
16Bhagat R,Kumar SS,Vaderhobli S,etal.Epigenetic alteration of p16 and retinoic acid receptor beta genes in the development of epithelial ovarian carcinoma〔J〕.Tumor Bio,2014;35(9):9069-78.
17付 冉,王艳林,黄利鸣.p16表达异常与肿瘤关系的研究进展〔J〕.生命的化学,2017;37(4):585-9.
18王 阳,张黎黎,卢 颖,等.p53表达对老年晚期非小细胞肺癌化疗效果的影响研究〔J〕.中国全科医学,2015;18(9):989-93.

