电石渣制备过氧化钙液相循环工艺的研究*
熊 磊 ,蓝师文 ,邹友琴 ,蒋柏泉 ,
(1.南昌大学科学技术学院生物化学系,江西南昌330029;2.南昌大学资源环境与化学工程学院)
电石渣是电石法生产聚氯乙烯(PVC)过程中产生的主要固体废弃物,每生产1 t的PVC可副产1.5~1.9 t电石渣。若未经处理而将电石渣任意丢弃或露天堆放,不仅会占用和侵蚀土地,而且还会污染河流水域,严重破坏生态环境。近年来,中国广大科研人员对电石渣综合利用的研究十分活跃,在利用电石渣制备水泥[1]、高附加值碳酸钙[2-3]、改性聚氯乙烯[4]、多孔水化硅酸钙[5]、混凝剂[6]、低强度材料[7]等有用的工业产品和处理煤矿酸性废水[8]、电镀废水[9-10]和吸收/分离 CO2[11]等三废治理方面都做了大量的研究工作,并取得了一定的成效。笔者利用氯化铵溶液提取电石渣中的钙离子,再与过氧化氢反应,制备高纯过氧化钙,同时将副产的氯化铵溶液循环使用,以期取得经济、环保双重效益,为合理有效利用电石渣探索一条新的出路。
1 实验
1.1 原料、试剂与仪器
原料:电石渣,取自南昌市某化工厂。
试剂:氯化铵(AR),广东台山化工厂;钙-羧酸指示剂(AR),上海展云化工厂;三乙醇胺(AR)、磷酸二氢钠(AR),西陇化工有限公司;氢氧化钠(AR)、双氧水(质量分数为30%),天津大茂化工厂。
仪器:FA2104型电子分析天平、SHZ-D(Ⅲ)型循环水式真空泵、S-212型恒速搅拌器、PHS-3E型精密PH计、D8 Advcance型X射线衍射仪、Quanta 200型扫描电镜。
1.2 实验过程
电石渣预处理:将膏状固体电石渣经过水洗、热烘(105℃±5℃)和粉碎后得到干渣供实验用。测得干渣中钙质量分数为64.09%(以CaO计)。
电石渣提钙:将过量的电石渣粉加入一定浓度的NH4Cl溶液中反应,反应结束后经过滤得到氯化钙和氨水的混合溶液,反应方程式:
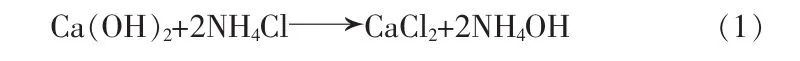
过氧化钙制备:将由电石渣提钙过程得到的混合溶液调节至规定浓度后加入双氧水中,反应后过滤,得含有结晶水的CaO2,其反应方程式为式(2),再烘干脱水后得CaO2产品,其反应式为式(3):
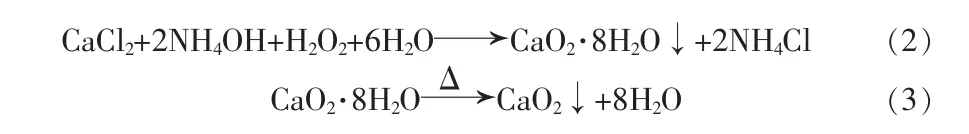
液相循环:将反应式(2)产物过滤后所得滤液(NH4Cl为主要溶质)经测浓后循环用于反应(1)的电石渣提钙。
图1为上述工艺过程的流程示意图。
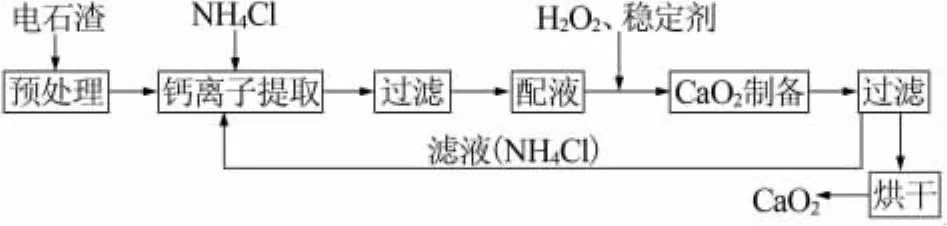
图1 电石渣制备过氧化钙的液相循环工艺流程图
1.3 钙含量测定
钙含量按GB/T 19281—2003《碳酸钙分析方法》测定并按下式计算:
w1=c(V-V0)M1/(m×103×25/250)×100%=c(V-V0)M1/(m×100)×100%
式中,w1为电石渣中的钙含量 (以CaO的质量分数计),%;c为乙二胺四乙酸二钠(EDTA)的浓度,mol/L;V为消耗 EDTA的体积,mL;V0为空白试验消耗EDTA的体积,mL;M1为CaO的相对分子质量;m为电石渣的质量,g。
1.4 钙提取率计算
钙提取率按下式计算:
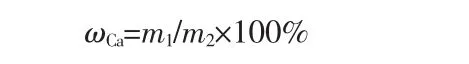
式中,ωCa为钙提取率,%;m1为滤液中钙的质量,g;m2为电石渣中钙的质量,g。
1.5 氯化铵利用率计算
氯化铵利用率按下式计算:
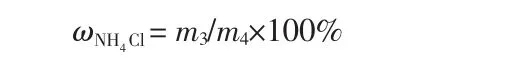
式中,ωNH4Cl为氯化铵利用率,%;m3为反应消耗的氯化铵质量,g;m4为实际添加的氯化铵质量,g。
1.6 过氧化钙含量的测定
精确称取0.5 g产品置于100 mL烧杯中,加少量水润湿后用盐酸全部溶解,转移至250 mL容量瓶中定容。移取25 mL上述溶液置于250 mL锥形瓶中,加入三乙醇胺溶液5 mL、水25 mL和少量钙-羧酸指示剂,用NaOH溶液调成酒红色,并过量0.5 mL,用EDTA标准液滴定至纯蓝色(V)。同法做空白试验(V0)[12]。
钙离子含量计算:
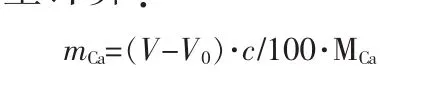
式中,mCa为钙离子质量,g;MCa为钙的原子质量。
过氧化钙含量计算:
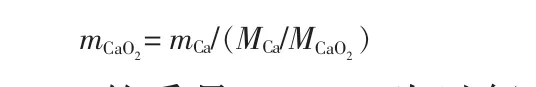
式中,mCaO2为 CaO2的质量,g;MCaO2为过氧化钙相对分子质量。
1.7 过氧化钙产率和纯度的计算
过氧化钙产率按下式计算:
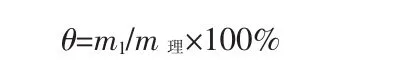
式中,θ为过氧化钙产品的产率,%;m1为实际制备所得产物的质量,g;m理为过氧化钙的理论产量,g。
过氧化钙纯度按下式计算:
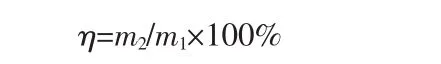
式中,η为产品纯度,%;m2为产物中过氧化钙的质量,g。
1.8 原料和产品物相分析与表征
原料和产品采用D8型X-射线衍射仪分析;产品的表面形貌采用Quanta 200型扫描电镜观察。
2 结果与讨论
2.1 钙提取工艺优化
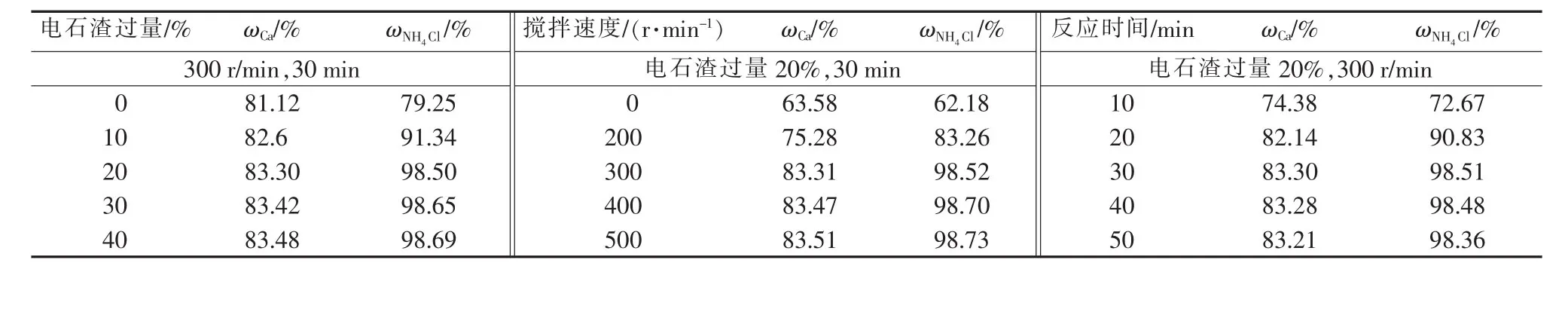
表1 工艺参数对电石渣钙提取率和氯化铵利用率的影响
固定NH4Cl溶液(质量分数为10%)添加量为62 g,考察工艺参数电石渣过量分数(%)、搅拌速度(r/min)和反应时间(min)对钙提取率(ωCa)和氯化铵利用率(ωNH4Cl)的影响,结果见表1。由表1可知,钙提取率和氯化铵利用率均随电石渣过量分数、搅拌速度和反应时间的增加而提高,当电石渣过量20%、搅拌速度为300 r/min、反应时间为30 min时,钙提取率和氯化铵利用率分别达到最大值83.30%和98.50%。然而,当进一步提高这3个因素值时,由于此时氯化铵已基本消耗完全,反应接近平衡,对钙提取率和氯化铵利用率的提高已无明显作用。因此确定适宜的反应条件:电石渣过量20%、搅拌速度为300 r/min、反应时间为30 min。
2.2 过氧化钙制备工艺优化
2.2.1 单因素实验
通过单因素实验,分别考察了稳定剂(磷酸二氢钠)用量(质量分数,%)、混合液用量(以氯化钙过量分数计,%)、反应时间(min)和搅拌速度(r/min)等工艺参数对过氧化钙产率(%)的影响。结果见表2。由表2可知,稳定剂用量越大,过氧化钙产率越高,但用量过大,成本会上升;产率随混合液用量增大而提高,但用量超过10%时,产率提高不明显;反应时间延长有利于产率提高,但时间太长,过氧化钙会在水中缓慢分解,使产率降低;搅拌速度过低,体系混合不充分,反应物粒子碰撞几率较小,产率不高,但超过600 r/min后,过快的搅拌速度会造成双氧水及产品过氧化钙的双重分解,同时也会带来能耗增加。根据上述分析,可确定最佳工艺参数:稳定剂用量为8%、混合液用量为10%、混合液浓度2 mol/L,反应时间为20 min、搅拌速度为300 r/min。在此条件下,过氧化钙产率接近80%,纯度为67.45%。
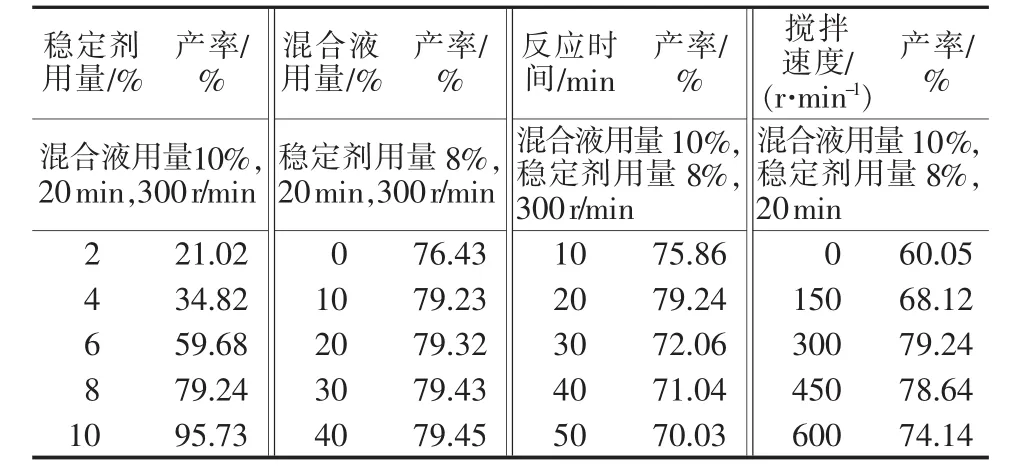
表2 工艺参数对过氧化钙产率的影响
2.2.2 正交实验
根据单因素实验结果,取稳定剂用量(A)、混合液用量(B)、反应时间(C)和搅拌速度(D)做 4 因素4水平正交实验,并进行二次优化。正交实验因素水平值见表3,正交实验结果及极差、方差分析见表4。
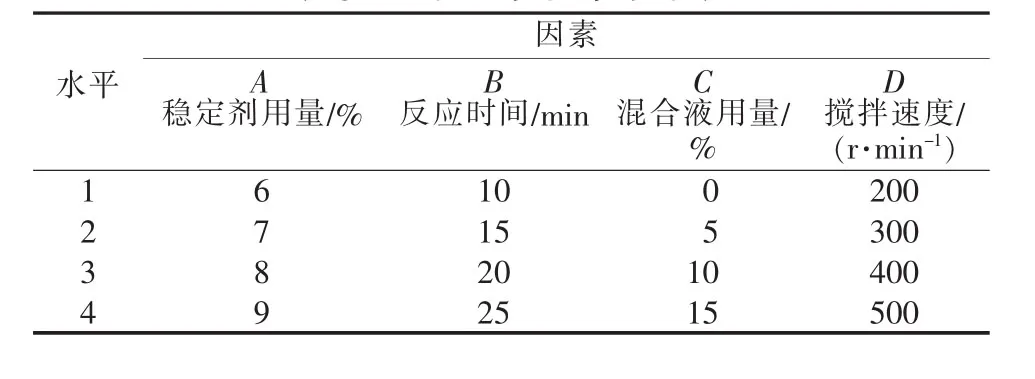
表3 正交实验因素水平表
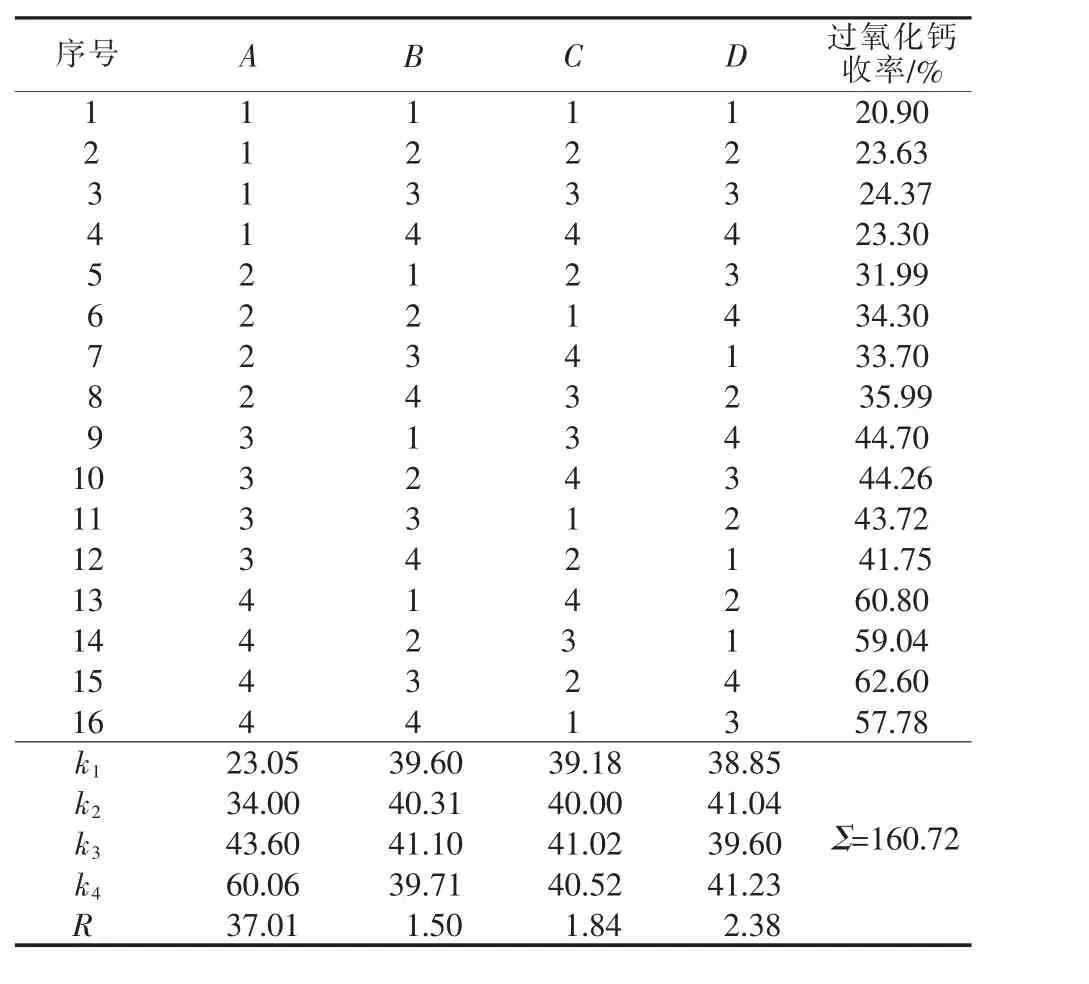
表4 正交实验结果
由表4中R值可知,各因素对产率影响程度大小的主次顺序为A>D>C>B,即稳定剂用量>搅拌强度>混合液用量>反应时间。根据k值可知最优水平组合为A4B3C2D4,即稳定剂用量为9%、反应时间为20 min、混合液用量为5%、搅拌速度为500 r/min。在此条件下做3次平行实验验证,结果得到产品平均收率为94.69%,平均纯度为69.74%。
2.3 氯化铵溶液循环工艺
2.3.1 循环液pH测定
将制备过氧化钙过程中的副产氯化铵溶液取样,测定其pH,结果见表5。由表5可知,循环液pH符合工艺要求范围。2.3.2 循环液氯化铵含量测定
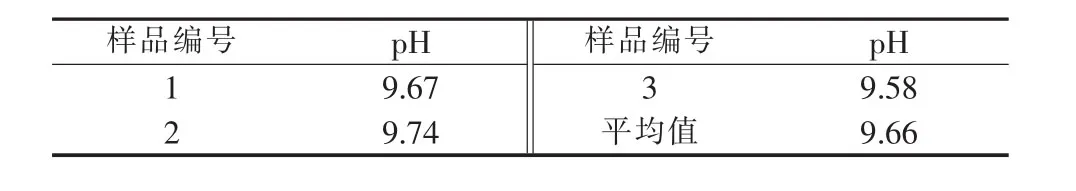
表5 循环液中的pH(23.3℃)
采用银量法测定循环液中氯化铵的含量,结果见表6。根据表6数据,通过适当调配制成所需浓度氯化铵溶液后循环使用。
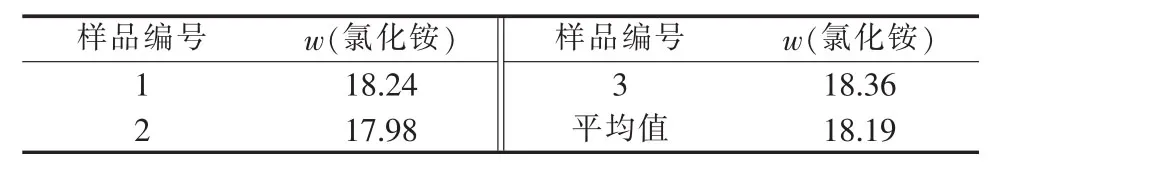
表6 循环液中氯化铵含量 %
2.3.3 循环工艺验证
取一定量的已调配成所需浓度的副产氯化铵溶液,用于钙提工艺过程,在电石渣过量20%、搅拌速度为300 r/min、反应时间为30 min的条件下操作,结果见表7。由表7可知,滤液循环提钙效果较为理想,与氯化铵原料效果相当。
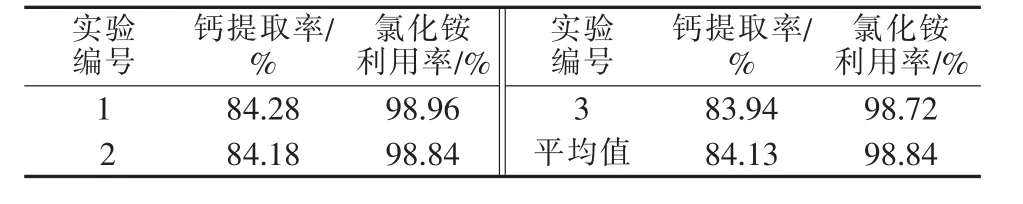
表7 循环工艺实验结果
2.4 原料和产品表征
2.4.1 XRD物相分析
图2~3为原料电石渣和产品过氧化钙的XRD谱图。由图2可以看出,原料电石渣主要以氢氧化钙为主,含有少量 Al、Si的氧化物杂质[13]。 图 3 经与JCPDS标准卡片对照,证明为碳酸钙型CaO2,该结果与文献[14]基本一致。
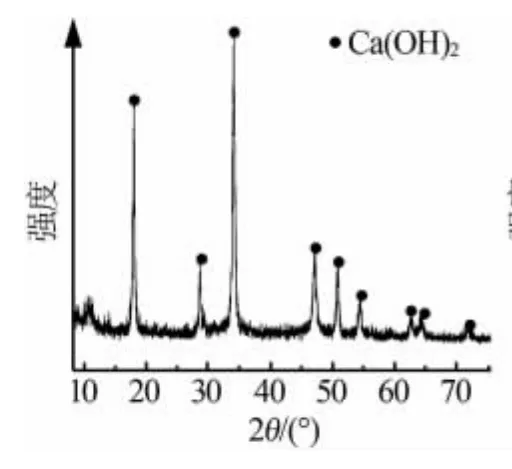
图2 原料电石渣的XRD谱图
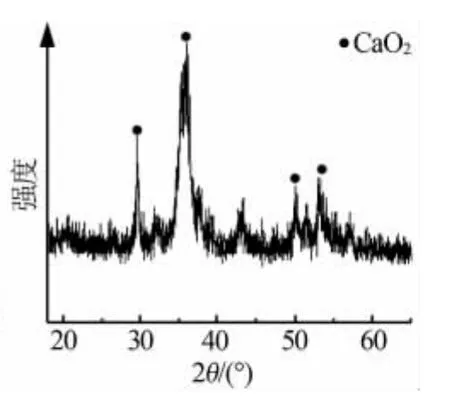
图3 过氧化钙产品的XRD谱图
2.4.2 SEM表征
图4为实验所得产品的SEM照片。由图4可知,产品基本呈球形颗粒状,大小和分布都比较均匀。

图4 产品的SEM表面形貌照片
3 结论
本工艺过程主要包括3个步骤:1)用氯化铵溶液与电石渣中的氢氧化钙反应,得到氯化钙和氨水的混合溶液;2)混合溶液与过氧化氢溶液反应制得产物过氧化钙,并副产氯化铵溶液;3)过氧化钙经干燥后获得最终产品,而副产氯化铵溶液经检测含量后代替原料氯化铵循环使用。
实验证明该循环工艺切实可行,具有环保、经济双重效益和潜在的工业化应用前景。通过单因素实验确定了钙离子提取的最佳工艺条件:电石渣过量20%、搅拌速度为300 r/min、反应时间为30 min。此时钙离子提取率为83.30%,氯化铵利用率为98.50%。通过单因素实验和正交实验2次优化,确定了过氧化钙制备的最佳工艺条件:稳定剂用量9%(质量分数)、反应时间为20 min、混合液用量为5%、搅拌速度为500 r/min。此时产品收率为94.69%,纯度为69.74%。
[1]姜文刚.采用100%电石渣生产高抗硫酸盐硅酸盐水泥熟料[J].水泥,2016(6):18-19.
[2]梁博,韩凤兰.电石渣制备碳酸钙微粉的晶型转变[J].无机盐工业,2016,48(10):63-67.
[3]王百年,葛礼响,曹萌,等.高Ca2+浓度CO2沉淀法由电石渣制备纳米 CaCO3[J].化工环保,2016,36(4):460-465.
[4]陈韩江,田生慧,何慧.电石渣增强改性聚氯乙烯塑料[J].高分子材料科学与工程,2015,31(12):98-103.
[5]周君生,徐伟,陈益兰,等.用工业废渣生产多微孔胶凝材料的研究[J].无机盐工业,2012,44(9):39-41.
[6]张卫红,郝丽娟,安永乐.聚合硅酸硫酸钙铝混凝剂的制备工艺研究[J].硅酸盐通报,2013,32(12):2627-2631.
[7]张骏,蓝思杰,李阳,等.用电石渣、钢渣和煤矸石制备可控性低强度材料[J].环境工程学报,2016,10(4):1967-1972.
[8]胡文,康媞,丁剑秋.电石渣处理煤矿酸性废水技术的研究[J].环境工程,2013(增刊):139-146.
[9]潘燕锋.电石渣在电镀废水处理中的应用[J].广东化工,2012,39(5):144-145.
[10]申荣平.电石渣在含铬废水处理中的应用[J].广东化工,2013,40(13):145-146.
[11]龚德鸿,张忠孝,朱兵,等.电石渣循环吸收/分离CO2特性研究[J].化工新型材料,2017,45(2):213-215.
[12]高誉,马兵,潘易,等.过氧化钙含量分析方法的比较研究[J].湖北农业科学,2011,50(17):3625-3627.
[13]蒋明,刘红盼,黄小凤.电石渣在环境污染控制中的应用[J].无机盐工业,2017,49(3):6-8.
[14]翟永青,鲁秀国,丁士文,等.过氧化钙常温水相法合成新工艺的研究(Ⅱ)[J].河北大学学报:自然科学版,2000,20(2):140-143.

