响应面法优化乳酸乳球菌电转化效率研究
韦云莹,王立峰,熊智强,王世杰,赵林森,艾连中
(1.上海理工大学 医疗器械与食品学院,上海 200093;2.南京财经大学 食品科学与工程学院,南京 210046;3.石家庄君乐宝乳业有限公司,石家庄 050221;4.河北一然生物科技有限公司,石家庄 050800)
乳酸乳球菌(Lactococcus lactis,L. Lactic)是被公认为安全的食品级微生物,具有较强的分解蛋白和产酸能力,能够抑制葡萄球菌、球菌和芽孢杆菌等微生物,所以被广泛应用于食品发酵工业[1-2]。作为益生菌,乳酸乳球菌不仅可以维持肠道菌群平衡,还可以刺激肠道免疫组织分泌免疫因子,从而提高机体免疫力[3]。乳酸乳球菌是乳酸菌属中一种重要的模式菌,具有生长迅速快、代谢相对简单、基因组小、操作容易和安全性高等特点[4]。此外,由于乳酸乳球菌抗原性较弱,自身蛋白分泌少,不在肠道中定值[5],不仅不会引起机体强烈的免疫应答和干扰目的蛋白的表达,还可以避免产生免疫耐受性。这些优点使得乳酸乳球菌成为食品级表达宿主的最佳选择[6]。近年来,利用分子生物学手段可以对乳酸乳球菌的生物学特性进行改造,使得乳酸乳球菌不仅可以用于乳制品的制备,提高食品的营养价值,还可以用于抗原的生产和人类疾病的治疗[7-8]。
乳酸乳球菌NZ9000 是乳酸菌中调控基因表达使用最广泛的一种宿主菌株[9],在食品和药品等工业生产中具有广阔的应用前景,因此获得高效的电转化效率至关重要。本研究首先单因素优化了乳酸乳球菌的电转化方法,接着利用响应面法对影响电转化效率的关键因素进一步优化,为发掘乳酸乳球菌感受态潜力奠定基础,为提高乳酸乳球菌感受态效率提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒
试验所用的质粒pNZ44 为乳杆菌穿梭质粒。
1.1.2 培养基
GM17 培养基:用于乳酸乳球菌NZ9000 的活化、培养和活菌计数。配方为:胰蛋白胨5 g/L、大豆蛋白胨5 g/L、牛肉膏5 g/L、葡萄糖5 g/L、酵母浸出粉2.5 g/L、β−磷酸甘油二钠19 g/L、维生素C 0.5 g/L、MgSO40.25 g/L。固体培养基另加琼脂粉20 g/L。
复苏培养基I:GM17 液体培养基。
复苏培养基II:含有CaCl22 mmol/L 和 MgCl220 mmol/L 的GM17 液体培养基。
复苏培养基III:含有蔗糖0.5 mol/L,CaCl22 mmol/L 和 MgCl220 mmol/L 的GM17 液 体 培养基。
复苏培养基IV:含有山梨醇0.5 mol/L,CaCl22 mmol/L 和MgCl220 mmol/L 的GM17 液 体 培养基。
大肠杆菌(LB)培养基:用于大肠杆菌的培养。配方为:胰蛋白胨10 g/L、酵母粉5 g/L、NaCl 10 g/L。121℃灭菌15 min。固体培养基另加琼脂粉20 g/L。
1.1.3 洗涤缓冲液溶液I:体积分数为10%的甘油、蔗糖0.5 mol/L。溶液II:体积分数为10%的甘油、蔗糖0.5 mol/L和乙二胺四乙酸(EDTA)0.05 mol/L 。
溶液III:乙酸锂二水100 mmol/L、二硫苏糖醇(DTT)10 mmol/L、蔗 糖0.6 mol/L、pH7.5 的
Tris-HCl 1 mol/L。
1.1.4 仪器与试剂
质粒提取试剂盒购自Axygen; Nanodrop 2000c 购 自Thermo 公 司; 冷 冻 离 心 机 购 自Sigma 公司;厌氧培养箱购自Ruskinn 公司。
1.2 乳酸乳球菌NZ9000 感受态制备方法
挑取平板划线后的单菌落至5 mL GM17 液体培养基中,30℃静置培养12~16 h;5%接种至50 mL GM17 液体培养基中,30℃静置培养12~16 h;8%接种至含有0.5 mol/L 蔗糖和25 g/L 甘氨酸的GM17 液体培养基中,30℃静置培养至吸光值OD600为0.3~0.4,离心弃上清,溶液III 重悬细胞,室温静置30 min,离心弃上清,先用溶液I 洗涤细胞,再用溶液II 洗涤,最后重悬于溶液I 中。每管100 μL 保存至−80℃,电转化备用。以上所有离心条件均为4℃,6 000 r/min,10 min[10]。
1.3 乳酸乳球菌NZ9000 感受态效率检测
取一定量质粒与100 μL 感受态细胞混匀,迅速转入预冷无菌的2 mm 的电转杯中,设置好电转参数后进行电击。电击完毕后,立即加入900 μL液体复苏培养基,并在30℃静置保温2~3 h,然后取100 μL 涂布于抗性平板,30℃静置培养24~48 h 后,观察并记录转化子个数。
以上试验均重复做3 次。根据加入质粒的量,计算每μg 质粒所得转化子的数目即为电转化效率,其公式如下:
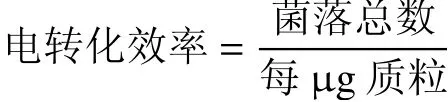
1.4 单因素试验
将液体活化后的菌液接种至含有25 g/L 甘氨酸和0.5 mol/L 蔗糖的GM17 培养基中,分别培养至OD600为0.2,0.4,0.6,0.8 收集菌体并制备感受态。其他步骤不改变的情况下,比较电转化效率,寻找合适生长阶段。
在获得最优OD600的情况下,将液体活化后的菌液分别接种至含有甘氨酸浓度5,10,15,20,25 g/L 和蔗糖0.5 mol/L 的GM17 培养基来培养细胞并制备感受态。其他步骤不变的情况下,比较电转化效率,找到合适的甘氨酸浓度。
在获得上述最优条件的情况下制备感受态,分 别 将50,200,500,800,1 100 ng 的pNZ44质粒电转到乳酸乳球菌NZ9000 感受态中,观察不同质粒浓度对电转化效率的影响,找到最佳质粒浓度。
将制备好的感受态,分别在电场强度为7.5,10,12.5,15 kV/cm 下电击转化,比较电转化效率,获得最优电场强度。
在获得上述最优条件的情况下,比较不同复苏培养基I,II,III,IV 对电转化效率的影响,确定最佳复苏培养基。
在获得上述最优条件的情况下,比较不同复苏时间1,2,3,4,5,6 h 对电转化效率的影响,确定复苏时间。
1.5 响应面优化试验设计
在单因素试验的基础上,采用Box-Behnken 响应面设计法,对乳酸乳球菌NZ9000 电转化条件的关键因素作进一步研究和探讨,以获得其最佳电转化效率。Box-Behnken 试验设计见表1。其中,A,B,C 分别表示甘氨酸浓度、吸光值和电场强 度。

表1 Box-Behnken 响应面试验因素和水平Tab.1 Factors and levels of Box-Behnken test
2 结果与讨论
与乳酸乳球菌商业化感受态制备的过程相比,本课题组前期借鉴Papagianni 等[11]预处理细胞的方法,使用乙酸锂二水和DTT 处理细胞[10],电转化效率可达1.5×107CFU/μg DNA。但是使用含有甘氨酸浓度25 g/L 和蔗糖0.5 mol/L 的GM17 培养细胞,由于高浓度甘氨酸对细胞生长压力大,细胞生长缓慢,培养时间长,大大影响了试验效率。在此基础上,本研究对其电转化条件展开优化。
2.1 生长阶段对电转化效率的影响
目前关于乳酸菌电转化的研究表明,不同生长阶段的乳酸菌对电击的敏感程度不同[12]。选取4 个生长阶段的乳酸乳球菌NZ9000 制备成感受态并电转化,其结果如图1 所示。在细胞培养至OD600为0.4 左右时,电转化效率最高,可达4.81×106CFU/μg DNA。相比于稳定期的细胞,处于对数生长前期的细胞电转化效率更好。这可能是因为该时期细胞活性较好,细胞壁结构相对疏松 ,有利于外源DNA 的进入[13]。
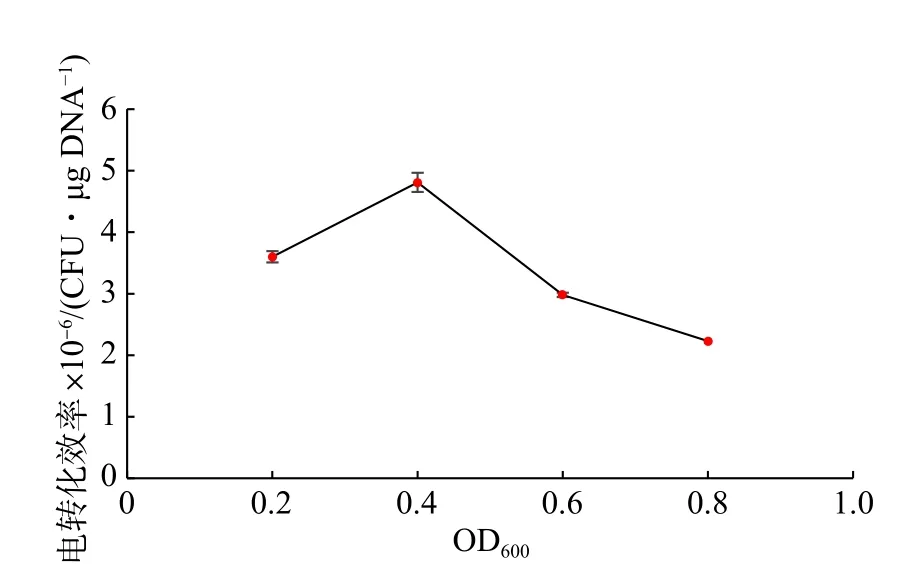
图1 生长阶段对乳酸乳球菌NZ9000 电转化效率的影响Fig.1 Effect of growth phase on the electrotransformaion efficiency of L.lactis NZ9000
2.2 甘氨酸浓度对电转化效率的影响
乳酸乳球菌是革兰氏阳性菌,其较厚的细胞壁是影响转化效率的关键因素。在培养基中添加一些细胞壁弱化剂有利于外源质粒进入细胞。甘氨酸作为常见的细胞弱化剂,已经广泛用于乳酸菌感受态的制备。但是,甘氨酸浓度过高可能会抑制菌体的生长,引起细胞裂解[14]。因此,选择合适浓度的甘氨酸至关重要。分别选取甘氨酸5,10,15,20,25 g/L 和蔗糖0.5 mol/L 的GM17 培养基,处理细胞至OD600约0.4 时制备感受态并电转化,其结果如图2 所示。在甘氨酸浓度为10 g/L时,电 转 化 效 率 达 到 最 高,为2.17×107CFU/μg DNA,随着甘氨酸的浓度升高,转化效率反而下降 。这与杨涓等[15]的研究结果一致。

图2 甘氨酸浓度对乳酸乳球菌NZ9000 电转化效率的影响Fig.2 Effect of glycine content on the electrotransformation efficiency of L.lactis NZ9000
2.3 质粒浓度对电转化效率的影响
外源质粒浓度会影响电转化效率,当细胞浓度一定时,添加不同浓度的外源质粒得到的转化子数目不同。质粒浓度过大,电转化产生的电阻较大,易于击穿电转杯[16]。本研究选择添加不同浓度的pNZ44 质粒进行电转化,考察其对NZ9000 电转化效率的影响,其结果如图3 所示。质粒浓度在500 ng 左右时,电转化效率最高达2.89×107CFU/μg DNA。质粒浓度再升高时,转化效率反而下降。
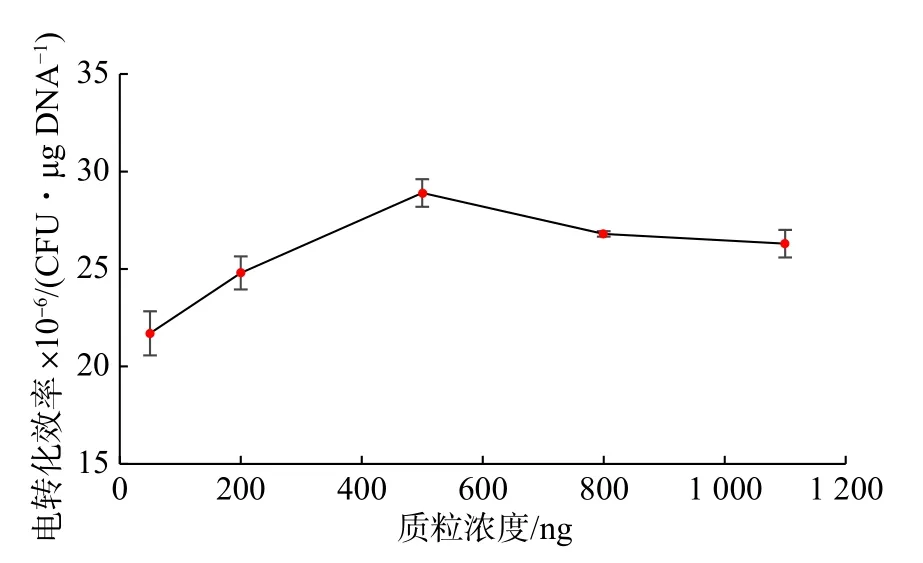
图3 质粒浓度对乳酸乳球菌NZ9000 电转化效率的影响Fig.3 Effect of plasmid content on the electrotransformation efficiency of L.lactis NZ9000
2.4 电场强度对电转化效率的影响
电转化的原理就是利用瞬时高压电击细胞膜形成孔洞,使DNA 分子进入细胞[17]。电场强度过低时,细胞膜难以形成孔洞;场强过高又可能会损伤细胞膜,影响存活率。只有在合适的场强范围内,电场强度越强,细胞膜上产生的孔洞越多,通透性越好,这样才更有利于外源DNA 分子的进入[18]。电场强度对电转化效率的影响如图4 所示,乳酸乳球菌NZ9000 的电转化效率在10 kV/cm 时达到最好,为2.95×107CFU/μg DNA。

图4 电场强度对乳酸乳球菌NZ9000 电转化效率的影响Fig.4 Effect of electric filed strength on the electrotransformation efficiency of L.lactis NZ9000
2.5 复苏培养基对电转化效率的影响
研究表明,细胞电击后很容易大量死亡。在培养基中添加一些物质如蔗糖、山梨醇等可能会有利于细胞膜孔洞的复原[19]。选择4 种培养基来复苏电转化后的NZ9000 细胞,结果如图5 所示。在GM17 培养基中电转化效率最低,而其他3 种培养基复苏后转化效率相差不大。复苏培养基II 比复苏培养基I 的转化效率更高,可能是由于CaCl2和MgCl2的存在能够促进外源DNA 的吸收 ,获得更多的转化子。
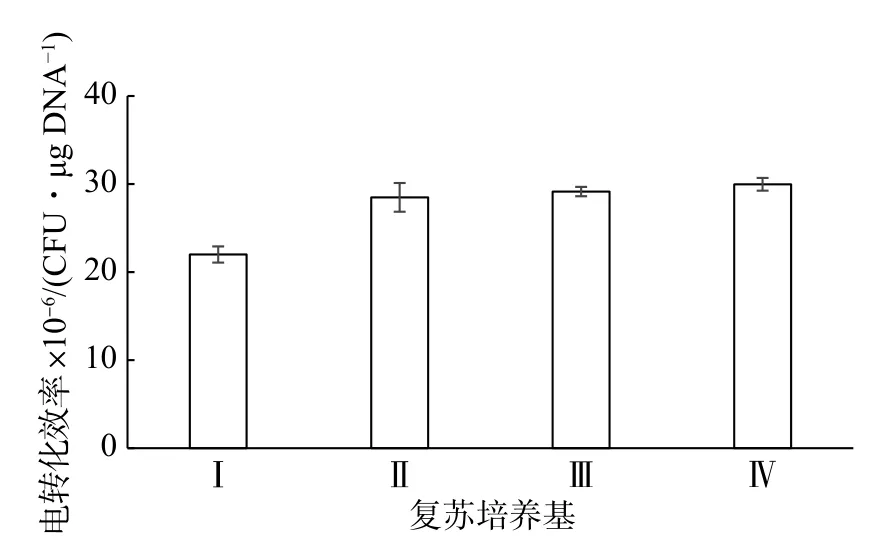
图5 复苏培养基对乳酸乳球菌NZ9000 电转化效率的影响Fig.5 Effect of incubation medium on the electrotransformation efficiency of L.lactis NZ9000
2.6 复苏时间对电转化效率的影响
细胞电击后一定的复苏时间有利于抗性基因的表达[18]。相比于直接涂布抗性平板,电转后先在不含抗生素的培养基中复苏一段时间可以获得更多转化子。分别将电击后的细胞复苏1,2,3,4,5,6 h 涂布抗性平板,结果如图6 所示。细胞复苏时间为2h时电转化效率较高,2h之后随着复苏时间的增加,电转化效率变化不大。因此复苏时间选择2h为宜。

图6 复苏时间对乳酸乳球菌NZ9000 电转化效率的影响Fig.6 Effect of incubation time on the electrotransformation efficiency of L.lactis NZ9000
2.7 响应面优化乳酸乳球菌NZ9000 电转化条件结果分析
通过单因素试验可以发现生长阶段、甘氨酸浓度和电场强度对电转化效率的影响较为显著,因此采用Box-Behnken 响应面试验对对甘氨酸浓度(A)、OD600(B)和电场强度(C)这3 个因素进行优化,得到的试验方案和数据结果见表2。

表2 Box-Behnken 试验设计及结果Tab.2 Box-Behnken test design and results
利用Design Expert 软件对试验结果进行方差分析及二次多项回归拟合,得到乳酸乳球菌NZ9000 电转化效率Y 对甘氨酸浓度、OD600和电场强度的多元回归方程为
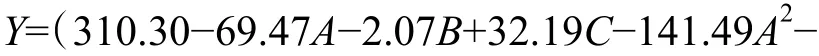

模型的方差和显著性分析结果如表3 所示。可见,模型概率值P(<0.000 1)小于0.01,表明该模型极显著,模型失拟项的P 值为0.674 4,大于0.05,所以该模型的拟合度较高。决定系数R2=0.982 0,调整决定系数R2adj=0.958 9,说明此模型与实际拟合较好,误差较小,可以用此模型对乳酸乳球菌NZ9000 电转化效率进行预测。由回归系数检验值F 可知,各因素对乳酸乳球菌NZ9000 电转化效率的影响程度为:甘氨酸浓度>电场强度>OD600。3 个因素对响应值都有极为显著的影响;交互项BC 影响最显著,其次分别是交互项AB 和AC;各因素的平方项对响应值也都具有显著影响,其中A2和B2的影响极显著,说明各影响因素对电转化效率的影响不是简单的线性关系。

表3 回归方程模型显著性分析Tab.3 Significance test for cofficients of the regression model developed
运用Design Expert 软件分析,得到乳酸乳球菌NZ9000 最优电转化条件为:电场强度12.5 kV/cm,OD6000.2,甘氨酸浓度7.77 g/L,预测在此条件下乳酸乳球菌 NZ9000 的电转化率达到 3.8×107CFU/μg DNA。为了方便操作,将上述预测的参数修改为:电场强度12.5 kV/cm,OD6000.2,甘氨酸浓度8 g/L。按此电转化条件得到乳酸乳球菌NZ9000 的电转化效率为(3.76±0.26)×107CFU/μg DNA,与理论值非常接近。这说明条件参数可靠,能够较好地预测乳酸乳球菌NZ9000 的电转化效率。与目前报道相比,优化后乳酸乳球菌NZ9000 的电转化效率提高了250%,并且缩短了培养时间,提高了试验效率。
3 结 论
通过单因素试验,对影响乳酸乳球菌NZ9000 电转化效率的各因素:生长阶段、甘氨酸浓度、质粒浓度、电场强度、复苏培养和复苏时间进行优化,并在此基础上建立了响应面模型,确定出乳酸乳球菌NZ9000 的最佳电转化条件,使电转化效率高达3.76×107CFU/μg DNA。本研究不仅为提高电转化效率提供了新思路,还促进人们对乳酸乳球菌的感受态潜力进行更深入的挖掘,以提高其工业性能和发酵产品的质量。

