蓝雪花组培快繁无菌体系建立的研究
宗树斌 王永平 任焕焕


摘 要:以带腋芽茎段为外植体,通过外植体消毒试验和培养基、激素种类及激素浓度正交试验对蓝雪花组培快繁无菌体系的建立进行研究。结果表明:外植体消毒用10%次氯酸钠灭菌8min,或用0.1%升汞灭菌6min,效果最佳,灭菌充分,致死率低。激素种类因素是影响诱导率的主导因素,试验最佳的组合是WPM培养基+0.4mg/L玉米素(ZT),诱导率达到92.3%。
关键词:蓝雪花;外植体;组织培养
中图分类号 S567 文献标识码 A文章编号 1007-7731(2018)24-0016-4
Abstract:Stem segments with axillary buds were used as explants to study the establishment of the rapid propagation aseptic system of Plumbago auriculata through explant disinfection experiment ,and orthogonal experiment of culture medium,hormone types and hormone concentration. The results showed that the best sterilization time of explants with 10% sodium hypochlorite was 8 minutes,the best sterilization time was 6 minutes with 0.1% liter mercury,the best sterilization time was filled with sterilization and mortality rate is low. Orthogonal test showed that hormone type was the dominant factor affecting the induction rate,and the best combination was WPM medium + 0.4mg/L zeatin (ZT) treatment,the induction rate reached 92.3%.
Key words:Plumbago auriculata;Explant;Tissue Culture
蓝雪花(Plumbago auriculata)原产南非,又名蓝花丹、蓝雪丹、蓝花矶松、蓝茉莉等,为白花丹科(蓝雪科)白花丹属多年生常绿灌木。蓝雪花长势强健,耐热,较耐高温高湿,病虫害少,管理简单,观赏期长。叶色翠绿,花色淡雅,炎热的夏季给人以清凉感觉,可盆栽点缀居室、阳台;成熟植株枝条悬垂,适宜大型容器组合盆栽,可用于场馆周边道路、立交桥等主要路段的绿化美化,可地栽林缘种植或点缀草坪[1]。蓝雪花花期正值少花的夏季,而且是自然界少有的蓝色花,受到园林工作者青睐[2]。蓝雪花作为一种新优观花花卉被引种栽培,在一些重要绿化地段被推广应用,发挥了很好的景观效果,其种苗需求量逐年递增,市场潜力巨大。另外,蓝雪花含有大量白花丹素[3-4],对风湿关节疼痛、血瘀经闭、跌打损伤、肿毒恶疮以及疥癣均具有较好的治疗作用[5],兼具较高的观赏价值和药用价值[6]。
目前国内对蓝雪花的研究刚刚起步,主要集中在其观赏特性、引种栽培、生物学特性等方面[7]。对蓝雪花的栽培管理和繁殖技术还主要只是一些经验性的总结,在学术方面的系统研究则比较少[8]。蓝雪花的繁育类型为异交型,开花强度不高,不利于吸引昆虫,不利于生殖成功,加之蓝雪花是典型的花柱异型植物,且具有自交不亲和性,故缺少传粉者则其结实率很低[9]。且其种子价格较为昂贵,扩繁系数低,造成目前传统繁殖方式已无法满足蓝雪花的应用需求。对蓝雪花无性繁殖技术的研究主要在于扦插繁殖技术[10,11]。组织培养快速繁殖技术可以克服传统繁殖方法的不足,繁殖系数大、速度快、保持优良性状,特别适合工厂化繁育等。因此,对蓝雪花开展组织培养研究,建立无菌体系,是蓝雪花组培工厂化繁育技术体系的基础,同时也为蓝雪花利用组织培养技术进行遗传育种及有用物质的制备提取奠定基础,具有重要意义。
1 材料与方法
1.1 试验材料 以江苏农林职业技术学院玻璃温室盆栽培育的2年生蓝雪花为母株,采集生长健壮、发育充实、无病虫害的当年生枝条,在枝条的中上段,去掉叶片,剪取带腋芽的茎段为蓝雪花组织培养的外植体。
1.2 试验地概况 试验在江苏农林职业技术学院风景园林学院实训基地进行。实训基地有现代化的玻璃温室2700m2和设备齐全的组培室300m2,基地常年进行多种观赏植物的引种、栽培繁育工作,能够为试验提供充足良好的条件。
1.3 试验方法
1.3.1 外植体消毒方法 把剪取好的带腋芽的茎段放入烧杯,蒙上1层纱布,在流水下冲洗30min,拿到接种室无菌操作台上,先用75%酒精消毒60s,倒掉酒精,用无菌水冲洗1遍,然后按照表1的要求各处理采用不同的灭菌剂及灭菌时间进行消毒,最后再用无菌水冲洗3~5遍,外植体消毒完成。在无菌操作台上,用消过毒的剪刀和镊子对外植体进一步剪切,使外植体腋芽上端保留0.5~1cm长度,腋芽下端保留0.5~1cm长度,把剪切好的外植体接种到MS培养基的试管内,每个试管接种1个外植体,每处理接种30支试管,试验重复3次。放在培养室内进行培养,注意观察记录接种苗的污染情况、成活情况及致死情况。试管内染菌既为污染,试管内没有菌且腋芽萌动既为成活,试管内没菌但腋芽没有萌动既为致死。30d后统计计算各处理的污染率、成活率、致死率,分析得出最佳的外植体消毒方法。
1.3.2 培养基及激素选择的正交试验 采用1.3.1研究得出的方法进行外植体消毒,对蓝雪花初代培养无菌体系的建立进行初代培养基及激素浓度選择的进一步研究试验,把培养基、激素种类、激素浓度作为3个因素,每个因素设3个水平,因素水平见表2,采用正交设计表L9(34)进行试验,正交试验表见表3。
按照正交试验表,每处理接种10个培养瓶,每个培养瓶接种10个外植体,试验重复3次,随机区组设计。把培养瓶放置在温度(25±1)℃、光照强度36~54μmol/m2·s,光周期(12h光照/12h黑暗)条件下进行培养。观察记录外植体的分化诱导情况,60d后统计记录各处理的有效诱导苗数(有效诱导苗是指诱导芽苗高度2cm以上,至少含有1个茎节),计算各处理的诱导率。
诱导率(%)=(有效诱导苗数/接种苗数)×100
对各处理的诱导率利用SPSS22.0软件进行统计分析,进行极差分析、方差分析和多重比较。
2 结果与分析
2.1 外植体消毒方法 观察记录各处理外植体的生长情况,记录下污染的试管数、成活的试管数以及致死的试管数,算出各处理的平均污染率、平均成活率和平均致死率,结果如表4所示。
试验采用了10%次氯酸钠和0.1%升汞2种灭菌剂进行不同时间处理,根据表4结果,分别对10%次氯酸钠和0.1%升汞不同灭菌时间处理的灭菌效果作直观分析,如图1、2所示。
由图1和图2可以看出,随着灭菌时间的延长,污染率逐渐降低,成活率逐渐升高,而随着灭菌时间的进一步延长,开始出现致死率,并随时间的延长致死率逐渐提高,而成活率则相应降低。这是因为灭菌剂在一定时间内可以杀死细菌,但时间过长灭菌剂同样会对外植体有伤害作用使外植体致死。因此,在组培无菌体系建立外植体消毒时,均需准确找到1个时间节点,使得外植体能够灭菌充分,而又不会被致死。从图1可以看出,利用10%次氯酸钠灭菌剂消毒时灭菌时间8min为最佳,灭菌充分,而致死率很低;从图2可以看出,利用0.1%升汞进行消毒时灭菌6min为最佳。同时,比较图1和图2,从成活率和致死率的走势可以判断,0.1%升汞相对10%次氯酸钠更为敏感,在进行灭菌消毒时对时间的要求更为严格。
2.2 培养基及激素选择 统计培养基及激素浓度正交试验各处理的有效诱导苗数,算出各重复处理的诱导率,试验结果如表5所示。
由表5可知,平均诱导率最高的处理是处理9达到了92.3%,即诱导培养结果最佳的组合WPM培养基+0.4mg/L玉米素(ZT)。
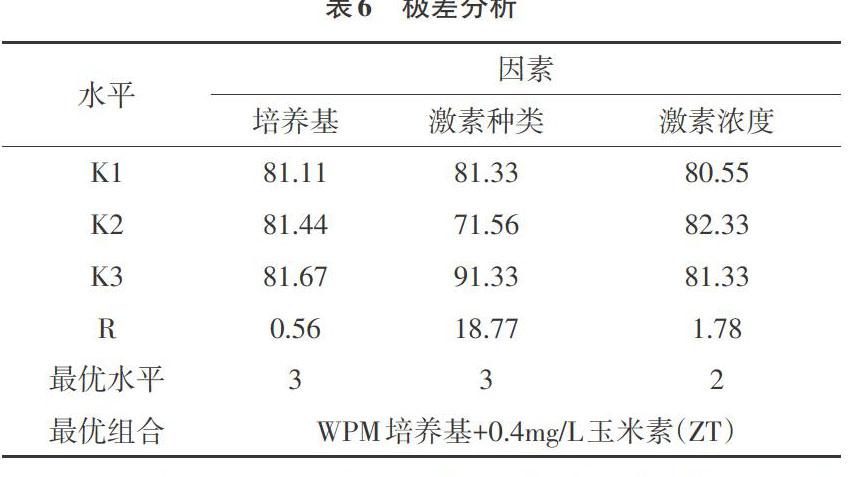
2.2.1 极差分析 对表5正交试验结果数据作极差分析(见表6)。通过极差分析得出最优组合是WPM培养基+0.4mg/L玉米素(ZT),这与试验结果是一致的。各因素对诱导率的影响大小依次为激素种类>激素浓度>培养基。
2.2.2 方差分析 对表5正交试验结果数据作方差分析。由表7可以看出,各因素对诱导率的影响,培养基和激素浓度显著性均未小于0.05,影响均不显著,而激素种类显著性小于0.01,影响极显著。对激素种类作进一步的多重比较分析。
2.2.3 多重比较 对激素种类对诱导率的影响进行用LSD检验多重比较。由表8可知,激素种类因素中,诱导率最高的是玉米素(ZT),平均诱导率达到91.33%;其次是6-BA,平均诱导率81.33%,与玉米素的差异达到极显著水平;诱导率最低的是IAA,平均诱导率为71.56%,与6-BA的差异也达到了极显著水平。
3 结论与讨论
利用带腋芽茎段为外植体进行蓝雪花组织培养,外植体消毒可以先用75%酒精灭菌60s后,再用10%次氯酸钠灭菌8min,或者用0.1%升汞灭菌6min,均能起到很好的消毒效果,灭菌比较充分,且致死率低。0.1%升汞灭菌剂相对10%次氯酸钠灭菌剂较为敏感,对灭菌时间要求更严。其他常见滅菌剂如过氧化氢、硝酸银、溴水等灭菌时间需要作具体的试验研究。
通过对培养基、激素种类、激素浓度3因素正交试验,研究了蓝雪花组培初代培养无菌体系建立的条件。3因素中激素种类对诱导率的影响最大,其次是激素浓度,最后是培养基。方差分析表明,激素种类对诱导率的影响极显著,激素浓度和培养基对诱导率的影响均不显著。进一步的多重比较表明,玉米素是最佳的激素处理,其次是6-BA,最后是IAA,3者之间的差异均达到了极显著水平。综合比较得到了最佳组合是WPM培养基+0.4mg/L玉米素(ZT)处理,最高诱导率达到92.3%。
参考文献
[1]刘华敏.蓝雪花的引种栽培[J].南方农业,2011(5):49.
[2]叶剑秋.小庭园植物推荐蓝雪花[J].园林,2008(5):51.
[3]徐晔春.蓝雪花[J].花木盆景,2010,3(5):32.
[4]Crouch I J,Finnie J F,Staden J V. Studies on the isolation of plumbagao from in vitro and in vivo grown Drosera species[J].Plant Cell,Tissue and Organ Culture,1990,21:79-82.
[5]张倩睿.白花丹化学成分的研究[J].中药材,2007,30(5):558-560.
[6]Santosect,Paivas R,Kaplanmac,et al.Atividade antileishmania de Plumbagao scandens(Plumbaginaceae)[J].RevBras Farm,1997,78(1):13-15.
[7]秦贺兰.园林新秀蓝雪花[J].中国花卉园艺,2007(16):24.
[8]陈果.蓝雪花(Plumbago auriculata)种子生物学与扦插繁殖特性初步研究[D].雅安:四川农业大学,2012.
[9]陈毅.蓝雪花(Plumbago auriculata)植物组织培养技术研究[D].雅安:四川农业大学,2013.
[10]周亮,谢桂林,邹义萍.蓝雪花扦插繁殖技术研究[J].西北大学学报(自然科学版),2017,47(1):82-86.
[11]宗树斌,顾立新,卢卡斯·斯考特.蓝雪花嫩枝扦插技术[J].福建林业科技,2015,9(3):121-124.
(责编:徐世红)

