肠瘤康基于p16/CyclinD1/CDK4/Rb通路对结肠癌HT29细胞的影响*
李建省,杨维建,旦孝三,孙尚龙
甘肃省中医院,甘肃 兰州 730050
结肠癌是人类最常见的消化道恶性肿瘤之一,近些年发病率和死亡率呈上升趋势,位居人类恶性肿瘤病死率的第3位[1-2],严重危害人们的生命健康。目前临床上对结肠癌的治疗以综合治疗为主,采用放疗、手术及中药辅助化疗的方法。肿瘤细胞的共性是细胞周期调控机制受到破坏导致细胞生长失控、分化受阻、衰老凋亡异常,而选择保护正常组织并诱导肿瘤细胞分化和凋亡的新药及有效的治疗新方案,调节偏离细胞周期轨道的肿瘤细胞回到正常轨道上,是当下抗肿瘤治疗的策略之一[2]。近年来有学者发现中药及其提取物如:肠复康[3]、大蒜素[4]、黄连素、吴茱萸碱及小檗碱[5]等成分对体外培养结肠癌细胞有抑制作用。本研究探索中药肠瘤康(由黄芪、槟榔、皂角刺、大蒜素和莪术等组成)对人结肠癌HT29细胞周期的影响,探究中药肠瘤康抑制肿瘤增殖的作用机制,为临床应用中药抗肿瘤提供实验基础。
1 材料与方法
1.1 材料 人结肠癌HT29细胞购买于中国科学院上海生物化学和细胞生物学研究所,中药肠瘤人结肠癌HT29细胞购买于中国科学院上海生物化学和细胞生物学研究所,中药肠瘤康提取液由甘肃省中医院制剂室提供,酶标仪(iMarkTM Microplate Reader,BIO-RAD)、流式细胞仪(ENC5V,USA)、二 甲 基 亚 砜 (DMSO)(NO.721D037)、RPMI-1640(AD19912263)购买自Solarbio公司。胎牛血清(RNBF3324)、MTT(SLBJ2169)、胰蛋白酶(SLBN6893V)、BCA试剂盒(RJ240514)、碘化丙啶(PI)(BCBN1506V)购买于Sigma公司。qPCR试剂盒均购自TaKaRa:PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒 (AI58964),SYBR Premix Ex TaqTMⅡ试剂盒(AI69802),引物由宝生物工程(大连)有限公司合成。
1.2 方法
1.2.1 细胞培养 用含10%胎牛血清和1%PS[100 μL 链霉素(100 μg/mL)和 100 IU/mL 青霉素]的RPMI-1640完全培养基常规培养人结肠癌HT29细胞,接种至培养瓶后置于37℃5%CO2恒温培养箱,每3天传代1次,培养至对数生长期后进行细胞计数,开始实验。
1.2.2 MTT实验 取对数生长期的人结肠癌HT29细胞,调整细胞浓度为104mL接种于96孔板内,待细胞完全贴壁后加入梯度浓度的肠瘤康溶液,分为对照组(肠瘤康 0 μg·ml-1),肠瘤康高(100 μg·ml-1)、中(10 μg·ml-1)、低(0.1 μg·ml-1)剂量组及5-氟尿嘧啶组(5-氟尿嘧啶组4μg·ml-1),并设置复孔。在加药后的第24、48和72小时后加入MTT溶液,于37℃5%CO2细胞培养箱中培养4小时后小心吸弃去孔内培养基,每孔加150 μL的二甲基亚砜(DMSO),用酶标仪测定波长490 nm处各孔的吸光值即OD值。
1.2.3 流式细胞术 细胞周期:收集用肠瘤康和5-氟尿嘧啶干预24小时后的HT29细胞,用PBS洗涤、重悬,弃上清,加入碘化丙啶(PI)溶液,进行流式细胞仪分析,并用MUTCYCLE软件分析细胞周期分布情况。
1.2.4 荧光实时定量PCR检测基因水平 将生长至对数期的结肠癌HT29细胞更换新鲜的RPMI-1640 完全培养基后,用 0 μg/mL、0.1 μg/mL、10 μg/mL和100 μg/mL肠瘤康和5-氟尿嘧啶分别干预,细胞培养箱中培养24 h,加适量Trizol、氯仿、异丙醇等提取各组细胞中的总RNA。取1 μL总RNA经超微量分光光度计检测A260/280的比值在1.8~2.0,提示RNA质量较好。总RNA用gDNA Eraser处理后,采用逆转录试剂盒将纯化的RNA逆转录合成cDNA。以cDNA作为模板进行荧光PCR扩增。实时荧光定量PCR采用TaKaRa公司的SYBR Premix Ex TaqⅡ试剂盒,在实时荧光定量Agilent(Mx3000P)PCR仪上进行,分别扩增p16、CyclinD1、CDK4、Rb mRNA(引物序列见表 1)。每个反应设3个重复。反应条件:预变性,95℃10分钟,1个循环;热循环,95℃15s,60℃15s,72℃30 s,40个循环,扩增结束后确认扩增曲线和溶解曲线,确认得出的数据的可信性。计算基因的相对表达量F=2-△△Ct。
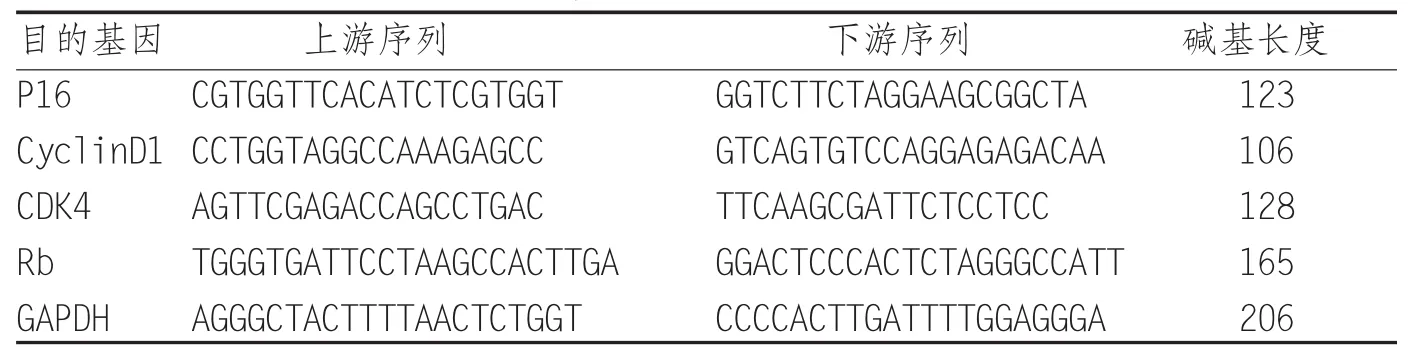
表1 荧光定量PCR引物序列
1.3 统计学方法 采用SPSS 21.0软件进行数据统计分析,定量资料以(χ±s)表示,多组间比较用单因素方差分析,组间两两比较用LSD-t检验分析,方差不齐时用Dunnett′s方法分析,P<0.05表示有统计学意义。
2 结果
2.1 肠瘤康对HT29细胞增殖的影响 肠瘤康能明显抑制HT29细胞的增殖,随着给药剂量的增加,增殖抑制率呈上升趋势,与对照组(0 μg/mL)相比(除24小时0.1 μg/mL肠瘤康组),肠瘤康组增殖抑制率显著升高(P<0.05),有明显的量效关系,也有一定的时间依赖性。见表2。
2.2 肠瘤康对HT29细胞周期的影响 在肠瘤康干预24小时后,与对照组相比,细胞在G1期的比例显著增加(P<0.05),S期的比例显著降低(P<0.05)。见表3。
2.3 肠瘤康对 HT29细胞 p16、CyclinD1、CDK4、RbmRNA表达的影响 与对照组相比,p16和Rb基因在肠瘤康组中表达随肠瘤康剂量增加依次升高;肠瘤康组CyclinD1和CDK4 mRNA的表达均下降,与对照组相比差异显著(P<0.05),其中肠瘤康高剂量组下降最为显著。见图1。

表2 肠瘤康对结肠癌HT29细胞增殖抑制率的影响(χ±s) n=3

表3 肠瘤康对HT29细胞细胞周期的影响(χ±s) n=3

3 讨论
细胞周期包含分裂间期和分裂期,分裂间期由G1期、S期和G2期组成,分裂期(M期)又分为前、中、后和末期。当G1期细胞受到调节因子调控或外界因子干扰时会进入既不生长也不分化的静息状态,即G0期[6]。近年来的研究表明,肿瘤的发生、发展与细胞周期密切相关,而细胞周期的调控因子中包含多种癌基因和抑癌基因。细胞生长周期中,最重要的调控点是G1期与S期之间的调控点[7]。细胞周期的G1期与S期受细胞周期素依赖性激酶(CDKs)的活化物即细胞周期蛋白(Cyclins)和细胞周期蛋白依赖性激酶抑制因子(CKIs)对CDKs的正负调节,也就是说细胞由G1期到S期的调控需CyclinD1的正调节和p16的负调节共同实现[8-9]。
在许多肿瘤中,CyclinD1由于基因扩增、染色体易位或倒置、转录增强、mRNA稳定性增强等导致其蛋白过度表达。而CyclinD1过度表达可使G1期缩短,促进细胞增殖。CyclinD1基因是一种原癌基因,其蛋白的过表达与许多肿瘤的发生和发展密切相关[10-11]。CDKI包括2大类,一类是INK4(p15INKb、p16INKa、p18INKc、p19INKd),主要抑制CDK4/6与CyclinD的结合及活性,抑制G1期;另一类是CIP/KIP(p21cip1/waf1、p27Kip1、p57Kip2)家族,主要抑制 CDK2、CDK3、CDK4/6,作用于细胞周期的多个阶段[12]。p16蛋白与CDK竞争性结合CyclinD而阻碍CDK与CyclinD形成复合物,进而导致CyclinD/CDK激酶失活,最终阻滞细胞从G1期进入S期,细胞增殖受到抑制[13]。
中医认为结肠癌由机体正气不足、湿毒瘀滞凝结而致病。根据中医临证辨证施治原则,肠瘤康以黄芪、槟榔、皂角刺、莪术、姜黄素、大蒜素和小檗碱等为主要成分,以补中益气,清热利湿为主要功能。研究表明:黄芪可将人宫颈癌C-33A细胞阻滞在G1[14],也可将小鼠肝癌细胞和肉瘤细胞阻滞在G0期,诱导肿瘤细胞凋亡[15-16]。还有研究表明黄芪、莪术配伍使用对人卵巢癌HO-8910抑瘤效果明显[17]。皂角刺及其提取物具有治疗癌症的作用,其中皂角刺总黄酮有抑制体外培养的结肠癌细胞HCT1116增殖的作用,且有良好的量效关系[18-19]。
本实验研究表明:流式细胞仪检测发现肠瘤康作用于HT29细胞24小时后,浓度在0.1~100 μg/mL内,细胞周期的G1期比例逐渐升高,S期比例明显下降,存在G1/S阻滞。通过以上研究结果推测肠瘤康主要是通过阻滞HT29细胞G1期向S期的进程,形成G1期阻滞,造成G1期细胞堆积并阻断DNA合成和复制,从而影响细胞周期,起到抑制肿瘤细胞增殖的作用。RT-PCR研究表明,与对照组相比,p16 mRNA 表达明显增强,CyclinD1、CDK4、RbmRNA表达明显下降。说明肠瘤康通过调控p16、CyclinD1、CDK4、Rb等细胞周期正负调节因子的表达而发挥作用,最终抑制细胞周期顺利进行,而导致肿瘤细胞凋亡。
综上所述,肠瘤康诱导的HT29细胞凋亡,可能是通过使细胞阻滞G1期无法完成自修复而发挥抗肿瘤作用,其分子机制可能与抑制p16/CyclinD1/CDK4/Rb通路有关。

