KCl浓度对Fe3+/SCN-平衡体系影响的实验探究
唐文秀 钱扬义 陈雪飞 王立新 陈秋伶

摘要: 利用手持技术设计2组实验,分别探究不同浓度的KCl溶液和不同质量的KCl晶体对Fe3+/SCN-平衡体系的影响。发现KCl溶液和晶体均使Fe3+/SCN-平衡体系颜色变浅,且变浅程度随KCl浓度和质量的增大而增大。继而设计4个实验以探究KCl的影响原因。结果表明: KCl使Fe3+/SCN-平衡体系颜色变浅原因是盐效应和配体取代反应共同作用的结果,二者的主次作用目前尚不明确。
关键词: Fe3+/SCN-平衡体系; KCl浓度; 色度计传感器; 实验探究
文章编号: 1005-6629(2018)11-0085-05中图分类号: G633.8文献标识码: B
1 问题提出
中学化学共涉及700多个化学概念,钱扬义等根据其重要程度排名从中筛选出100个作为“化学学科关键词”,“化学平衡”的重要程度排在第25位,是中学化学非常重要的化学概念[1~2]。“化学平衡”是人教版高中化学选修四第二章第三节的核心化学概念[3],是学生后续学习电离平衡、水解平衡及沉淀溶解平衡等的关键铺垫。
中学化学考试中常出现以下考点——KCl是否会对FeCl3与KSCN络合反应平衡有影响?答案解释为: 因该络合反应的离子方程式为Fe3++SCN-[Fe(SCN)]2+,无KCl,故KCl物质本身对该反应无影响,若加入KCl溶液,由于引起了溶液体积的变化,故平衡发生移动;若加入KCl晶体,因未引起溶液体积的变化,故平衡不移动。笔者通过对广州市5所中学高二师生的半结构访谈,了解到一线教师在教学中对该知识点的解释也是如此。然而,教材上并没有通过实验科学探究该知识点,即此答案尚无科学的证据支持。因此深入研究KCl对Fe3+/SCN-平衡体系的影响十分必要,研究结果将有助于学生科学掌握“浓度对化学平衡的影响”,进而科学建构化学平衡概念。
手持技术主要由传感器、数据采集器、计算机等构成,具有便携、实时、准确、综合和直观的特点,因此对化学平衡、化学反应速率、电化学等抽象化学核心概念与原理的教学具有极大的辅助作用。本研究以手持技术为主要工具,深入研究KCl对Fe3+/SCN-平衡体系的影响[4~5]。
2 研究设计
2.1 实验方案
为了使本研究实验在化学教学实践中方便演示与推广,本研究中KCl溶液浓度选取0.04mol/L、 4.0mol/L和饱和溶液;KCl晶体质量选取0.05、 0.10、 0.15、 0.20、 0.25g。对应设置2组实验进行探究,如表1所示。
2.2 实验原理
FeCl3溶液与KSCN溶液混合反应后,可以建立以下平衡:
Fe3+与SCN-还可生成[Fe(SCN)2]+、 Fe(SCN)3、 ……[Fe(SCN)6]3-等一系列配合物,在本实验的浓度配比下,主要以[Fe(SCN)]2+形式存在。
[Fe(SCN)]2+可以吸收蓝色光,故溶液的颜色为红色。若将溶液装入比色皿中,用色度计检测其透光率(T),根据朗伯比尔定律,T=It/I0(I0: 入射光强度,It: 透射光强度,本研究用百分数来表示透光率)。溶液中[Fe(SCN)]2+的浓度越大,溶液的颜色越深,对光的吸收程度越大,透光率越小[6, 7]。
因本研究中混合前FeCl3溶液的浓度为0.005mol/L, Fe3+的浓度很小,颜色很浅,当与KSCN溶液混合后,发生反应消耗大量Fe3+,溶液中只剩余更少量Fe3+,故忽略原混合溶液中Fe3+颜色的影响。同时,因FeCl3溶液在酸性条件下配制,且浓度较低,故忽略Fe3+的水解反应。
2.3 实验用品
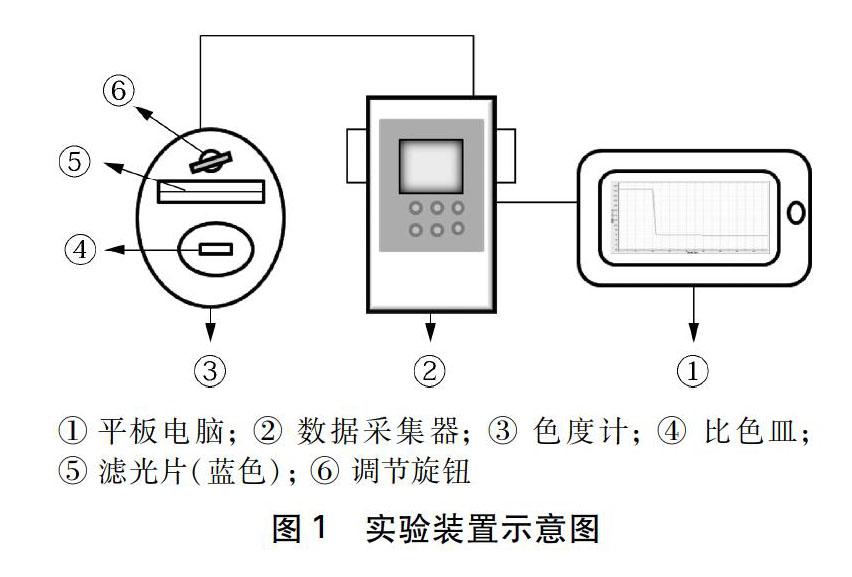
实验仪器: 胶头滴管、烧杯、玻璃棒、注射器(量程为1mL)、数据采集器、色度计、平板电脑
实验药品: FeCl3、 KSCN、 KCl、 NaCl、 NH4Cl、 KNO3、 NaNO3(本实验药品均为广州化学试剂厂生产,纯度为AR)
2.4 实验步骤
在100mL小烧杯中混合25mL 0.005mol/L FeCl3溶液与25mL 0.01mol/L KSCN溶液,得到红色混合溶液;取9只比色皿各加入3mL混合溶液,分别编号为1、 2……9;另取1只比色皿加入3mL去离子水,编号为10。
连接实验装置(如图1),启动数据采集器和平板电脑,设置采样频率1次/秒,时间为继续。以去离子水为参比溶液校准色度计传感器[8~10]。
(1) 取1號比色皿放进色度计测量透光率,用注射器注入0.1mL 0.04mol/L KCl溶液,待透光率稳定后点击“停止”,保存数据。
(2) 取2~10号比色皿,按实验方案设计(见表1)加入药品,重复步骤(1)。
(3) 清理仪器,导出数据,在Origin 8.5软件中作图。
3 结果与分析
3.1 实验组1的实验结果与分析
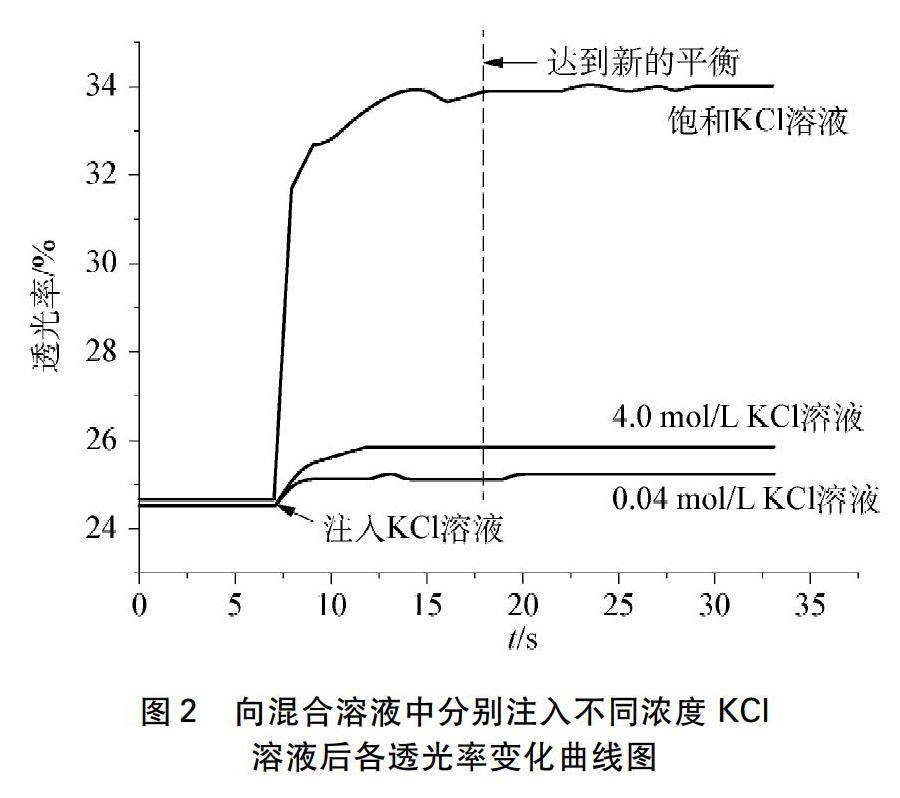
由图2可知,往Fe3+/SCN-平衡体系中加入KCl溶液,混合溶液的透光率上升,颜色变浅,[Fe(SCN)]2+浓度减小,说明KCl溶液对Fe3+/SCN-平衡体系有影响;随着加入KCl溶液浓度的增大,透光率差(平衡移动前后透光率的差值,取正值)增大,颜色变浅程度增加,说明KCl溶液对Fe3+/SCN-平衡体系影响程度增加。
经计算,加入0.1mL饱和KCl溶液后,混合溶液的透光率差为9.4%,大于加入0.1mL去离子水后混合溶液的透光率差(0.9%)。按照教辅和日常教学中的解释,即往Fe3+/SCN-平衡体系中加入KCl溶液,溶液颜色变化是由于体积的变化,也就是说颜色变化与加入的KCl溶液浓度无关,只与体积有关,若体积相同,则影响一致,这明显与实验结果不符。
图3中实验为空白对照,曲线先上升后平稳,说明加水稀释,混合溶液的颜色变浅,透光率升高,即注入0.1mL溶液会因为体积的变化而对混合溶液的透光率造成影响。经计算,注入0.1mL去离子水后混合溶液透光率差为0.9%,小于向混合溶液中注入不同浓度KCl溶液的透光率变化值,说明KCl溶液本身也影响着混合溶液透光率的变化。
关于KCl引起Fe3+/SCN-平衡体系发生平衡移动的原因,笔者查阅了大量文献和书籍发现目前说法不一,主要有以下3种。Driscoll[11]、柳一鸣[12]、高世雄[13]等认为出现该现象的原因为“盐效应”,不能用简单的化学平衡移动来解释,因为往Fe3+/SCN-平衡体系中加入NaNO3、 NH4NO3等盐也会使溶液颜色变浅,平衡向左移动。他们认为,虽然这些物质与平衡无关,但均属于电解质,在溶液中发生电离。由于离子电场的作用,每一个离子都受到一群带有异性电荷离子的包围形成了“离子氛”。加入KCl、 NaNO3、 NH4NO3等盐后,使得溶液中的Fe3+、 SCN-的行动受到一定程度的限制而使其有效浓度降低,从而导致平衡向左移动,溶液颜色变浅,该效应即为“盐效应”。陈珍珠、施志斌[14]、吴永兴[15]等认为KCl引起Fe3+/SCN-平衡移动的原因是加入KCl后发生了配体取代反应: [Fe(SCN)]2++4Cl-[FeCl4]-+SCN-,使得[Fe(SCN)]2+浓度减少,溶液颜色变浅。顾晔[16]认为前两种解释在处理不同平衡体系问题时既对立又统一,电解质的不同,2种原因的主次关系就不同,并认为往Fe3+/SCN-平衡体系中加入不含Cl-的盐时,“盐效应”为主要原因;往Fe3+/SCN-平衡体系中加入含Cl-的盐或盐酸时,发生了配体取代反应为主要原因。
基于以上文献分析,笔者以本研究的实验步骤,通过往4只装有Fe3+/SCN-混合溶液的比色皿中分别加入0.1mL 0.04mol/L KNO3、 NaNO3、 NaCl、 NH4Cl溶液,做了4个KCl影响原因的探究实验,实验结果如下:
由图4可知,往Fe3+/SCN-平衡体系中加入KNO3、 NaNO3、 NaCl、 NH4Cl晶体,混合溶液的透光率上升,颜色变浅,[Fe(SCN)]2+浓度减小,说明这4种盐对Fe3+/SCN-平衡体系均有影响,且影响程度各不相同。
一方面,加入不含Cl-的KNO3、 NaNO3溶液,使得Fe3+/SCN-平衡体系颜色变浅,[Fe(SCN)]2+浓度减小,笔者认为,这是因为引起盐效应而使得混合溶液各离子的有效浓度降低,根据勒夏特列原理,Fe3+/SCN-体系平衡向逆反应方向移动,故[Fe(SCN)]2+浓度减小。因KNO3和NaNO3的平均活度因子不同,盐效应程度不同,故2个实验[Fe(SCN)]2+浓度减少程度不同。另一方面,加入含Cl-的NaCl、 NH4Cl溶液,使得混合溶液中Cl-浓度大大增加,配体取代反应[Fe(SCN)]2++4Cl-[FeCl4]-+SCN-不能忽略,该反应的发生使得混合溶液中[Fe(SCN)]2+浓度减小,根据勒夏特列原理,Fe3+/SCN-体系平衡向正反应方向移动,但是移动的效果是削弱这种改变而不是消除,因此[Fe(SCN)]2+浓度仍减小。若加入氯盐产生影响的原因仅为发生配体取代反应,则加入等浓度等体积的NaCl、 NH4Cl溶液后,因Cl-浓度相同,影响的程度理应相同,但实验结果并非如此,说明往Fe3+/SCN-平衡体系中加入氯盐,[Fe(SCN)]2+浓度减小,是盐效应和配体取代反应共同作用的结果。二者作用的主次关系目前尚未可知,有待进一步探究。
3.2 实验组2的实验结果与分析
由图5、 6可知,往Fe3+/SCN-平衡体系中加入KCl晶体,混合溶液的透光率上升,颜色变浅,[Fe(SCN)]2+浓度减小,说明KCl晶体对Fe3+/SCN-平衡体系有影响;随着加入KCl晶体质量的增大,透光率差增大,颜色变浅程度增加,说明KCl晶体对Fe3+/SCN-平衡体系影响程度增加。
由以上分析可知,KCl晶体对Fe3+/SCN-体系平衡会产生影响,且与KCl溶液对其的影响趋势一致,这与教辅和日常教学中所做解释,即“KCl晶体对Fe3+/SCN-体系平衡无影响”产生冲突,说明教辅和日常教学的解释有失偏颇[17, 18]。图5中发现,向Fe3+/SCN-平衡体系中加入0.25g KCl晶体时,曲线先上升后下降,然后再上升至趋于稳定。曲线出现一个较大的凹峰,笔者随之做了一个对比实验,向去离子水中加入0.25g KCl晶体(见图7),曲线中也出现了一个类似的凹峰,笔者认为,该峰可能是由于KCl晶体非常细小,在溶解的过程中悬浮在溶液中,使得透光率出现短暂不稳定,并不影响实验的结果分析。
4 结语
利用手持技术探究了KCl对Fe3+/SCN-平衡体系的影响,结果表明,向Fe3+/SCN-平衡体系中加入不同浓度和不同质量梯度的KCl,溶液的透光率均增大,且透光率差随着KCl浓度和质量的增加而增加。说明KCl溶液和晶体均会对Fe3+/SCN-平衡体系产生影响,且KCl浓度持续增大,影响程度持续增加,课堂教学与教辅资料中就KCl对Fe3+/SCN-体系平衡影响的解释与实验结果不符。
通过4个验证实验,得出KCl对Fe3+/SCN-平衡体系产生影响是盐效应和配体取代反应共同作用的结果,二者作用的主次关系目前尚未可知,有待进一步探究。
参考文献:
[1]钱扬义,张积家,罗秀玲等.化学概念与化学“学科关键词”的学习与认知[M].北京: 科学出版社, 2009: 124~125.
[2]李言萍,钱扬义,陈博殷等.利用数字化手持技术探究电解硫酸铜水溶液过程中阳极附近pH变化[J].化学教育, 2017, 38(3): 48~54.
[3]宋心琦主编.普通高中课程标准实验教科书·化学反应原理(选修)[M].北京: 人民教育出版社, 2007: 26~27.
[4][6][8]錢扬义,叶静怡,邓峰等.手持技术在化学学习中的应用与建模研究[M].北京: 科学出版社, 2009: 4~5.
[5][7][9]王磊,魏锐,范林等.传感技术——化学实验探究手册[M].北京: 北京师范大学出版社, 2007: 29.
[10]韦新平.基于SOLO分类理论的化学“四重表征” 教学研究——以“浓度对化学平衡的影响”为例[J].化学教学, 2013, (10): 31~33, 49.
[11][17]Driscoll D.R. “Invitation to enquiry”: The Fe3+/CNS- equilibrium [J]. J. chem. educ, 1979,56(9): 603.
[12]柳一鸣.对氯化钾影响平衡问题的商讨[J].化学教育, 1993,(06): 39.
[13]高世雄.浓度对化学平衡移动影响实验中的一个误解[J].中学化学教学参考, 1983,(03): 33.
[14]陈珍珠,施志斌.氯化钾对铁盐和硫氰化钾的显色反应的影响[J].福建基础教育研究, 2015,(08): 83.
[15][18]吴永兴.固体KCl对FeCl3和KSCN溶液反应平衡移动的再讨论[J].化学教学, 1994, (07): 49~50.
[16]顾晔.三氯化铁与硫氰化钾平衡体系颜色变化的探讨[J].化学教育, 2014, 35(11): 85~86.

