同轴静电纺RSF载VEGF纳米纤维膜的制备与研究
1. 东华大学纺织面料技术教育部重点实验室,东华大学纺织学院,上海 201620;2. 上海交通大学医学院附属第九人民医院,上海 200011
静电纺技术利用外加电场使聚合物溶液或熔体带电,在喷头末端形成悬垂的锥状液滴,当液滴表面的电荷斥力超过其表面张力时,液滴表面会高速喷射出“射流”,经过电场的拉伸细化及溶剂的挥发,纤维最终固化并沉积于接收板上,形成纳米纤维[1]。同轴静电纺技术由静电纺技术发展而来,该技术不仅使制备的纳米纤维膜具有孔隙率高、比表面积大、均一性好、可在纳米尺度模仿天然细胞外基质[2-3]等特点,并且可以在芯层搭载各种药物,通过壳层的聚合物对芯层的药物进行保护[4-5],以达到药物缓慢释放的效果。
再生丝素蛋白(regenerated silk fibroin,RSF)具有无毒、生物相容性良好及可降解等性能[6-7],在生物医用领域得到了广泛的应用。血管内皮生长因子(vascular endothelial growth factor,VEGF)是由两个相同多肽链通过二硫键构成的同源二聚体糖蛋白,具备诱导血管再生的能力,而血管能为组织再生提供营养物质[8]。利用同轴静电纺技术,将RSF作为壳层包裹VEGF制成纳米纤维膜,其不仅在结构上模仿了天然细胞外基质,具有孔隙率高、比表面积大等特点,而且芯层的VEGF得到了良好的保护,可用于组织工程修复,具有一定的医用发展前景。
本文拟采用同轴静电纺技术,将RSF溶液作为壳层,VEGF和胎牛血清作为芯层,在固定其他因素的情况下,通过改变芯层流速,制备不同壳芯结构的同轴纳米纤维膜(简称“纳米纤维膜”)。然后采用扫描电子显微镜(SEM)、透射电子显微镜(TEM)及ELISA试剂盒等手段,对纳米纤维膜的纤维形态、纤维直径及其不匀率、壳芯结构、VEGF释放性能等进行对比分析。
1 试验
1.1 试验原料和试验仪器
桑蚕茧(江苏徐州产,简称“蚕茧”);VEGF(杭州联科生物技术股份有限公司);胎牛血清(赛默飞世尔科技有限公司);尿素(分析纯,上海凌峰化学试剂有限公司);溴化锂(纯度99%,萨恩化学技术有限公司);甲酸(分析纯,国药集团化学试剂有限公司);去离子水;透析袋(截留相对分子质量14 000,上海雷布斯网络科技有限公司);医用一次性注射针管(5.0 mL,市售);移液器(大龙医疗设备有限公司);ELISA试剂盒(武汉塞维尔生物科技有限公司);PBS磷酸缓冲溶液(上海元象科技有限公司)。
FA2004 电子天平(上海良平仪器仪表有限公司);SHJ-6A 磁力搅拌水浴锅(常州迅生仪器有限公司);DHG-9145A 电热鼓风干燥箱(上海一恒科技有限公司);LGJ-10 真空冷冻干燥机(北京松源华兴科技发展有限公司);KDS100注射泵(美国KD Scientific 公司);DW-P303-AADCD1高压直流电源[东文高压电源(天津)有限公司];TM-3000台式扫描电子显微镜(日本日立高科技有限公司);JEM-2100透射电子显微镜(日本电子株式会社);SynergyH1酶标检测仪(美国宝特仪器有限公司)。
1.2 试验方法
1.2.1 丝素蛋白的提取[9]
(1) 脱胶。将5 g蚕茧剪碎并浸没于150.0 mL浓度为8.0 mol/L的尿素溶液中,90 ℃水浴3 h后取出脱胶蚕茧,用去离子水洗净、烘干。重复该步骤3次,得到丝素蛋白。
(2) 溶解。将丝素蛋白经60 ℃水浴溶解于30.0 mL 浓度为9.3 mol/L的溴化锂溶液中,待冷却后用纱布过滤,去除未溶解的杂质,得到丝素蛋白溶液。
(3) 透析。把经过前处理的透析袋彻底洗净,将丝素蛋白溶液装入透析袋,用去离子水透析48 h,前12 h内每间隔4 h更换一次去离子水,之后每间隔8 h更换一次去离子水。
(4) 冻干。将经过透析的丝素蛋白溶液冷冻干燥,得到RSF。
和逍遥子(张勇)以及他的年轻团队比起来,我确实有些不一样的东西,比如有创始人的光环,有自己的阐释问题、运营管理的方式方法。但是,他们身上的东西我也没有,比如知识结构的全面性、系统性。
1.2.2 纳米纤维膜的制备
将RSF溶于甲酸中,配置成浓度为14 g/mL的RSF溶液作为壳层。在室温下搅拌24 h,待RSF完全溶解后静置、脱泡,然后装入一支一次性医用注射针管(5.0 mL)。同时,将胎牛血清作为芯层装入另外一支一次性医用注射针管(5.0 mL)。将两支针管分别置于两个注射泵上并连接至同轴针头。在室温下进行静电纺,采用包有铝箔的接地金属板接收纳米纤维膜。同轴静电纺装置如图1所示。
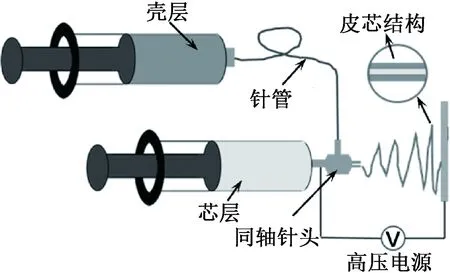
图1 同轴静电纺装置示意[10]
1.2.3 纤维形态观察与直径测量
将纳米纤维膜裁成0.3 cm×0.3 cm并贴于导电胶上进行喷金处理,通过TM-3000日立台式扫描电子显微镜观察纤维形态。同时使用Image J软件,随机选取50根纤维测量直径,并计算纤维直径不匀率。
1.2.4 纤维壳芯结构观察
将TEM专用铜网置于铝箔上收集纳米纤维,真空干燥后,通过JEM-2100透射电子显微镜观察纤维壳芯结构。
1.2.5 纳米纤维膜VEGF释放测试
裁取尺寸为1.5 cm×1.5 cm的纳米纤维膜放入1.0 mL磷酸缓冲溶液(PBS)中,置于37 ℃摇床上进行VEGF释放试验。每隔24 h用移液枪取出0.5 mL PBS(作为“样品液”),并加入0.5 mL新鲜PBS,使PBS的容积维持在1.0 mL。将样品液做好标记,然后冻存于-80 ℃条件下待测。使用ELISA试剂盒测试各个时间点取出的样品液的吸光度。依据VEGF标准释放曲线(根据已知VEGF浓度所测定的PBS溶液的吸光度,再通过拟合得到的VEGF浓度-吸光度关系曲线),可以计算出各个吸光度所对应的样品液中的VEGF浓度,通过进一步计算得到各样品液中的VEGF含量并将其累积,得到VEGF累积释放量,最后利用Origin软件处理,得到VEGF累积释放量与释放时间的关系曲线。
2 结果与讨论
2.1 芯层流速对纤维形态的影响
本课题组通过前期对RSF静电纺的研究得知,采用RSF溶液进行静电纺丝,当溶液浓度为14 g/mL时,设置纺丝电压为17 kV、流速为0.80 mL/h、收集距离为17.0 cm,可以获得形态规整的纳米纤维。因此,本文采用相同的纺丝电压(17 kV)和收集距离(17.0 cm),壳层流速采用0.80 mL/h 并保持不变,壳层为14 g/mL的RSF溶液,芯层为胎牛血清,改变芯层流速(0.60、0.40、0.30、0.15、0.10、0.05 mL/h)进行同轴静电纺试验,制备纳米纤维膜。图2所示为不同芯层流速下制备的纳米纤维膜的扫描电镜照片(放大倍数3 000)。表1给出了不同芯层流速下制备的纳米纤维膜中的纤维直径及其不匀率(CV值)。

(a) 0.60 mL/h

(b) 0.40 mL/h

(c) 0.30 mL/h

(d) 0.15 mL/h

(e) 0.10 mL/h

(f) 0.05 mL/h

芯层流速/(mL·h-1)纤维直径平均值/nmCV值0.601 0240.1390.408100.1330.307120.1350.156740.2800.106490.3080.055990.205
从图2可以明显看出,当芯层流速为0.60 mL/h时,扫描电镜照片中的纤维数量较少,且纤维呈扁平带状。在纺丝过程中,也发现当芯层流速设置为0.60 mL/h时,纺丝效率极低且铝箔上有类似水滴状的芯层溶液。芯层流速较大,一方面会加大壳层和芯层产生互溶的可能性,另一方面会使壳层对芯层的包裹效果变差,如壳层很薄或未能完全包裹芯层,因而所制备的纤维在外界因素如空气的压迫下形成扁平带状,而且不具备成纤性的芯层脱离壳层的包裹会直接喷射到铝箔上成为水滴状。随着芯层流速从0.60 mL/h减小至0.05 mL/h,纤维形态从较粗的扁平带状逐渐向圆柱形转变,当芯层流速为0.30 mL/h时几乎看不到扁平带状纤维。
结合表1中的数据可以得出,随着芯层流速逐步降低,纤维的平均直径逐渐减小。在芯层流速为0.60、0.40 mL/h这两种情况下,纤维直径的CV值较低,但纺丝效率较差。因此,本文选取芯层流速0.30、0.15、0.10、0.05 mL/h进行后续试验。
2.2 芯层流速对纤维壳芯结构的影响
在固定壳层(即RSF溶液)浓度14 g/mL、芯层为胎牛血清、纺丝电压17 kV、壳层流速0.80 mL/h、接收距离17.0 cm的条件下,改变芯层流速(0.30、0.15、0.10、0.05 mL/h)进行同轴静电纺试验,制备的纳米纤维透射电镜照片如图2所示。

(a) 0.30 mL/h

(b) 0.15 mL/h

(c) 0.10 mL/h

(d) 0.05 mL/h
如图2所示,4个芯层流速下获得的纳米纤维均呈现壳芯结构,可用于后续载VEGF试验。当芯层流速为0.30 mL/h时,虽然可看出纤维具备壳芯结构,但壳层非常薄,而且在观察过程中部分纤维未见壳芯结构。这说明芯层流速为0.30 mL/h时所制备的纤维,其扫描电镜照片虽未显示纤维形态有明显异常,但此时获得具有壳芯结构的纤维的效率较低,壳层对芯层的包覆不是很理想。对比图2中(a)~(d)可以发现,随着芯层流速逐渐减小,纤维壳芯结构逐渐清晰且较稳定,同时纤维的直径呈下降趋势,这与“2.1”节的测量结果一致。
结合“2.1”节测得的纤维平均直径及CV值可知,当芯层流速为0.05 mL/h时,纤维的平均直径最小且CV值较低;当芯层流速为0.15、0.10 mL/h时,纤维的平均直径较接近,但前者得到的纤维的CV值更低,这表明纤维的均匀性更好。因而,本文选取芯层流速为0.15、0.05 mL/h进行后续试验。
2.3 同轴静电纺RSF载VEGF纳米纤维膜的释放性能分析
基于以上试验,在纺丝电压(17 kV)、壳层流速(0.80 mL/h)、接收距离(17.0 cm)保持不变的条件下,改变芯层流速(0.15、0.05 mL/h)进行同轴静电纺。其中,壳层为14 g/mL的RSF溶液,芯层为VEGF和胎牛血清的混合溶液,VEGF的浓度为5 μg/mL。图3所示为不同芯层流速下制备的纳米纤维膜的VEGF释放曲线。
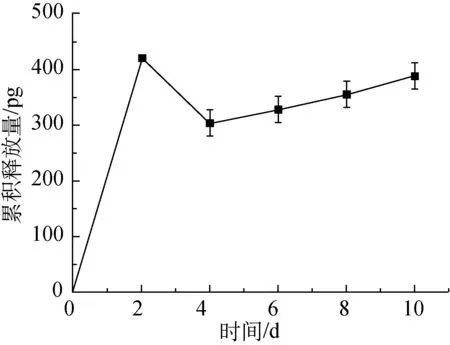
(a) 0.15 mL/h
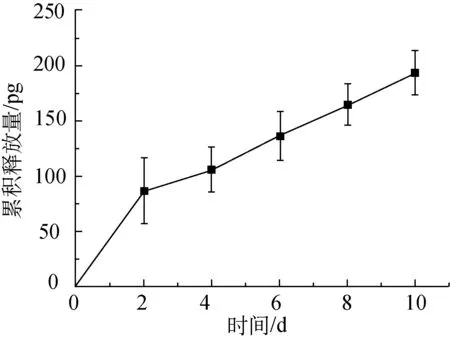
(b) 0.05 mL/h
从图3可以看出,两个芯层流速下制得的纳米纤维膜的VEGF释放曲线总体均呈上升趋势,表明同轴静电纺可以实现RSF包裹VEGF及VEGF缓慢释放。对比图3(a)和(b)可以发现,第2天时,芯层流速为0.15 mL/h时所制备的纳米纤维膜的VEGF累积释放量达到420 pg,而芯层流速为0.05 mL/h时所制备的纳米纤维膜的VEGF累积释放量为86pg。芯层流速为0.05 mL/h时所制备的纳米纤维膜,其纳米纤维的芯层厚度较小,VEGF的含量相应较少,因此VEGF累积释放量明显低于芯层流速为0.15 mL/h时。第2天到第10天期间,芯层流速为0.15 mL/h时所制备的纳米纤维膜,第4天的VEGF累积释放量为304 pg,比第2天下降了约27.6%,第10天的VEGF累积释放量为389 pg;芯层流速为0.05 mL/h 时所制备的纳米纤维膜,VEGF累积释放量呈持续上升趋势,第10天的VEGF累积释放量为194 pg。对其原因进行分析:芯层流速为0.15 mL/h时,虽然透射电镜照片显示纤维具有明显的壳芯结构,但由于芯层流速较快,并非所有芯层的VEGF都被RSF完好地包裹,可能有部分芯层突破壳层的包裹直接暴露在纤维表面,这使得第2天检测得到的VEGF累积释放量不仅包括芯层缓慢释放的VEGF,还包括暴露在纤维表面的VEGF,因此测试结果偏大;此外,RSF属于亲水性材料[11],将纳米纤维膜置于PBS中进行缓释试验,由RSF制成的纳米纤维膜浸润性较好,芯层流速为0.15 mL/h时,纳米纤维的芯层厚而壳层较薄,芯层中的VEGF更容易且更快地释放。
综上,芯层流速为0.05 mL/h时,纤维的壳芯结构最稳定,而且能够达到较好的VEGF缓慢释放效果。
3 结论
(1) 在固定壳层溶液(即RSF)浓度14 g/mL、纺丝电压17 kV、接收距离17.0 cm、壳层流速0.80 mL/h的条件下,随着芯层流速从0.60 mL/h减小至0.05 mL/h,纳米纤维由扁平带状逐渐向圆柱形转变,且纤维的平均直径逐渐减小。芯层流速过高会引起纺丝过程不稳定,且纺丝效率较低。当芯层流速为0.30、0.15、0.10、0.05 mL/h时,纺丝过程较稳定,且纤维形态良好。
(2) 在其他条件相同的情况下,随着芯层流速减小,纤维的壳芯结构中,芯层厚度减小。当芯层流速为0.15、0.05 mL/h时,纤维具有明显的壳芯结构,且纤维的均匀性较好。
(3) 同轴静电纺RSF载VEGF纳米纤维膜具备缓慢释放VEGF的能力。芯层流速为0.15 mL/h时,纳米纤维膜上负载的VEGF含量较大,相应的VEGF累积释放量更多,但易导致纤维的壳芯结构不稳定。芯层流速为0.05 mL/h时,纤维的壳芯结构最稳定,而且VEGF释放性能良好。

