水流条件对苦草及菖蒲的生长特性影响研究
巫丹 凌虹 黄夏银


摘 要:水生植物在磷的循环过程中扮演着不可或缺的角色,对湖泊的富营养化过程影响重大。对于生长在浅水湖泊水域的水生植物,水动力条件是其生长环境不可避免的一个重要因子。研究水流条件对植物的形态、生物量及营养盐的吸收等方面的影响具有很重要的现实意义。采用自主研发的浅水湖泊表面风应力扰动模拟装置,选择太湖常风速作为典型动态工况,选用苦草和菖蒲分别作为沉水植物和挺水植物的代表,研究了在生长期内水生植物生长特性对长时间水动力作用的响应过程。结果表明:常态风速5m/s的长期水流环境并没有改变苦草和菖蒲的生长速度变化趋势,但是抑制了苦草及菖蒲叶片的垂向生长,同时促进了枝叶的发育,提升了生物量在根系的分配。苦草整株生长速度减缓,生物量相对静态降低了33.27%,菖蒲对5m/s的动水环境具有良好的适应性,生物量相对静态提高了27.22%。
关键词:苦草;菖蒲;水动力;生物量;植株形态
中图分类号 X5 文献标识码 A 文章编号 1007-7731(2018)23-0115-05
Abstract:Aquatic plants play an indispensable role in the phosphorous cycle in eutrophic lakes. Hydrodynamic condition is an inevitable factor for aquatic plants growing in shallow lakes. It is of great significance to research the effects of water flow conditions on plant morphology,biomass and nutrient absorption. In this study,an especial equipment was developed to simulate the wind-induced current,Taihu Lake was chosen as the research object,Vallisneria natans and Acorus calamus were planted respectively. Based on the long-time hydrodynamic force with the typical velocity in Taihu Lake,the dynamic response of growth characteristic was discussed. The results showed that did not change the trend of plants growth rate,but the blade growth along the vertical was restrained,the development of branches and leaves was promoted and the ratio of root biomass was increased. For Vallisneria natans with hydrodynamic conditions,the growth rate got slow,the total biomass was reduced by 33.27%. For Acorus calamus with hydrodynamic conditions,the total biomass was increased by 27.22%. The research results would be beneficial to reveal the environmental function of aquatic plants which provides the theoretical foundation for bio-control of Lake Eutrophication.
Key words:Vallisneria natans;Acorus calamus;Hydrodynamic;Biomass;Plant morphological
水生植物是公認的改善水体环境和维持水体清洁的重要工具,具有调节水体生态系统的物质循环速度、增加水体生物多样性、抑制藻类过量生长、增强水体稳定性等特点,因而近年来利用水生植物治理污染和进行生态修复,已经得到广泛的重视和研究。
水生植物在生长发育及衰亡过程中通过光合、呼吸、残体分解等作用改变沉积物—水界面的理化环境进而影响沉积物和上覆水之间磷的迁移转化。水生植物在生长过程中能通过根及茎叶的吸收,使得上覆水和沉积物中的磷浓度降低[1-3];但是,处于衰亡的植物的残体腐烂分解,又将上覆水和沉积物富集的磷释放到水中,从而引起水质恶化,造成二次污染[4-5]。因此,水生植物的生长状态决定了水生植物净化水体的效果。
水流是影响水生植物生长和分布的重要因素[6]。单向性的水流所产生的机械应力对水生植物的结构和分布有重要影响。在水流的长期作用下,植物通常会产生形态可塑性,通过改变不同部位生物量分配的方式来确保生存[7-9]。水体密度大于空气,水流所造成的粘性介质比空气具有更大的拖拽力[10]。同样,水生植物通过自身的生长,影响水流流速和水体环境[11]。水体流速的改变对水生植物生物量以及群落组成都有明显的影响,较高的水体流速会从生理特征上限制水生植物繁殖、生长能力[12-13],流速增大会影响植物对光的吸收利用,快速的水流能显著增加底泥沉积物的再悬浮,减弱或分散光在水中的传播,影响水生植物的光合作用。另外,水流速度也会影响水生植物根部的固着生长。水流条件对水生植物生长的影响是多方面的,这一过程与机制极为复杂,目前虽然已开展一些相关探讨,但对指导实践仍缺乏一些定量成果。
笔者依据太湖实际情况,选择太湖常风速作为典型动态工况,选用苦草和菖蒲分别作为沉水植物和挺水植物的代表,研究了在生长期内水生植物的生长特征,对比分析了常态水动力条件及静态条件2种生长环境下不同植物及植株不同部位的响应差异,为富营养化湖泊生态治理过程中水生植物的选择与应用提供科学依据。
1 材料与方法
1.1 试验装置与材料
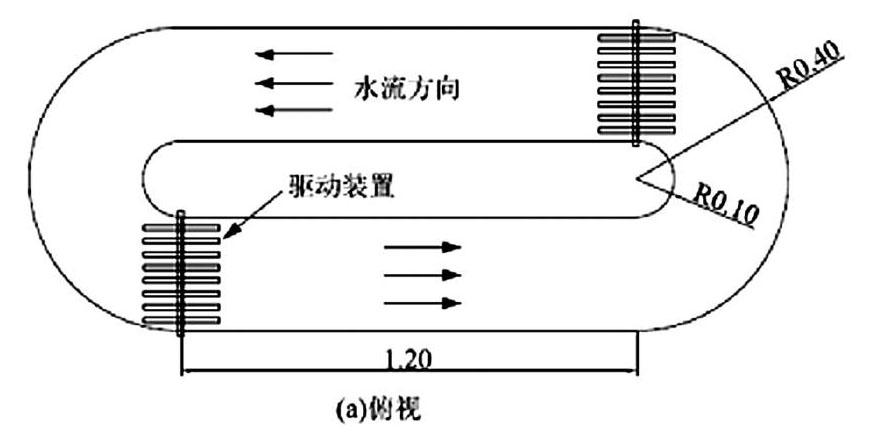
1.1.1 试验装置 研究采用自主研发的浅水湖泊表面风应力扰动模拟装置来模拟受风浪扰动的自然水体,并设置静态样作为对比。浅水湖泊表面风应力扰动模拟装置包括1个跑道型环形水槽,2套水流推进动力系统。跑道型环形水槽槽体长120cm、高80cm,两端采用半圆形有机玻璃板,弯道内径10cm,外径40cm(图1)。槽体外壁正中自上而下依次排列设置若干带阀取样口。该跑道型环形水槽顶部敞开,2套水流推进动力系统分别安装在水槽体两端的弯道出流处,跑道型环形水槽顶部放置流速量测固定装置,便于固定测速仪测杆,准确测量水槽内各断面水流运动情况。以太湖为研究对象,基于野外实测的太湖风速与对应的水体平均流速的关系,构建了本装置转碟转速与风速的对应关系,[W=0.24ω+6.581.8139]([W]为风速,[ω]为实验装置电机转速,10r/min≤[ω]≤250r/min)[14-16],以此通过测定流速反推模拟的风速。
1.1.2 试验材料 实验沉积物采自太湖梅梁湾地区(31°30′51″N,120°10′42″E)。沉积物湿容重为1.14×103~1.47×103kg/m3,含水率为0.65。沉积物粒度组成为砂粒5.4%、粉(砂)粒81.97%、黏粒12.63%。总磷含量为557mg/kg,有机质含量为9.49%。
沉积物自太湖梅梁湾采集回后,分别过100目筛去除其中的植物残体、石块等杂质后平铺于水槽底部,厚度设置为15cm。已有研究表明,沉积物表层10cm为磷参与水体动力交换的活跃层[17],同时,该厚度的设置也满足植物根系的生长需求。
采用太湖地区常见的2种水生植物:沉水植物苦草(Vallisneria natans)、挺水植物菖蒲(Acorus calamus)作为研究对象。采用太湖梅梁湾地区的湖水作为上覆水体。上覆水的基本性质如表1所示。
1.2 试验设计与方法 综合考虑日均风速及日最大风速出现频率,将5m/s设定为长时间风扰动的模拟工况,水体平均流速为0.1m/s。设动态实验组和静态对照组,动态实验组采用上述表面风应力扰动模拟装置,静态对照组实验装置为PVC实验桶(底直径400mm,口直径455mm,高675mm)。考虑了2种植物的株高、分枝数等一些形态特征,2种植物设定不同密度以保证单位面积生物量比较均衡。选取生长情况基本一致、长势良好的苦草及菖蒲进行移栽,实验分别设空白、苦草及菖蒲3组植物种植情况,各情况又分别设置有动态实验组和静态对照组,各组处理情况见表2。
植物移植完毕后,用虹吸装置缓缓注入上覆水以避免对沉积物的扰动,待植物生长稳定14d后开始试验。实验安排在6~10月,处于苦草及菖蒲的生长大周期(grand period of growth)。在98d的实验观测期内,每14d采1次样,各装置中植物样品取5株,植物采样后送至实验室用蒸馏水洗净,再用超纯水洗净,沥干水分,然后放置在阴凉处,待其表面剩余水分挥发后将植物茎叶部和根部分开,分别测定其叶片长度、叶片宽度、株高、单株叶片数、根长等形态指标,以及不同部位生物量(湿重、干重),以单个装置为独立单位分别取各指标的均值。
1.3 质量控制与数据分析 试验所用玻璃及聚乙烯器皿均以30%的HCl溶液充分浸泡24h以上后,以超纯水充分清洗。试剂为分析纯和优级纯,实验用水为超纯水。每个样品测定时设置3个平行样,取平均值作为结果。试验数据处理均采用Excel、Origin和SPSS统计分析。
2 结果与分析
2.1 试验过程中水体理化指标变化 试验过程中各装置水体的温度、pH、DO变化过程见表3。分别对比动静态条件下苦草及菖蒲,溫度、pH无显著差异(p>0.1,独立样本检验),动态环境下溶解氧大于静态环境。
2.2 水流条件对水生植物植株形态的影响 实验结果表明,在实验期内,苦草与菖蒲的株高均呈持续增长的趋势(图2a)。在2种不同的水体环境下的植株单株株高及单株叶片数差异性显著(p<0.05,独立样本检验),培养98d后,动静态条件下的苦草株高分别为55.1cm、69.5cm,动静态条件下的菖蒲株高分别为98.1cm、106.8cm,生长在静态水体中的苦草及菖蒲均分别高于其在动态水体中生长的植株。而生长在动态水体中的苦草及菖蒲单株叶片数均分别高于其在静态水体中生长的植株(图2b)。在实验期内,2种植物的叶片宽度均略有增加,在2种不同的水体环境下无显著差异(p>0.1,独立样本检验)。
Dawson与Robinson研究认为,水生植物的生长特征与植物受到的作用力存在相互关联的关系[18]。实验结果表明,在水体平均流速为0.1m/s的动态条件下,水流运动对水生植物产生拉伸、搅动、拖曳作用直接影响其垂向生长,而另一方面水体流动增加了溶氧的供给与交换,又有利于植物的新陈代谢,促进其枝叶的发育。
2.3 水流条件对水生植物生物量累积及分配的影响
至试验结束(98d),苦草和菖蒲的单株总生物量随时间推移均有不同程度的增加,均极显著大于实验初始值(p<0.05,独立样本检验)。在2种水流环境下,苦草及菖蒲均保持了良好的生长状态,经过98d的种植时间,相对于静态水槽,动态苦草的绝对生长量降低了33.27%,而动态菖蒲提高了27.22%。
图3列出了2种水流环境下苦草及菖蒲不同部位的生物量(鲜重)变化。对比分析植株茎叶部生物量,至试验开始42d以后,SVS相对于SVD开始出现较大的增长量并维持至试验结束,而2组菖蒲在28d后就开始出现较明显差异,且动态环境下的菖蒲增长量较大。对比分析植株根部生物量,发现在动态环境下生长的植株均大于静态环境。
图4列出了苦草及菖蒲生物量(鲜重)根冠比的变化过程。植物根冠比随时间推移呈现不同幅度的增长,在动态条件下生长的苦草及菖蒲根冠比分别高于其在静态条件下生长的植株。菖蒲根冠比显著高于苦草。
由于2种植物本身属性的不同,挺水植物菖蒲的生物量均远大于沉水植物苦草,挺水植物部分叶片生长在水面以上,植株具有发达的通气组织,有利于其根系的生长,而苦草植株长期淹没在水下,根系相对退化,故菖蒲根冠比显著大于苦草。Biggs等研究表明,水体流速对沉水植物的生物量以及群落组成都有很明显的影响[19]。本研究也发现,由于2种植物不同的形态特性,苦草叶片柔软易断,长时间的动水环境抑制了其叶片的生长,更适合在静态水体中生长,而菖蒲则对动水环境表现了更为良好的适应性,其粗壮坚挺的叶片能有效的抵挡试验设定的动水环境,而该环境中更为充足的溶氧也促进了菖蒲的生长。
2.4 水流条件对植株不同部位相对生长速度的影响
对不同植株生长能力进行比较时,生长速度是一个重要度量。为更深入的分析2种植物在不同水流环境下的生长过程,根据植株的干重数据,分别计算了茎叶部及根部的相对生长速度R(relative growth rate),计算公式如下:
试验结果表明,在2种水流环境下,2种水生植物的相对生长速度变化趋势是一致的(图5):茎叶部相对生长速度均呈现“先升后降”的变化过程,而植株根部在生长初期的相对生长速度都较大,随后呈现持续下降的趋势。对于苦草,SVS茎叶部的相对生长速度大于SVD,两者的日相对生长率峰值出现在第56d;SVS根部的相对生长速度在实验初期值较大(0~28d),随后呈下降趋势,SVD根部的相对生长速度在实验初期出现小幅上升,在第28d出现了相对生长速度的峰值。对于菖蒲,茎叶部及根部相对生长速度开始下降的拐点分别出现在第28d和第42d,两者茎叶部的相对生长速度无显著差异(p>0.1,独立样本检验),动态环境中菖蒲的地下部分相对生长速度要显著高于静态(p<0.05,独立样本检验)。
不同水流环境造成的影响体现在变化幅度的差异上。在动水环境下生长的苦草,由于其叶片的弱抵流性能,使其茎叶部相对生长速度相对于静态条件较小,两者生长速度出现拐点的时间点也有所不同,SVD茎叶部生长速度在第56d开始呈下降趋势,而SVS则是在第70d,这也表明在动水环境中生长的苦草长期受水动力作用胁迫,旺盛生长期的时间缩短,提前进入缓慢生长阶段。在实验后期,动态苦草根部相对生长速度出现较大的衰减并小于同时期静态条件,结合上述苦草生物量的变化情况,可以认为长时间的动水环境对苦草的叶片生长造成胁迫,植物生长能力的减弱也同时影响到了根系的生长。
对比2种环境下生长的菖蒲,其茎叶部相对生长速度无显著差异,这也与菖蒲粗壮坚挺的叶片对动水环境具有良好的适应性有关。在动水环境下生长的2种水生植物,其根系相对生长速度表现为在实验初期显著大于静态环境,一方面,这可能与水生植物面对生长环境的不同所采取的自我调节策略有关,由于叶片受到流动水体的长时间胁迫,促使了根部向下生长以稳固植株,同时通过加快繁殖根系、增大根系吸收表面积来保证植株对养分的获取,增加植物的生存能力;另一方面,可能是由于动水环境充足的溶氧条件促进了植物根系的生长[20]。结合不同水流环境下2种植物的根冠比变化,发现风速为5m/s的动态条件更能促进生物量在根系的分配量,这也验证了上述观点。
3 结论
依据太湖实际情况,选择太湖典型流速作为动态工况,选用苦草和菖蒲分别作为沉水植物和挺水植物的代表,研究了在生长期内水生植物生长特性对长时间水动力作用的响应过程,得到以下结论:
(1)相较于静态水体,风速为5m/s的动态环境抑制了苦草及菖蒲叶片的垂向生长,但动水的富氧环境能够促进枝叶的发育。在动态条件下,苦草的单株总生物量较静态降低了33.27%,而菖蒲的单株总生物量较静态提高了27.22%。苦草茎叶部生物量為SVS>SVD,菖蒲茎叶部生物量为EVD>EVS,2种植物动态条件下根部生物量均大于静态条件。动态条件促进了生物量在根系的分配。
(2)扰动风速为5m/s的动态条件并没有改变苦草和菖蒲的生长速度变化趋势:茎叶部生长速率均呈现“先升后降”的变化过程,而植株根系在实验初期的相对生长速率都较大,随后呈现持续下降的趋势。在动水环境下生长的苦草,由于其叶片的弱抵流性能,使其茎叶部生长速度相对于静态条件较小,旺盛生长期的时间缩短,提前进入缓慢生长阶段;而由于植物的自我调节策略和较好的富氧环境,根系生长速度在初期大于静态,随着长时间的动力胁迫,生长速度减缓并小于静态。菖蒲茎叶部生长速度无显著差异,根部生长速度显著大于静态,对长时间的动水胁迫有良好的适应性。
参考文献
[1]Kalkhoff S J,Hubbard L E,M.D. Tomer,et al. Effect of variable annual precipitation and nutrient input on nitrogen and phosphorus transport from two Midwestern agricultural watersheds[J]. Science of the Total Environment,2016,559:53.
[2]关秀婷,周林飞,成遣.不同生长期水生植物对湿地沉积物中营养物质含量的影响[J]. 沈阳农业大学学报,2017,48(1):70-77.
[3]李欢,吴蔚,罗芳丽,等. 4种挺水植物、4种沉水植物及其组合群落去除模拟富营养化水体中总氮和总磷的作用比较[J]. 湿地科学,2016,14(2):163-172.
[4]何娜,孙占祥,张玉龙,等. 不同水生植物去除水体氮磷的效果[J]. 环境工程学报,2013,7(4):1295-1300.
[5]马月.水生植物腐解—生长—水质的耦合关系研究[D].南京:南京师范大学,2015.
[6]Teeter A M,Johnson B H,Berger C,et al. Hydrodynamic and sediment transport modeling with emphasis on shallow-water,vegetated areas (lakes,reservoirs,estuaries and lagoons)[J].Hydrobiologia,2001,444(1-3):1-23.
[7]孔祥虹,肖兰兰,苏豪杰,等. 长江下游湖泊水生植物现状及与水环境因子的关系[J].湖泊科学,2015,27(3):385-391.
[8]Strand J A,Weisner S E B. Wave exposure related growth of epiphyton: implications for the distribution of submerged macrophytes in eutrophic lakes[J].Hydrobiologia,1996,325(2):113-119.
[9]Posey M H,Wigand C,Stevenson J C. Effects of an introduced aquatic plant,Hydrilla verticillata,on benthic communities in the Upper Chesapeake Bay[J].Estuarine Coastal & Shelf Science,1993,37(37):539–555.
[10]Barko J W,Smart R M. Sediment-Related Mechanisms of Growth Limitation in Submersed Macrophytes[J].Ecology,1986,67(5):1328-1340.
[11]Barrat-Segretain M H,Amoros C. Influence of flood timing on the recovery of macrophytes in a former river channel[J]. Hydrobiologia,1995,316(2):91-101.
[12]魏华,成水平,吴振斌. 水文特征对水生植物的影响[J]. 现代农业科技,2010(7):13-16.
[13]Shields E C,Moore K A. Effects of sediment and salinity on the growth and competitive abilities of three submersed macrophytes[J].Aquatic Botany,2016,132:24-29.
[14]李一平. 太湖水體透明度影响因子实验及模型研究[D].南京:河海大学,2006.
[15]Wu D,Hua Z. The effect of vegetation on sediment resuspension and phosphorus release under hydrodynamic disturbance in shallow lakes[J].Ecological Engineering,2014,69(69):55-62.
[16]Hua Z L,Wu D,Kang B B,et al. Flow Resistance and Velocity Structure in Shallow Lakes with Flexible Vegetation under Surface Shear Action[J].Journal of Hydraulic Engineering,2013,139(6):612-620.
[17]Qin B Q,Hu W P,Gao G,et al. Dynamics of sediment resuspension and the conceptual schema of nutrient release in the large shallow Lake Taihu,China[J].Chinese Science Bulletin,2004,49(1): 54-64.
[18]Dawson F H,RobinsonW N. Submersed macrophytes and the hydraulic roughness of a lowland chalkstream[J].Verhandlungen der Internationalen Vereinigung für Theoretische und Angewandte Limnologie,1984,22: 1944-1948.
[19]Biggs B J F. Hydraulic habitat of plants in streams[J].Regulated Rivers: Research & Management,1996,12(2-3):131-144.
[20]白雪.水体氧胁迫对不同水生植物生长的影响研究[D]. 呼和浩特:内蒙古大学,2015.
(责编:徐世红)

