二甲双胍对胰岛素抵抗患者甲状腺体积及结节的影响
张楠
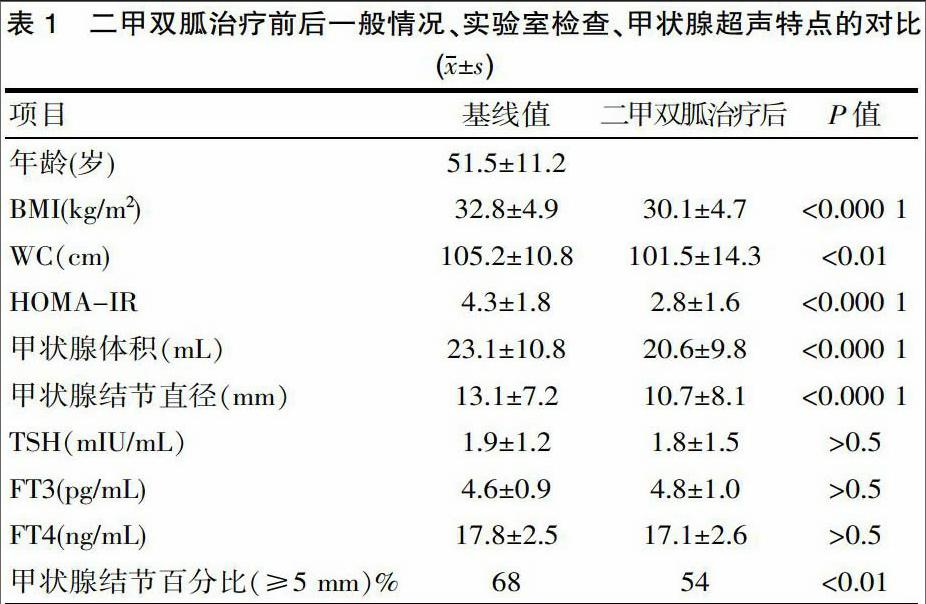
[摘要] 目的 研究探讨二甲双胍对甲状腺体积及结节大小的影响。方法 纳入新诊断的伴胰岛素抵抗的甲状腺功能正常的甲状腺结节患者30例,给予二甲双胍1 500 mg/d共6个月,收集基线及6个月时的BMI、WC、甲状腺体积及结节大小、甲状腺功能、HOMA-IR等指标。结果 二甲双胍治疗前后甲状腺功能(FT3、FT4、TSH)差异无统计学意义,HOMA-IR由基线的(4.3±1.8)下降至(2.8±1.6),差异有统计学意义(P<0.000 1),甲状腺体积由基线的(23.1±10.8)mL下降至(20.6±9.8)mL,甲狀腺结节直径由基线的(13.1±7.2)mm下降至(10.7±8.1)mm,差异有统计学意义(P<0.05)。结论 存在胰岛素抵抗的患者,二甲双胍可显著缩小甲状腺结节及甲状腺体积。
[关键词] 二甲双胍;胰岛素抵抗;甲状腺结节
[中图分类号] R581 [文献标识码] A [文章编号] 1672-4062(2017)09(b)-0089-02
Effect of Melbine on the Thyroid Volume and Nodules of Patients with Insulin Resistance
ZHANG Nan
Beijing Huairou Hospital, Beijing, 101400 China
[Abstract] Objective To study the effect of melbine on the thyroid volume and nodules of patients with insulin resistance. Methods 30 cases of thyroid nodules patients with normal thyroid function with insulin resistance were selected, and all patients met the inclusion standards and signed the informed consent, and the patients were treated with melbine 1 500 mg/d for six months, and indicators such as baseline, and BMI, WC, thyroid volume and nodule size, thyroid function and HOMA-IR at 6 months were collected. Results There were no differences in the thyroid functions (FT3, FT4, TSH) before and after treatment, and the HOMA-IR decreased from (4.3±1.8) on the baseline to (2.8±1.6), the difference was statistically significant(P<0.000 1), and the thyroid volume decreased from (23.1±10.8)mL to (20.6±9.8)mL, and the thyroid nodule diameter decreased from (13.1±7.2)mm on the baseline to (10.7±8.1)mm, and the differences were statistically significant(P<0.05). Conclusion The melbine can obviously shorten the thyroid nodules and thyroid volume of patients with insulin resistance.
[Key words] Melbine; Insulin resistance; Thyroid nodules
先前的研究发现胰岛素抵抗增加甲状腺体积及甲状腺结节的患病率[1-2],胰岛素有类似促甲状腺激素刺激甲状腺细胞增殖的作用[5],这种促进甲状腺细胞增殖的作用部分是通过胰岛素样生长因子1(IGF-1)介导的。现在有大量证据表明二甲双胍可调节这些激素及其信号转导[4-5],具有抗增殖作用,为研究二甲双胍在甲状腺形态中的作用提供了理论基础,因此二甲双胍可能作为抑制良性和恶性甲状腺增生的潜在方案。该研究的目的是观察二甲双胍对甲状腺体积和结节大小的影响,现报道如下。
1 资料与方法
1.1 一般资料
由同一人员收集患者身高、体重、腰围(WC)、并计算BMI。利用甲状腺彩超测量测量甲状腺体积,甲状腺体积(mL)=厚度(cm)×长度(cm)×宽度(cm)×π/6,甲状腺结节的大小取三个维度测量的最大直径值。分别收集基线及二甲双胍治疗6个月时的各项生化指标,血样本的收集均为空腹上午8:00-9:00点时采集,包括甲状腺功能(FT3 FT4 TSH)、甲状腺自身抗体(TPOAb TgAb),胰岛素抵抗由HOMA指数评估,HOMA-IR=空腹血胰岛素水平(IU/mL)×空腹血糖水平(mmol/L)/ 22.5受试对象均接受较低热量饮食及适当运动的基础治疗。应用二甲双胍1 500 mg/d。
1.2 纳入标准
甲状腺功能正常且有胰岛素抵抗的肥胖患者;年龄18~75岁;甲状腺结节最大直径大于5 mm;均签署知情同意书。共纳入30例患者(男性18例,女性12例)。
1.3排除标准
有甲状腺疾病:甲状腺功能异常、甲状腺自身抗体阳性或有颈部放疗史者;存在内分泌性肥胖、糖尿病、妊娠或哺乳期、肝肾功能异常、心力衰竭、严重的心理疾病等可能影响甲状腺功能的疾病;胸骨后甲状腺;甲状腺体积大于40 mL。endprint
1.4 统计方法
应用SPSS 17.0统计学软件进行统计学分析。计量资料用(x±s)表示,并用t检验,相关性分析采用Pearson's相关性检验,P<0.05为差异有统计学意义。
2 结果
①二甲双胍治疗前后甲状腺功能(FT3、FT4、TSH)无统计学差异。②二甲双胍治疗后HOMA-IR由基线的(4.3±1.8)下降至(2.8±1.6),差异有统计学意义(P<0.000 1)。③甲状腺体积由基线的(23.1±10.8)mL下降至(20.6±9.8)mL,甲狀腺结节直径由基线的(13.1±7.2)mm降至(10.7±8.1)mm,差异有统计学意义。④甲状腺结节≥5 mm所占的百分比由68%下降至54%,差异有统计学意义(P<0.01)。⑤二甲双胍治疗前后甲状腺体积及结节大小与血TSH水平间无相关性(r=0.2,P>0.05)。见表1。
3 讨论
多项研究[7-8]证实胰岛素抵抗患者甲状腺体积较大,甲状腺结节形成风险更高,高胰岛素血症可能增加甲状腺增生和甲状腺结节形成。Rezzonico J等[1]及Santisteban P等[9]研究亦证实TSH和胰岛素共存时促进甲状腺细胞增殖,其机制部分由IGF-1介导,通过胰岛素/IGF-1信号途径调控甲状腺基因的表达,并推测IGF-1参与甲状腺形态学改变。另外Takao kimura等[3]总结各项研究进展,提出TSH主要通过cAMP途径促进甲状腺细胞的增殖,并且胰岛素或IGF-1存在下可增加其促细胞增殖的敏感性。
Vigersky等[6]首次报道了二甲双胍降低甲状腺功能减退症患者的TSH水平,类似的研究结果亦有报道。但是Díez and Iglesias [10]针对甲状腺功能正常的糖尿病患者的研究中,应用二甲双胍与血TSH水平之间并无相关。SantosPalacios等[11]纳入278例甲状腺功能正常患者,给予二甲双胍治疗1年,发现二甲双胍治疗后患者血TSH水平趋向于接近2.98 mU/L,即基线TSH高于2.98 mU/L者二甲双胍治疗后其水平降低,反之低于2.98 mU/L者,其治疗后血TSH水平升高。而我们的研究发现二甲双胍治疗前后,甲状腺体积与TSH水平之间无统计学相关,提示二甲双胍可能通过非TSH依赖的途径影响合并胰岛素抵抗患者的甲状腺细胞增殖。
体外试验[12]证实应用二甲双胍几乎可阻断所有胰岛素介导的细胞增殖作用,提示二甲双胍可抑制胰岛素的促生长作用。Rezzonico J等[12]纳入66例伴有胰岛素抵抗的甲状腺结节患者,发现应用二甲双胍组及二甲双胍联合L-T4组,相比单用L-T4组及对照组,其甲状腺结节及体积均有减少,同时伴有HOMA指数的下降。我们的研究同样证实二甲双胍治疗后,甲状腺体积及甲状腺结节的大小较基线下降,具有统计学差异。因此,推测二甲双胍可能通过抑制胰岛素/IGF-1途径影响甲状腺体积及甲状腺结节的大小,当然也不能除外二甲双胍可能直接作用于甲状腺,影响其增殖。
4 结论
该项研究初步探讨了二甲双胍对伴胰岛素抵抗患者的甲状腺结节及甲状腺体积的缩小作用,为临床伴胰岛素抵抗甲状腺结节的治疗提供了新的思路。不足之处是缺乏对照组,尚需后续研究进一步证实。
[参考文献]
[1] Rezzonico J, Rezzonico M, Pusiol E, et al.Introducing the thyroid gland as another victim of the insulin resistance syndrome[J].Thyroid,2008,18(4): 461-464.
[2] Ayturk S, Gursoy A, Kut A, et al.Metabolic syndrome and its components are associated with increased thyroid volume and nodule prevalence in a mild-to-moderate iodine-deficient area[J].Eur J Endocrinol,2009,16(4): 599-605.
[3] Kimura T, van Keymeulen A, Golstein J, et al. Regulation of thyroid cell proliferation by TSH and other factors: a critical evaluation of in vitro models[J].Endocr Rev,2001,22(5):631-656.
[4] Seibel SA, Chou KH, Capp E, et al. Effect of metformin on IGF-1 and IGFBP-1 levels in obese patients with polycystic ovary syndrome[J].Eur J Obstet Gynecol Reprod Biol,2008, 138(1):122-124.
[5] Vigersky RA, Filmore-Nassar A,Glass AR,et al. Thyrotropin suppression by metformin[J].J Clin Endocrinol Metab,2006,91(1): 225-227.
[6] Cappelli C, Rotondi M, Pirola I, et al.Thyreotropin levels in diabetic patients on metformin treatment[J].Eur J Endocrinol, 2012,167(2):261-265.endprint
[7] Ittermann T, Markus MR, Schipf S, et al.Metformin inhibits goitrogenous effects of type 2 diabetes[J].European Journal of Endocrinology,2013,169(1):9-15.
[8] Ogbera AO, Kuku S, Dada O,et al.The metabolic syndrome in thyroid disease: a report from Nigeria[J].Indian Journal of Endocrinology and Metabolism,2012,16(3):417-422.
[9] SantistebanP,Acebron A, Polycarpou-Schwarz M, et al.Insulin and insulin-like growth factor I regulate a thyroid-specific nuclear protein that binds to the thyroglobulin promoter[J].Molecular Endocrinology,1992(6):1310-1317.
[10] Díez JJ,Iglesias P.Relationship between serum thyrotropin concentrations and metformin therapy in euthyroid patients with type 2 diabetes[J].Clinical Endocrinology,2013,78(4):505-511.
[11] Chen G, Xu S, Renko K,et al. Metformin inhibits growth of thyroid carcinoma cells, suppresses self-renewal of derived cancer stem cells, and potentiates the effect of chemotherapeutic agents[J].Journal of Clinical Endocrinology and Metabolism,2012,97(4):510-520.
[12] Rezzonico J,Rezzonico M,Pusiol E,et al.Metformin treatment for small benign thyroid nodules in patients with insulin resistance[J].Metabolic Syndrome and Related Disorders,2011, 9(1): 69-75.endprint

