糖尿病患者颈动脉斑块磁共振成像特征与急性脑缺血病灶形态关系研究
孙贝贝,李晓,刘晓晟,赵锡海,许建荣,赵辉林
动脉粥样硬化是2型糖尿病的重要并发症,是糖尿病致残、致死的重要原因之一[1]。颈动脉粥样硬化斑块与缺血性卒中关系密切[2-3]。本研究旨在运用磁共振管壁成像(magnetic resonance vessel wall imaging,MR-VWI)技术对颈动脉动脉粥样硬化斑块特征进行定性和定量化分析,比较2型糖尿病与非糖尿病患者症状侧颈动脉斑块特征的差异;明确2型糖尿病合并急性缺血性卒中患者中症状侧颈动脉粥样硬化斑块易损特征与同侧颈内动脉供血区急性脑缺血病灶大小及形态之间的关系。
1 资料与方法
1.1 病例资料 本研究连续入组2011年9月-2015年6月在上海交通大学附属仁济医院神经内科因颈内动脉供血区急性缺血性卒中入院的患者为研究对象。入组标准:①急性缺血性卒中(症状发生≤7 d);②颈内动脉供血区梗死且为单侧梗死;③症状发生一周内完成颈动脉MRI-VWI检查及头颅常规磁共振成像(magnetic resonance imaging,MRI)检查;④年龄≥18周岁;⑤签署知情同意书。
排除标准:①有MRI检查禁忌证或其他原因未完成MRI者;②入院心电图或超声心动图怀疑心源性卒中的患者(心房颤动、心脏瓣膜置换术后、可疑或确诊的心内膜炎);③颅内出血、烟雾病、肿瘤、感染或者任何与现在神经功能缺损症状不符合的患者;④症状侧颈动脉行剥脱术或颈部放射治疗患者。
收集患者基本资料包括:年龄、性别、体质指数(body mass index,BMI)、2型糖尿病、高血压、高血脂、吸烟以及既往脑梗死或短暂性缺血性事件史。入院24 h内完成美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分。实验室检查包括超敏C-反应蛋白、血肌酐、肾小球滤过分数、糖化血红蛋白(hemoglobin A1c,HbA1c)、高密度脂蛋白、低密度脂蛋白、甘油三酯及总胆固醇。
1.2 研究相关定义 急性脑缺血病灶定义为颈内动脉供血区MRI弥散加权成像(diffusionweighted imaging,DWI)上高信号、表面扩散系数(apparent diffusion coefficient,ADC)值降低。症状侧颈动脉定义为与DWI图像上颈内动脉供血区急性脑缺血病灶同侧的颈动脉或与神经系统症状相关的责任侧颈动脉[4]。2型糖尿病定义为快速血糖≥7.0 mmol/L或口服糖耐量测试≥11.1 mmol/L[5]。高血压定义为收缩压≥140 mmHg、舒张压≥90 mmHg或正在服用降压药。高血脂定义为低密度脂蛋白≥1.7 mmol/L及高密度脂蛋白<1.03 mmol/L(男性)或低密度脂蛋白≥1.7 mmol/L及高密度脂蛋白<1.29 mmol/L(女性)或正在降脂治疗的患者[6]。吸烟定义为一生中连续或累积吸烟6个月以上者,每天吸烟至少1支。
1.3 MRI检查技术
1.3.1 头颅M R I 在3.0 T磁共振扫描仪(Philips Intera Achieva 3.0T TX)上,使用标准8通道头线圈,行头颅T1加权成像(T1-weighted,T1WI)、T2加权成像(T2-weighted,T2WI)、弥散加权成像(diffusion weighted imaging,DWI)、3D-时间飞跃法(time of flight,TOF)扫描。主要参数为:①T1WI:重复时间(time of repetition,TR)/回波时间(time of echo,TE)2000 ms/12 ms;②T2WI:TR/TE 280 ms/105 ms;③T2-液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR):TR/TE 8000 ms/105 ms;④DWI:TR/TE 6000 ms/72 ms;⑤3D-TOF:25 ms/3.4 ms。矩阵128×128,层厚/间距6 mm/1 mm,视野(field of vision,FOV)24 cm×24 cm。
1.3.2 颈动脉MRI-VWI 参照既往报道的研究方法,在同一MRI平台上使用8通道颈部相控阵表面线圈(上海辰光),以患者颈动脉分叉为中心行3D-TOF、T2WI、磁化强度预备梯度回波序列(magnetization prepared rapid acquisition gradient echo sequences,MPRAGE)和增强前后T1WI扫描[7]。主要参数为:①3D TOF:TR/TE 20 ms/4 ms;②T1WI:4反转恢复(quadruple inversion-recovery,QIR),TR/TE 800 ms/10 ms;③T2WI:多平面双反转(multislice double inversionrecovery,MDIR),TR/TE 4800 ms/50 ms;④MP-RAGE:TR/TE 8.8 ms/5.3 ms。造影剂(Magnevist,Bayer Healthcare,Germany,Germany)按照0.1 mmol/kg静脉注射约5 min后进行延迟T1WI扫描。各序列FOV 14 cm×14 cm;矩阵256×256,平面重建最小分辨率0.55 mm×0.55 mm。T1WI和T2WI为16层图像,层厚/间距2 mm/0 mm;TOF扫描48层图像,层厚/间距1 mm/0 mm。总扫描时间约35 min。
1.4 MRI图像分析 由2名具有5年以上神经血管MRI诊断经验的医师采用盲法,分别独立完成对急性脑缺血病灶形态及症状侧颈动脉斑块的图像分析。使用已经发表的公认的脑供血区划分图像,在图形后处理工作站(GE AW 4.4)手动勾勒并计算症状侧颈内动脉供血区急性脑缺血病灶的体积[8];参照Bik Ling等[9]研究将病灶形态分为以下6种:①直径≤1.5 cm的小穿支动脉梗死(small perforating artery infarct,PAI);②直径>1.5 cm的大PAI;③软脑膜区梗死;④大面积区域性梗死;⑤分水岭区梗死;⑥多发病变。
颈动脉MRI-VWI图像质量分为1~4级。1级:图像中颈动脉管腔和血管外界均判断不清,信噪比(signal noise ratio,SNR)低,并有明显的运动伪影;2级:图像中颈动脉管壁可见,但管壁结构或管腔和血管外界轮廓判断不清,SNR较低或有运动伪影;3级:图像中颈动脉管壁结构、管腔和血管外界轮廓较清晰,管腔内血流信号抑制不完全,SNR高,伴少量运动或吞咽伪影;4级:图像中颈动脉管壁结构、管腔和血管外界轮廓清晰,管腔内血流信号抑制完全,SNR高,无明显伪影。≤2级图像不用于统计。
按照修正的美国心脏学会颈动脉粥样硬化斑块分型标准[2],统计症状侧具有复杂成分的颈动脉Ⅳ-Ⅵ型斑块[Ⅳ-Ⅴ型斑块:含有富脂质核(lipid-rich necrotic core,LRNC)并被覆纤维帽的斑块,可伴有钙化;Ⅵ型斑块:合并斑块表面破溃或斑块内出血,或血栓形成]。颈动脉斑块定量分析参照既往研究[4],在颈动脉斑块分析软件(CASCADE,USA)上进行独立分析,测得最大管壁厚度(maximum wall thickness,max WT),管壁体积标准化指数(percent wall volume,PWV)代表管壁体积与血管总体积的比值;LRNC、大的LRNC(定义为占斑块体积≥40%)、斑块内出血(intraplaque hemorrhage,IPH)及钙化(calcification,CA)存在与否及体积,纤维帽破裂(fibrous cap rupture,FCR)存在与否。另外,在颈动脉及大脑中动脉3D-TOF重建MRI血管成像(magnetic resonance angiography,MRA)上按照北美症状性颈动脉内膜剥离术试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET)的标准计算管腔狭窄率[10]。
1.5 统计学方法 使用SPSS 22.0(SPSS Inc,Chicago,IL)统计软件,计量资料符合正态分布,以表示;分类变量以百分比表示。计量资料采用单因素方差分析或秩和检验分析。采用Logistic回归模型分析颈动脉斑块存在危险因素,计算比值比(odds ratio,OR)以及95%可信区间(confidence interval,CI)。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估症状侧颈动脉斑块特征对急性脑缺血病灶发生的预测能力。P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病与非糖尿病患者临床基本信息比较研究共入组149例患者,其中9例因颈动脉图像质量≤2级被剔除,符合研究要求的共140例患者。年龄38~80岁,平均(63.48±9.67)岁。84例(60%)为男性,56例(40%)为女性。68例(48.6%)为2型糖尿病患者。
糖尿病和非糖尿病两组患者年龄、BMI及性别的分布无明显差异。2型糖尿病患者超敏C-反应蛋白水平较糖代谢正常患者增高,差异有统计学意义。高血压、血脂异常、吸烟和NIHSS评分在两组间无显著差异(表1)。
2.2 糖尿病与非糖尿病患者颈动脉斑块MRI特征比较 与非糖尿病患者相比,糖尿病患者症状侧颈动脉具有更大的斑块负荷包括管腔狭窄率、最大管壁厚度以及管壁体积百分比。同时,糖尿病患者症状侧颈动脉斑块的发生率,尤其是Ⅳ-Ⅵ型病变的发生率更高,存在更多、更大的LRNC病变(表1)。此外,在颅内大脑中动脉M1段>50%狭窄的病变比较中,两组差异无统计学意义(42.9%vs35.7%,P=0.475)。进一步多因素回归分析发现,2型糖尿病和吸烟是入组患者症状侧颈动脉富脂质核斑块发生的独立危险因素(OR3.35,95%CI1.33~8.43;OR4.80,95%CI2.15~10.71)(图1)。
2.3 糖尿病患者合并症状侧颈动脉富脂质核斑块与急性脑缺血病灶的关系 将91例存在症状侧坏死脂核的患者分为2型糖尿病组(n=53)及非糖尿病组(n=38)。糖尿病组患者年龄[(64.34±9.80)岁vs(61.76±9.94)岁,P=0.219]、BMI[(24.52±2.27)vs(24.76±2.43),P=0.635]、男性(79.2%vs71.1%,P=0.458)、高血压(86.8%vs71.1%,P=0.063)、血脂异常(30.2%vs50.0%,P=0.080)、吸烟(69.8%vs71.1%,P=0.898)和NIHSS评分[(4.62±3.94)vs(4.00±3.18),P=0.424]与非糖尿病组相比均无显著差异。2型糖尿病组具有更高的大穿支动脉梗死发生率(34.0%vs13.2%,P=0.024)、更低的小穿支动脉梗死发生率(13.2%vs31.6%,P=0.033)。其他的病灶形态发生率在两组间无显著差异(图2)。同时,糖尿病组患者的急性脑缺血病灶体积显著高于非糖尿病组[(15.37±8.87)mlvs(9.66±8.43)ml,P=0.014]。图3为两组患者合并症状侧颈动脉富脂质核斑块与相应供血区急性脑缺血病灶的病例图。
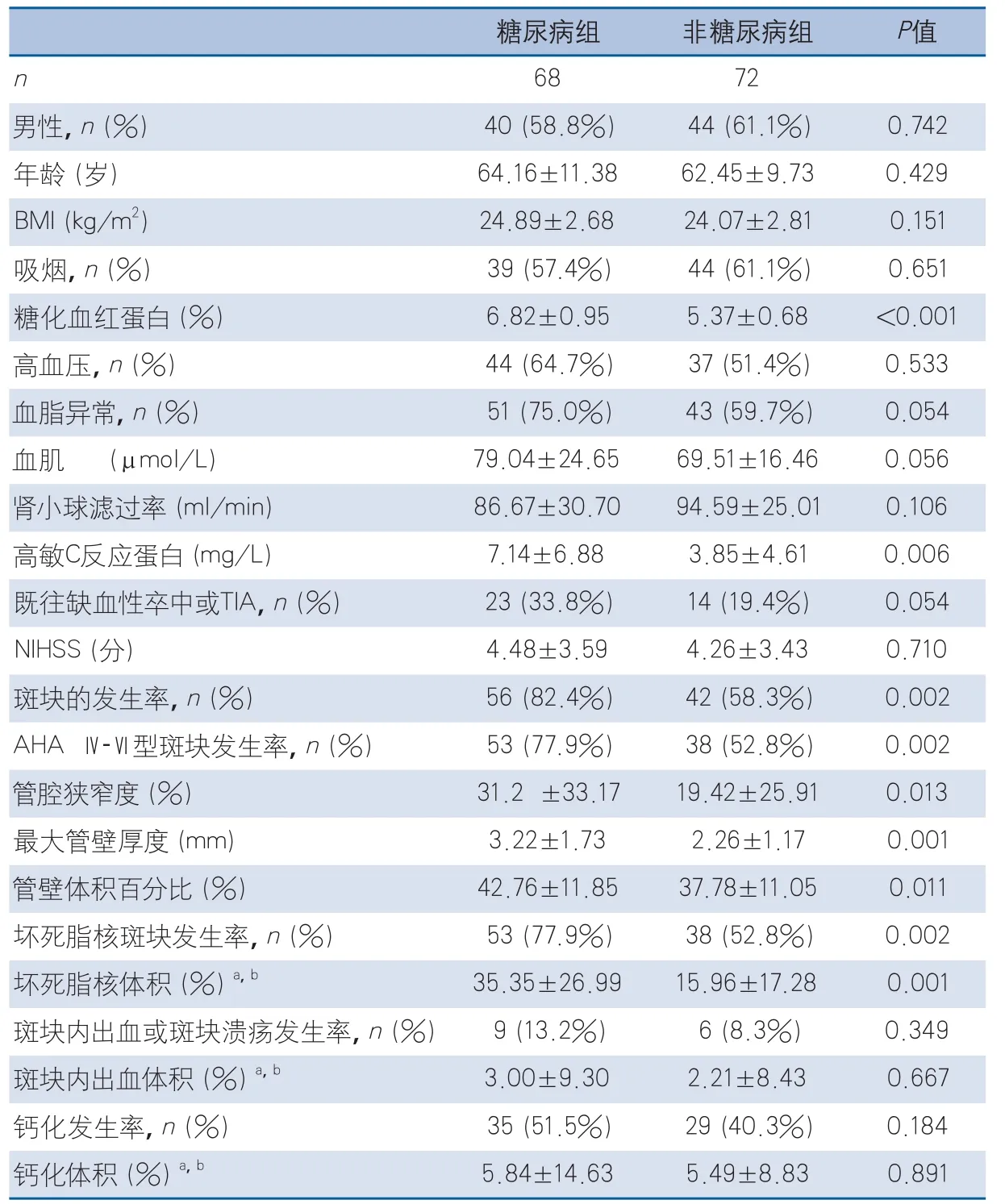
表1 糖尿病与非糖尿病患者的临床信息和影像学比较
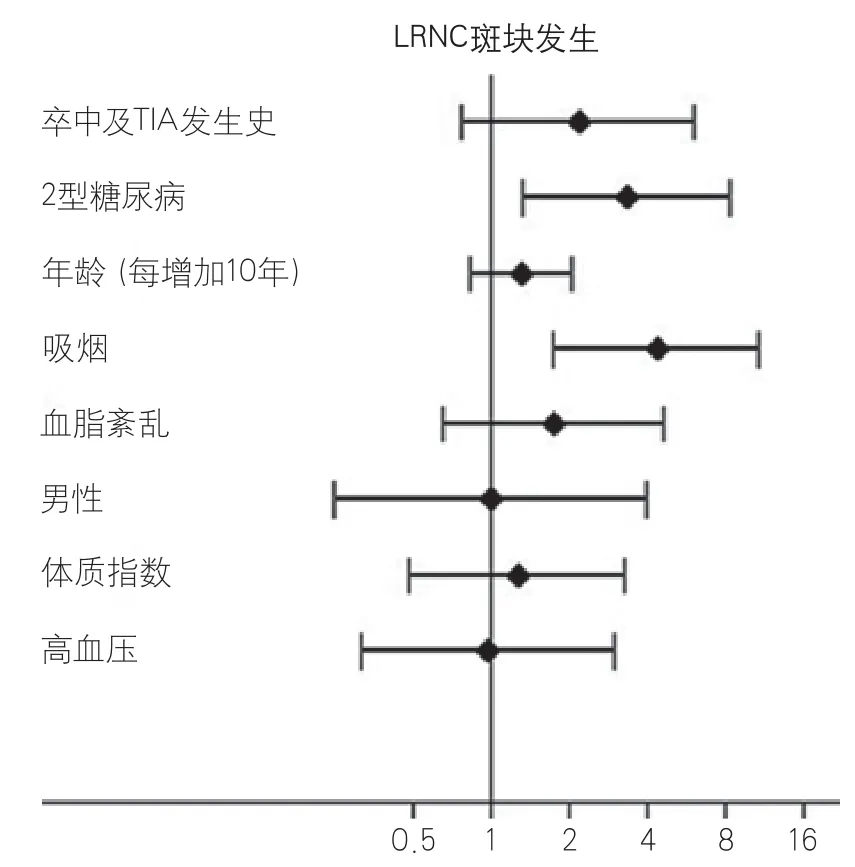
图1 症状侧颈动脉富脂质核斑块发生的临床危险因素分析(n=140)
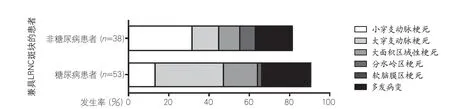
图2 有颈动脉富脂质核斑块的糖尿病和非糖尿病患者急性脑缺血病灶形态比较
3 讨论
本研究基于MR-VWI技术细致化分析斑块负荷和成分特征,以及同侧颈内动脉供血区DWI上急性脑缺血病灶的大小及形态,结果发现:与非糖尿病患者相比,糖尿病患者具有更高的颈动脉Ⅳ-Ⅵ型斑块发生率、更大的斑块负荷以及更大的富脂质核成分;在具有症状侧颈动脉LRNC斑块的患者中,糖尿病组颈内动脉供血区急性脑缺血病灶体积更大、大穿支动脉梗死的发生率更高。研究提示颈动脉斑块的成分分析,尤其是富脂质核特征可能有助于缺血性卒中风险判断。
本研究主要研究对象是急性颈内动脉供血区缺血性卒中患者,结果与L Esposito等[11]的研究结果一致,他们的研究显示在无脑梗死的中重度颈动脉狭窄患者中,糖尿病与颈动脉Ⅳ-Ⅵ型斑块病变独立相关。Núria Alonso等[12]研究发现,在无心血管疾病以及正常肾功能的2型糖尿病患者中,糖尿病性视网膜病变与颈动脉斑块负荷密切相关。此外,本研究发现糖尿病是症状性颈动脉富脂质核斑块发生的独立危险因素。尸检研究表明,糖尿病患者较糖代谢正常者在冠状动脉粥样硬化病变中具有更大的富脂质核[13-14]。基础实验也揭示,在糖尿病相关的动脉粥样硬化损伤中,高血糖症及其终产物可引起严重的炎症浸润及更大的富脂质核的发生[14]。Xiao Wei Huang等[15]及我们前期的研究[16]均发现,无论在超声还是MRI成像中,HbA1c与斑块成分特征存在一定的定量关系。上述研究结果支持了糖尿病会加重斑块的不稳定性的论点。而另外一些研究,如鹿特丹(Rotterdam)研究[17]和对伴低高密度脂蛋白/高甘油三酯的代谢综合征行动脉粥样硬化干预和对全球健康结局的影响(The Atherothrombosis Intervention in Metabolic Syndrome with Low HDL/High Triglycerides: Impact on Global Health Outcomes,AIM-HIGH)研究[18]发现糖尿病与斑块内LRNC的发生并无关系。这些看似矛盾的结论可能是由于研究的设计方案和队列分析方法存在差异,其中研究对象特征则可能是最主要的原因之一。Rotterdam研究的参与者主要是颈动脉管壁增厚的患者,AIM-HIGH研究的受试者中女性更多,代谢综合征患者且糖尿病患者较少,而本研究招募的患者均为急性缺血性卒中患者。此外,上述MRI研究中人群种族分布也存在显著差异。既往研究表明,颈动脉粥样硬化斑块成分及形态在不同种族群体如东西方人及不同代谢水平状态之间均有所不同[19-21]。
本研究多因素分析中发现近期吸烟史也是症状性颈动脉LRNC斑块发生的独立危险因素。米东华等[22]研究发现吸烟史与颈动脉易损斑块的对称性分布有相关性。吸烟一直被认为是动脉粥样硬化发生发展的促进因素,吸烟可以导致血小板活化、迁移至血管内皮下,促进血管内皮氧化应激反应以及C反应蛋白水平增高等。
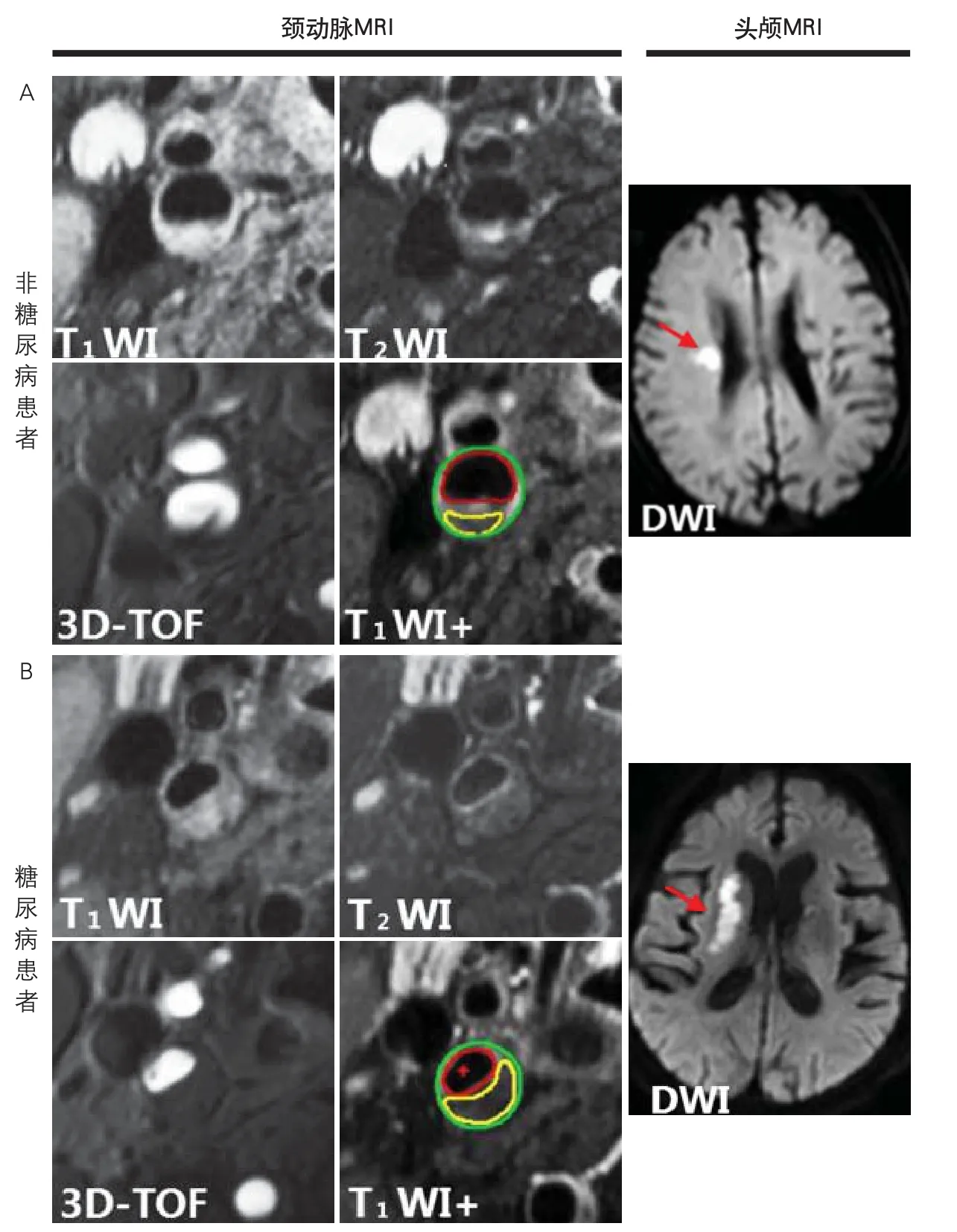
图3 糖尿病和非糖尿病患者颈动脉MR-VWI及头颅MRI图像
本研究发现在症状侧颈动脉存在LRNC斑块的人群中,糖尿病患者颈内动脉供血区大穿支动脉梗死发生率更高,且急性脑缺血病灶体积显著高于非糖尿病患者。既往研究[12,22-25]表明,糖尿病与缺血性卒中风险的增加或卒中后不良预后明确相关。糖尿病通过促进炎症浸润和脂质核扩张,导致斑块中大量的LRNC的发生,这与斑块破溃及后续小血栓形成密切相关[26]。虽然本研究临床初步排除了可疑心源性卒中患者、同时也进行了颈动脉和颅内动脉的MRI检查,但是本研究人群中卒中的病因仍尚难确定。在研究的症状侧颈动脉中,斑块内出血或纤维帽破裂的发生率较低(糖尿病患者中只有13.2%),且管腔狭窄度普遍较低,这表明本研究中大多数症状侧颈动脉斑块并非是责任斑块[27]。韩旭等发现在有症状的患者中普遍同时存在颅内和颅外颈动脉斑块,并且同时存在的斑块的数量与复发性卒中风险独立相关[28-29]。Jong-Won Chung等[20]对2702例亚裔急性缺血性卒中患者进行研究,发现低分子肝素治疗急性卒中试验(Trial of Org 10 172 in Acute Stroke Treatment,TOAST)分型中大动脉粥样硬化和小动脉闭塞是单个颈内动脉梗死形态中最常见的两种亚型(38.5%和22.8%),大动脉粥样硬化主要表现为分水岭梗死(89.9%)和颈内动脉梗死(51.5%)。Dae K等[30]发现,无论是单发的穿支动脉梗塞还是并发与边界区梗死,都是大脑中动脉疾病的特殊梗死类型。上述研究结果提示进一步完善颅内、外动脉管壁病变及脑血流动力学评价如灌注成像将有助于卒中病因学分析[31]。
本研究为回顾性研究,且病例样本的入选受限于较长的MRI扫描时间,一些症状较重的患者因无法耐受而未入选或检查后造成图像质量不佳而剔除,因此有待于前瞻性的队列研究证实糖尿病相关的颈动脉斑块内成分变化增加责任侧脑梗死风险的机制;其次,本研究对糖尿病的分层仅基于“是或否”的诊断模式,缺少具体的糖尿病年限以及近期血糖控制情况;第三,颈动脉MRI扫描范围局限在颈动脉分叉处,大范围的颅内、外动脉同时成像将有助于筛查脑供血动脉床的高危或责任斑块。
[1] IDRIS I,THOMSON G A,SHARMA J C. Diabetes mellitus and stroke[J]. Int J Clin Pract,2006,60(1):48-56.
[2] CAI J M,HATSUKAMI T S,FERGUSON M S,et al. Classi fi cation of human carotid atherosclerotic lesions with in vivo multicontrast magnetic resonance imaging[J]. Circulation,2002,106(11):1368-1373.
[3] PHINIKARIDOU A,HALLOCK K J,QIAO Y,et al. A robust rabbit model of human atherosclerosis and atherothrombosis[J]. J Lipid Res,2009,50(5):787-797.
[4] GRIMM JM,SCHINDLER A,FREILINGER T. Comparison of symptomatic and asymptomatic atherosclerotic carotid plaques using parallel imaging and 3 T black-blood in vivo CMR[J/OL]. J Cardiovasc Magn Reson,2013,15:44. https://jcmr-online.biomedcentral.com/articles/10.1186/1532-429X-15-44
[5] OBAYASHI K,SAEKI K,KURUMATANI N.Higher melatonin secretion is associated with lower leukocyte and platelet counts in the general elderly population:the HEIJO-KYO cohort[J]. J Pineal Res,2015,58(2):227-233.
[6] KEEVIL J G,CULLEN M W,GANGNON R,et al. Implications of cardiac risk and low-density lipoprotein cholesterol distributions in the United States for the diagnosis and treatment of dyslipidemia:data from National Health and Nutrition Examination Survey 1999 to 2002[J]. Circulation,2007,115(11):1363-1370.
[7] LIU X S,ZHAO H L,CAO Y,et al. Comparison of carotid atherosclerotic plaque characteristics by highresolution black-blood MR imaging between patients with fi rst-time and recurrent acute ischemic stroke[J].AJNR Am J Neuroradiol,2012,33(7):1257-1261.
[8] TATU L,MOULIN T,BOGOUSSLAVSKY J,et al. Arterial territories of the human brain:cerebral hemispheres[J]. Neurology,1998,50(6):1699-1708.
[9] MAN B L,FU Y P,CHAN Y Y,et al. Lesion patterns and stroke mechanisms in concurrent atherosclerosis of intracranial and extracranial vessels[J]. Stroke,2009,40(10):3211-3215.
[10] BARNETT H J M,TAYLOR D W,HAYNES R B,et al. Bene fi cial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. N Engl J Med,1991,325(7):445-453.
[11] ESPOSITO L,SAAM T,HEIDER P,ET al. MRI plaque imaging reveals high-risk carotid plaques especially in diabetic patients irrespective of the degree of stenosis[J/OL]. BMC Med Imaging,2010,10:27. https://doi.org/10.1186/1471-2342-10-27.
[12] ALONSO N,TRAVESET A,RUBINAT E,et al.Type 2 diabetes-associated carotid plaque burden is increased in patients with retinopathy compared to those without retinopathy[J/OL]. Cardiovasc Diabetol,2015,14:33. https://doi.org/10.1186/s12933-015-0196-1.
[13] MORENO P R,MURCIA A M,PALACIOS I F,et al. Coronary composition and macrophage in fi ltration in atherectomy specimens from patients with diabetes mellitus[J]. Circulation,2000,102(18):2180-2184.
[14] BURKE A P,KOLODGIE F D,ZIESKE A,et al. Morphologic fi ndings of coronary atherosclerotic plaques in diabetics:a postmortem study[J].Arterioscler Thromb Vasc Biol,2004,24(7):1266-1271.
[15] HUANG X W,ZHANG Y L,MENG L,et al. The relationship between HbA(1)c and ultrasound plaque textures in atherosclerotic patients[J/OL].Cardiovasc Diabetol,2016,15:98. https://doi.org/10.1186/s12933-016-0422-5.
[16] SUN B,ZHAO H,LIU X,et al. Elevated hemoglobin A1c Is Associated with Carotid Plaque Vulnerability:Novel Findings from Magnetic Resonance Imaging Study in Hypertensive Stroke Patients[J/OL]. Sci Rep,2016,6:33246. https://doi.org/10.1038/srep33246
[17] VAN DEN BOUWHUIJSEN Q J,VERNOOIJ M W,HOFMAN A,et al. Determinants of magnetic resonance imaging detected carotid plaque components:the Rotterdam Study[J]. Eur Heart J,2012,33(2):221-229.
[18] ZHAO X Q,HATSUKAMI T S,HIPPE D S,et al. Clinical factors associated with high-risk carotid plaque features as assessed by magnetic resonance imaging in patients with established vascular disease(from the AIM-HIGH Study)[J]. Am J Cardiol,2014,114(9):1412-1419.
[19] SAAM T,CAI J M,CAI Y Q,et al. Carotid plaque composition differs between ethno-racial groups:an MRI pilot study comparing mainland Chinese and American Caucasian patients[J]. Arterioscler Thromb Vasc Biol,2005,25(3):611-616.
[20] CHUNG J W,PARK S H,KIM N,et al. Trial of ORG 10172 in Acute Stroke Treatment(TOAST)classi fi cation and vascular territory of ischemic stroke lesions diagnosed by diffusion-weighted imaging[J/OL]. J Am Heart Assoc,2014,3(4).(pii):e001119.https://doi.org/10.1161/JAHA.114.001119.
[21] WASSERMAN B A,SHARRETT A R,LAI S,et al. Risk factor associations with the presence of a lipid core in carotid plaque of asymptomatic individuals using high-resolution MRI:the multi-ethnic study of atherosclerosis(MESA)[J]. Stroke,2008,39(2):329-335.
[22] 米东华,赵锡海,龚浠平. 影响颈动脉粥样硬化易损斑块对称性分布的危险因素分析[J]. 中国卒中杂志,2017,12(7):609-613.
[23] KUROSAKI Y,YOSHIDA K,FUKUDA H,et al. Asymptomatic Carotid T1-High-Intense Plaque as a Risk Factor for a Subsequent Cerebrovascular Ischemic Event[J]. Cerebrovasc Dis,2017,43(5-6):250-256.
[24] BAMBERG F,HETTERICH H,ROSPLESZCZ S,et al. Subclinical Disease Burden as Assessed by Whole-Body MRI in Subjects With Prediabetes,Subjects With Diabetes,and Normal Control Subjects From the General Population:The KORA-MRI Study[J]. Diabetes,2017,66(1):158-169.
[25] TZIOMALOS K,SPANOU M,BOUZIANA S D,et al. Type 2 diabetes is associated with a worse functional outcome of ischemic stroke[J]. World J Diabetes,2014,5(6):939-944.
[26] FALK E. Why do plaques rupture?[J]. Circulation,1992,86(6 Suppl):III30-42.
[27] MILOSEVIC D,PASTERNAK J,POPOVIC V,et al. The analysis of the connection between plaque morphology of asymptomatic carotid stenosis and ischemic brain lesions[J]. Vojnosanit Pregl,2013,70(11):993-998.
[28] 韩旭,赵锡海,刘丹青. 症状性颈动脉系统动脉硬化斑块颅内外分布的相关性研究[J]. 中华老年心脑血管病杂志,2014,16(2):181-184.
[29] XU Y,YUAN C,ZHOU Z,et al. Co-existing intracranial and extracranial carotid artery atherosclerotic plaques and recurrent stroke risk:a three-dimensional multicontrast cardiovascular magnetic resonance study[J]. J Cardiovasc Magn Reson,2016,18(1):90.
[30] LEE D K,KIM J S,KWON S U,et al. Lesion patterns and stroke mechanism in atherosclerotic middle cerebral artery disease:early diffusionweighted imaging study[J]. Stroke,2005,36(12):2583-2588.
[31] 中华神经科学会. 各类脑血管病诊断要点[J]. 中华神经科杂志,1996,29(6):379-380.

