盾叶冠心宁对冠心病患者同型半胱氨酸、血脂和内皮功能的影响
史威力 赵尊兰 赵英帅 李兵 王留义
血管内皮功能障碍(endothelial dysfunction,ED)是冠状动脉粥样硬化性心脏病发生的始动因素,贯穿于动脉粥样硬化发展的全过程。同型半胱氨酸(homocysteine,Hcy)是一种含硫氨基酸。1969年McCully首次发现血清Hcy水平升高可能与动脉粥样硬化的发生相关[1]。之后国内外学者围绕高同型半胱氨酸(high homocysteine,HHcy)与冠心病、周围血管疾病及脑血管疾病进行了大量的研究,证实HHcy是血管内皮功能障碍的一个危险因素,也是冠心病的一个独立危险因素[2]。目前,临床常用的降低Hcy的药物有叶酸、维生素B12和维生素B6等。HOPE-2研究表明,叶酸、维生素虽然可以降低血清同型半胱氨酸水平,但并不能降低心血管死亡、心肌梗死及卒中等复合终点事件的发生率。盾叶冠心宁片是一种中药制剂,有研究表明,盾叶冠心宁对治疗冠心病具有一定的临床价值,但其机制尚不完全明确。本研究以冠心病合并高同型半胱氨酸血症患者为研究对象,通过检测盾叶冠心宁治疗前后患者Hcy及反应性充血指数(reactive hyperemia index,RHI)的变化,探讨其机制是否与降低Hcy、改善血管内皮功能相关。
1 对象与方法
1.1 研究对象 选取自2016年1月至2017年1月就诊于郑州大学人民医院诊断为冠心病且合并同型半胱氨酸升高(血清Hcy水平≥15 μmol/L)的患者156例,男性75例,女性81例,平均年龄(58.1±11.6)岁,平均血清 Hcy水平(22.8±8.2)μmol/L。随机分为A、B两组,其中A组76例、B组80例。纳入标准:①男女不限,年龄在18~75岁;②符合2012 ACP/ACCF/AHA/AATS/PCNA/STS稳定型缺血性心脏病的诊断[3];③血清Hcy水平≥15 μmol/L;④患者具有良好的理解能力,能配合研究者进行本试验;⑤签署知情同意书。排除标准:⑴近6个月内经检查证实为急性冠脉综合征;⑵主动脉狭窄、肥厚型心肌病等其他导致心绞痛的疾病;⑶其他心脏疾病、重度神经官能症、更年期症候群、甲亢、胆心病、胃食管返流等所致胸痛者;⑷合并重度心肺功能不全;⑸合并肝、肾、造血系统等严重原发性疾病患者;⑹精神病患者;⑺已知对本品或本品任一成分过敏者;⑻在接受本品第一次治疗前28 d内接受过试验性药物治疗或者接受叶酸、维生素B12药物治疗的患者;⑼哺乳期或孕期女性;⑽生育期患者或无法避孕者;⑾服药依从性差者。
1.2 治疗方法 A组给予冠心病基础药物(抗血小板、他汀类药物)治疗,B组在冠心病基础药物治疗的同时增加常规剂量的盾叶冠心宁片(0.32 g,一日3次)。
1.3 监测指标
1.3.1 一般资料 所有患者入院后均收集其病史资料,包括性别、年龄、身高、体重、收缩压、舒张压。
1.3.2 生化指标 所有患者入院第2天抽取清晨空腹静脉血5 ml,在4℃条件下,以3000 r/min离心5 min,离心半径13.5 cm,留取血清,采用 VITROS 350干式化学分析仪(美国强生公司)检测甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸(UA)水平,试剂盒由美国强生公司生产。入院及治疗6个月后清晨空腹静脉采血,在我院检验科检测血清Hcy水平,其中Hcy在HITACHI 7600-020全自动生化分析仪上用循环酶法检测,血清Hcy水平≥15 μmol/L 为 HHcy。
1.3.3 血管内皮功能检测 入院及治疗6个月后采用外周动脉张力(peripheral arterial tension,PAT)仪器检测血管内皮功能。患者入院后72 h内用EndoPAT-2000无创血管内皮功能检测仪检测内皮功能。晨起空腹、停止应用血管活性药物12 h以上,嘱患者平卧于检查床上休息至少30 min,放松双手臂平放于身体两侧与心脏相同的高度,将充气袖带佩戴在非惯用侧上臂,再将两个生物传感器分别佩戴在双手食指上,注意避免触碰。打开Endo-PAT软件后,仪器自动通过管道为探针指套充气,使其压力均匀地包裹于食指指端,此时软件会记录下通过探针内传感器的指端动脉血管床血流信号,待指端血管床血流信号稳定后,开始血管内皮细胞功能测定。记录5 min指端血管床血流作为基线信号,然后快速充气袖带使压力维持>200 mm Hg(1 mm Hg=0.133 kPa)阻断肱动脉血流,使一侧指端血流信号消失,记录5 min,再快速将袖带放气使压力归零,指端血流信号恢复后再记录5 min,测试结束。利用仪器专用软件计算RHI,RHI≥1.67为正常,RHI越小,表示血管内皮功能障碍越重[4]。见图1。
1.4 统计学方法 全部数据结果采用SPSS 19.0统计软件进行分析。正态分布计量资料采用±s表示,组间比较采用两独立样本t检验,治疗前后比较采用配对资料t检验,组间比较采用χ2检验;单因素相关分析采用Pearson或者Spearman简单线性相关。P<0.05为差异具有统计学意义。
2 结果
2.1 两组一般资料比较 治疗前两组患者性别、年龄、身高、体重、体质指数、收缩压、舒张压、Hcy、TG、TC、HDL-C、LDL-C、UA、RHI水平比较,差异均无统计学意义(P>0.05),见表 1。
表1 治疗前两组患者一般资料比较(±s)
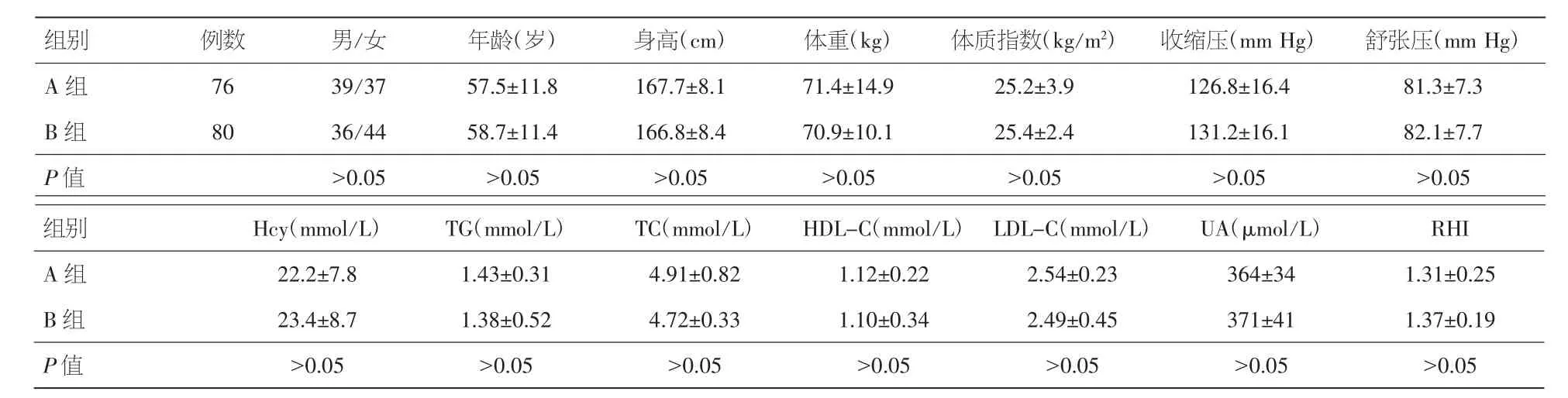
表1 治疗前两组患者一般资料比较(±s)
注:Hcy:同型半胱氨酸;TG:甘油三酯;TC:总胆固醇;HDL-C;高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇;UA:尿酸;RHI:反应性充血指数
组别 例数 男/女 年龄(岁) 身高(cm) 体重(kg) 体质指数(kg/m2) 收缩压(mm Hg) 舒张压(mm Hg)A 组 76 39/37 57.5±11.8 167.7±8.1 71.4±14.9 25.2±3.9 126.8±16.4 81.3±7.3 B 组 80 36/44 58.7±11.4 166.8±8.4 70.9±10.1 25.4±2.4 131.2±16.1 82.1±7.7 P值 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05组别 Hcy(mmol/L) TG(mmol/L) TC(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L) UA(μmol/L) RHI A 组 22.2±7.8 1.43±0.31 4.91±0.82 1.12±0.22 2.54±0.23 364±34 1.31±0.25 B 组 23.4±8.7 1.38±0.52 4.72±0.33 1.10±0.34 2.49±0.45 371±41 1.37±0.19 P值 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05 >0.05
2.2 两组患者治疗前后TG、TC、LDL-C、HDL-C比较 治疗期间,A组因头晕自动退出1例,B组因转氨酶升高自动退出2例。两组治疗6个月后,TG、TC、LDL-C较治疗前均明显下降,HDL-C较治疗前明显升高;B组各指标变化幅度均显著大于A组(P<0.05)。见表 2。
2.3 两组治疗前后Hcy及RHI比较 两组治疗6个月后A组血清Hcy水平无明显变化(P>0.05),B组血清Hcy水平较治疗前明显下降(P<0.05);两组治疗6个月后RHI较治疗前均显著增高,且B组增高幅度显著高于A组。见表3。
2.4 两组患者Hcy与RHI的相关性 绘制散点图,观察治疗前血清Hcy水平与RHI间有无直线相关性。结果提示,血清Hcy水平与RHI值间呈明显负相关关系(r=-0.567,P<0.01)。见图 2。
表2 两组患者治疗前后 TG、TC、LDL-C、HDL-C 比较(±s,mmol/L)
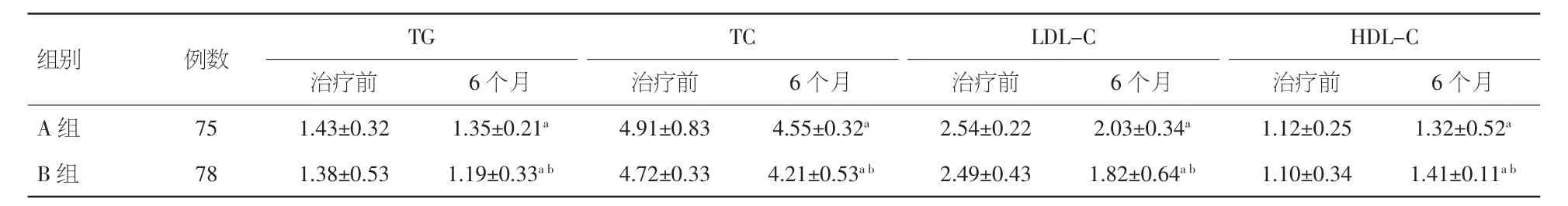
表2 两组患者治疗前后 TG、TC、LDL-C、HDL-C 比较(±s,mmol/L)
注:TG:甘油三酯;TC:总胆固醇;HDL-C;高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。与本组治疗前比较,aP<0.05;与A组比较,bP<0.05
组别 例数 TG TC LDL-C HDL-C治疗前 6个月 治疗前 6个月 治疗前 6个月 治疗前 6个月A 组 75 1.43±0.32 1.35±0.21a 4.91±0.83 4.55±0.32a 2.54±0.22 2.03±0.34a 1.12±0.25 1.32±0.52a B 组 78 1.38±0.53 1.19±0.33ab 4.72±0.33 4.21±0.53ab 2.49±0.43 1.82±0.64ab 1.10±0.34 1.41±0.11ab
表3 两组治疗前后Hcy及RHI的比较(±s)
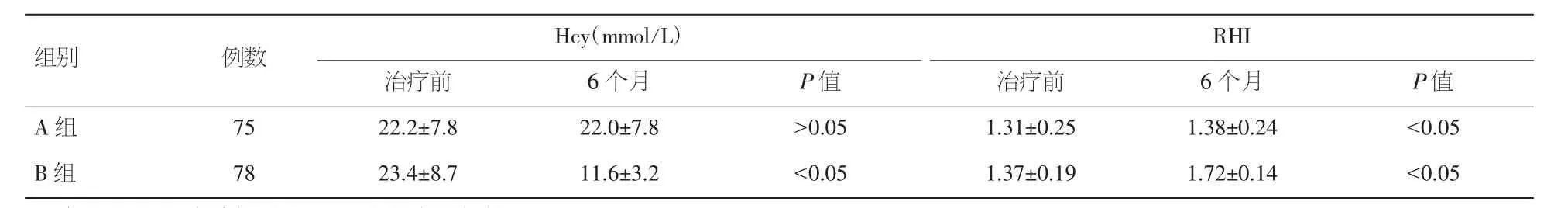
表3 两组治疗前后Hcy及RHI的比较(±s)
注:Hcy:同型半胱氨酸;RHI:反应性充血指数
组别 例数 Hcy(mmol/L)RHI治疗前 6个月 P值 治疗前 6个月 P值A 组 75 22.2±7.8 22.0±7.8 >0.05 1.31±0.25 1.38±0.24 <0.05 B 组 78 23.4±8.7 11.6±3.2 <0.05 1.37±0.19 1.72±0.14 <0.05
3 讨论
冠心病的病理基础是动脉粥样硬化。1976年,Ross提出动脉粥样硬化血管内皮损伤反应学说[5]。该学说认为,在严重的动脉粥样硬化血管结构损伤发病之前已有血管内皮功能障碍,随后才是相关的血管壁炎症及增生结构损伤改变。心血管疾病的多重危险因素都是通过损伤共同通路内皮细胞而启动或加速动脉粥样硬化的发生或发展。HHcy是冠心病的一个新的独立的危险因素[6]。目前HHcy致动脉粥样硬化的机制尚未完全明确,研究证实可能与下列几个方面有关:①Hcy损伤内皮细胞,可能通过产生的一系列活性氧簇中间产物抑制了一氧化氮的合成并促进其降解,从而导致血管细胞的损伤[7]。②促使平滑肌细胞增生,并且加速成骨细胞分化以及随后血管平滑肌细胞钙化,促使动脉粥样硬化斑块的形成[8-11]。③增强血小板的聚集功能和组织因子的活性,激活凝血酶因子Ⅴ和Ⅶ等,导致心血管系统的血栓形成[12]。④直接产生氧自由基诱导内皮细胞的损伤[13]。⑤加强低密度脂蛋白(LDL)的自身氧化,而氧化的低密度脂蛋白能影响一氧化氮的合成及凝血酶调节蛋白的活性。因此对冠心病合并高同型半胱氨酸血症患者进行临床干预是预防和治疗动脉粥样硬化性心血管疾病的重要环节。
血管内皮功能障碍是冠心病的始动环节。近年来,无创的血管内皮功能障碍检测指标成为评价冠心病发生发展及预后的研究热点,目前最常用的检测方法是血流介导的血管舒张功能的超声检测(flow-mediated dilation,FMD)[14]。但该方法不能规避因气温、心理、神经等因素导致的干扰性管径变化,且无法突破超声影像学手段测量范围窄、对术者水平依赖度高的瓶颈,导致检测可重复性及数据可靠度低。本次研究采用的Endo-PAT 2000无创血管内皮功能诊断系统是一套独创性容量描记生物传感系统,通过指尖动脉搏动容积变化检测血流量,以RHI反映血管内皮功能,RHI<1.67为内皮功能障碍,RHI越小,血管内皮功能障碍越严重[15]。Endo-PAT 2000对血管内皮功能的评价同样基于内皮细胞介导的血管舒张效应[16],与有创内皮功能检测相比,其对于血流变化极其敏感,准确可靠,灵敏度达80%,特异度达77%[17],并在2004年通过了美国食品药品监督管理局(FDA)认证,为唯一的无创血管内皮功能诊断系统[18]。
目前,降低Hcy的药物比较局限,中医药在HHcy的治疗中有独特的优势,为高同型半胱氨酸的防治提供了新的途径。盾叶冠心宁片的主要成分为盾叶薯蓣,是世界上薯蓣皂苷元含量最高的一种,被《中华人民共和国药典》所收载。盾叶薯蓣属于单子叶薯蓣科植物,主要成分是甾体皂苷元,具有抗血小板聚集、抗氧化应激、降低血胆固醇等作用,对心血管疾病具有很好的疗效。马利平等[19]将66例不稳定型心绞痛患者随机分为薯蓣皂苷治疗组和对照组,观察薯蓣皂苷对不稳定心绞痛患者血管内皮功能的影响,结果表明,薯蓣皂苷能够显著降低不稳定心绞痛患者血浆内皮素(ET)水平、升高血浆NO水平,从而改善和保护血管内皮功能,控制不稳定型心绞痛发作。苏健等[20]的动物研究显示,薯蓣皂苷可能通过减少ET的合成与分泌,提高eNOs的表达,使NO的合成与释放增加,从而对氧化低密度脂蛋白(OX-LDL)诱导血管内皮细胞凋亡起到保护作用。综上研究证实,薯蓣皂苷对血管内皮具有一定保护作用。
本次研究发现,两组治疗6个月时,TG、TC、LDL-C均低于治疗前,HDL-C均高于治疗前,B组的变化值高于A组;两组治疗6个月时两组尿酸水平无明显变化,说明盾叶冠心宁参与了冠心病患者血脂的调节,但是对患者尿酸代谢无显著影响。两组治疗6个月时,A组血清Hcy无明显变化,RHI升高,B组血清Hcy明显下降,RHI升高,并且B组RHI变化值幅度较A组高,说明盾叶冠心宁可以降低冠心病合并高同型半胱氨酸血症患者血清Hcy水平,并且可以改善患者血管内皮功能。本研究还发现,两组患者内皮功能的损害程度与Hcy升高呈明显负相关,表明内皮功能障碍可能是HHcy致动脉粥样硬化的机制之一,盾叶冠心宁对内皮细胞的保护作用可能和降低血清Hcy有一定关系。
本研究结果示,冠心病患者RHI值与血清Hcy呈明显负相关。盾叶冠心宁可以改善冠心病合并高同型半胱氨酸血症患者的血管内皮功能,其机制可能和降低血清Hcy及参与血脂代谢有关。
盾叶冠心宁对冠心病患者同型半胱氨酸、血脂和内皮功能的影响 P68
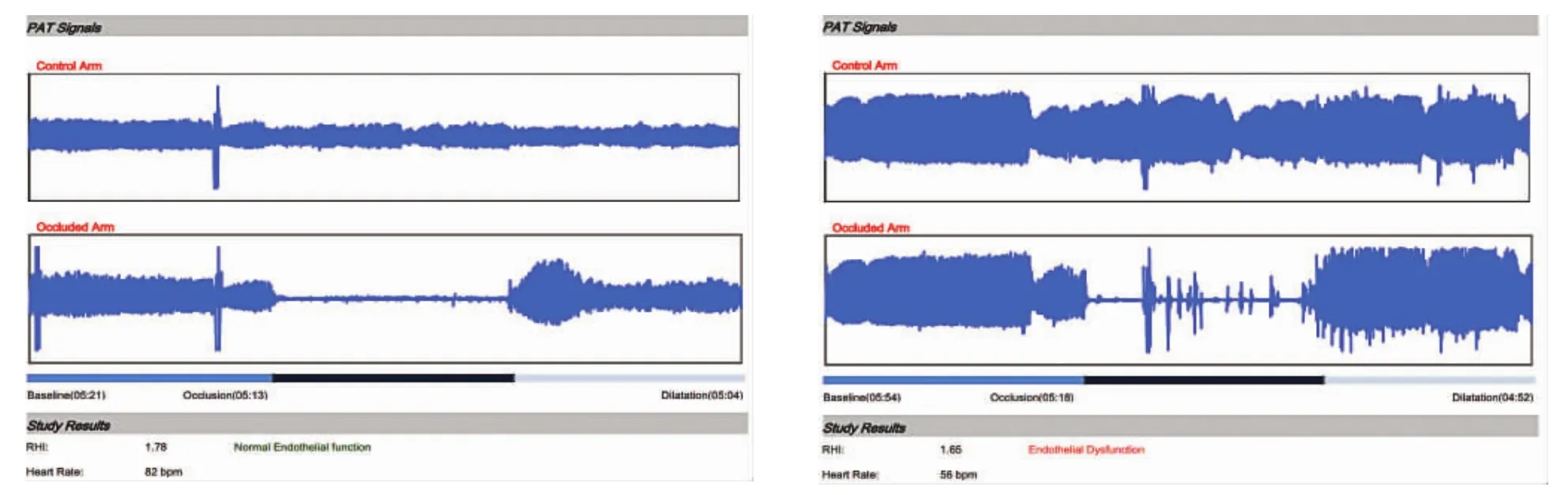
图1 PAT检测血管内皮功能(左图为内皮功能正常,右图为内皮功能障碍)
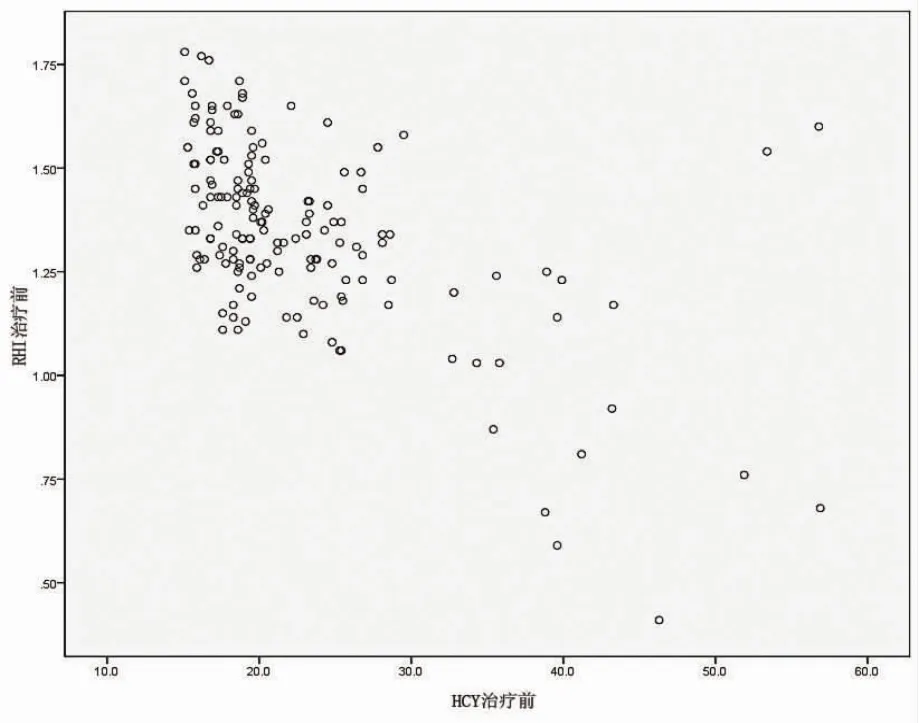
图2 RHI与Hcy的直线相关性
[1]McCully KS.Vascular pathology of homocysteinemia:implications for the pathogenesis of arteriosclerosis.Am J Pathol,1969,56:111-128.
[2]Esteghamati A,Hafezi-Nejad N,Zandieh A,et al.Homocysteine and metabolic syndrome:from clustering to additional utility in prediction of coronary heart disease.J Cardiol,2014,64:290-296.
[3]Qaseem A,Fihn SD,Williams S,et al.Diagnosis of stable ischemic heart disease:summary of a clinical practice guideline from the American College of Physicians/American College of Cardiology Foundation/American Heart Association/American Association for Thoracic Surgery/Preventive Cardiovascular Nurses Association/Society ofThoracic Surgeons.Ann Intern Med,2012,157:729-734.
[4]孙慧,吴永全,王永亮,等.外周动脉张力测定对急性心肌梗死预后的预测价值.中国动脉硬化杂志,2013,21:247-251.
[5]Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s.Nature,1993,362:801-809.
[6]Faria-Neto JR,Chagas AC,Bydlowski SP,et al.Hyperhomocystinemia in patients with coronary artery disease.Braz J Med Biol Res,2006,39:455-463.
[7]Biselli PM,Guerzoni AR,de Godoy MF,et al.Genetic polymorphismsinvolved in folatemetabolism and concentrationsof methylmalonic acid and folate on plasma homocysteine and risk of coronary artery disease.J Thromb Thrombolysis,2010,29:32-40.
[8]Joseph J,Washington A,Joseph L,et al.Hyperhomocysteinemia leads to adverse cardiac remodeling in hypertensive rats.Am J Physiol Heart Circ Physiol,2002,283:H2567-2574.
[9]Li J,Chai S,Tang C,et al.Homocysteine potentiates calcification ofcultured rataortic smooth muscle cells.Life Sci,2003,74:451-461.
[10]Joseph J,Joseph L,Shekhawat NS,et al.Hyperhomocysteinemia leads to pathological ventricular hypertrophy in normotensive rats.Am J Physiol Heart Circ Physiol,2003,285:H679-686.
[11]Devi S,Kennedy RH,Joseph L,et al.Effect of long-term hyperhomocysteinemia on myocardial structure and function in hypertensive rats.Cardiovasc Pathol,2006,15:75-82.
[12]Biswas A,Ranjan R,Meena A,et al.Homocystine levels,polymorphisms and the risk of ischemic stroke in young Asian Indians.J Stroke Cerebrovasc Dis,2009,18:103-110.
[13]Mansoor MA,Bergmark C,Svardal AM,et al.Redox status and protein binding of plasma homocysteine and other aminothiols in patients with early-onset peripheral vascular disease.Homocysteine and peripheralvasculardisease.Arterioscler Thromb Vasc Biol,1995,15:232-240.
[14]马志敏,王宏宇.超声检测动脉内皮功能.中国民康医学,2005,17:21-23.
[15]Schoenenberger AW,Urbanek N,Bergner M,et al.Associations of reactive hyperemia index and intravascular ultrasoundassessed coronary plaque morphology in patients with coronary artery disease.Am J Cardiol,2012,109:1711-1716.
[16]Javadov S,Rajapurohitam V,Kilic A,et al.Anti-hypertrophic effect of NHE-1 inhibition involves GSK-3beta-dependent attenuation of mitochondrial dysfunction.J Mol Cell Cardiol,2009,46:998-1007.
[17]Joseph J,Joseph L,Shekhawat NS,et al.Hyperhomocysteinemia leads to pathological ventricular hypertrophy in normoten-sive rats.Am J Physiol Heart Circ Physiol,2003,285:H679-686.
[18]Bonetti PO,Pumper GM,Higano ST,et al.Noninvasive identification of patients with early coronary atherosclerosis by assessment of digital reactive hyperemia.J Am Coll Cardiol,2004,44:2137-2141.
[19]马利平,汪凤兰,侯世瑞.薯蓣皂苷片对不稳定性心绞痛患者血管内皮功能的影响.山东中医杂志,2003,22:587-588.
[20]苏健,郭卫莉,李欣,等.薯蓣皂苷对氧化低密度脂蛋白诱导血管内皮细胞凋亡的保护作用.天津医科大学学报,2012,18:175-178.

