ABCG2在卵巢黏液性肿瘤中的表达及意义
张乾,王海欧,张虎祥,郑飞云
(温州医科大学附属第一医院,浙江 温州 325015,1.妇产科;2.病理科)
卵巢黏液性癌是常见的卵巢恶性肿瘤之一,预后差,容易复发,特别是晚期卵巢黏液性癌对一线化疗药物敏感性较差且易耐药,病死率高[1]。有研究表明,肿瘤组织中存在一小群特殊细胞即肿瘤干细胞(cancer stem cells,CSCs),具有自我分裂、更新和多向分化潜能,可能是肿瘤发生、发展、侵袭、转移及发生耐药的重要原因[2-3]。ABCG2(ATP-binding cassettesubfamily Gmember 2)是目前已知的常见CSCs表面标志物之一[4],参与多种肿瘤细胞的抗耐药性,但ABCG2在卵巢黏液性肿瘤中的相关情况鲜见报道。本研究检测卵巢黏液性肿瘤中ABCG2的表达情况,探讨其是否参与卵巢黏液性肿修复抗原20 min,3% H2O2阻断内源性过氧化酶,血清封闭后滴加抗ABCG2抗体(1∶50)4 ℃过夜,加二抗后37 ℃温箱孵育30 min,具体步骤按PV-9000两步法免疫组织化学检测试剂盒说明书进行,以PBS代替一抗做阴性对照,已知阳性结果做阳性对照,最后在显微镜下观察显色情况。
1.4 结果判断 由2位高年资病理医师用双盲法评估免疫组织化学染色体标本。ABCG2均为跨膜蛋白,定位于细胞膜及细胞浆,判断标准为细胞膜、细胞浆出现棕黄色颗粒。400倍镜下随机观察5个视野,每个视野计数100个细胞中的阳性细胞数。阳性细胞<25%为阴性,26%~50%为+,51%~75%为++,>75%为+++。
1.5 统计学处理方法 运用SPSS20.0统计软件进行统计学分析。各组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 ABCG2在各组中的阳性表达 各组肿瘤的细胞膜及细胞浆呈棕黄色颗粒表示ABCG2阳性表达,见图1。ABCG2在MOC、M-BOT、MOA的阳性表达率分别为18.2%、47.4%、80.0%,各组间两两比较,差异均有统计学意义(P<0.05),见表1。瘤的发生发展及可能的临床应用价值。
1 资料和方法
1.1 标本及临床资料 选取2011年1月-2015年12月在温州医科大学附属第一医院及温州医科大学附属第二医院住院手术的卵巢黏液性肿瘤患者术后石蜡标本66例,所有病例均排除合并其他系统恶性肿瘤及恶性肿瘤病史,患者年龄19~68岁,术前均未经化疗及其他治疗。所有标本均经2位高年资病理科医师阅片确定。根据WHO分类标准,其中卵巢黏液性囊腺瘤(mucinous ovarian cystad-enoma,MOC)22例,年龄23~49岁;卵巢交界性黏液性肿瘤(mucinous borderline ovarian tumor,M-BOT)19例,年龄19~48岁;卵巢黏液性囊腺癌(mucinous ovarian adenocarcinoma,MOA)25例,年龄23~68岁,年龄≥50岁16例,<50岁9例,中低分化14例,高分化11例,I~II期16例,III~IV期9例。
1.2 试剂 鼠抗人ABCG2(BXP-21)单克隆抗体购自英国Abcam公司;PV-9000两步法免疫组织化学检测试剂盒、DAB显色试剂盒、PBS、10 mmol/L枸橼酸盐缓冲液(pH 6.0)、防脱载玻片均购自北京中杉金桥生物技术公司。
1.3 方法 将所有石蜡标本连续切片,厚4 μm,脱蜡水化,置于10 mmol/L枸橼酸盐缓冲液中,微波
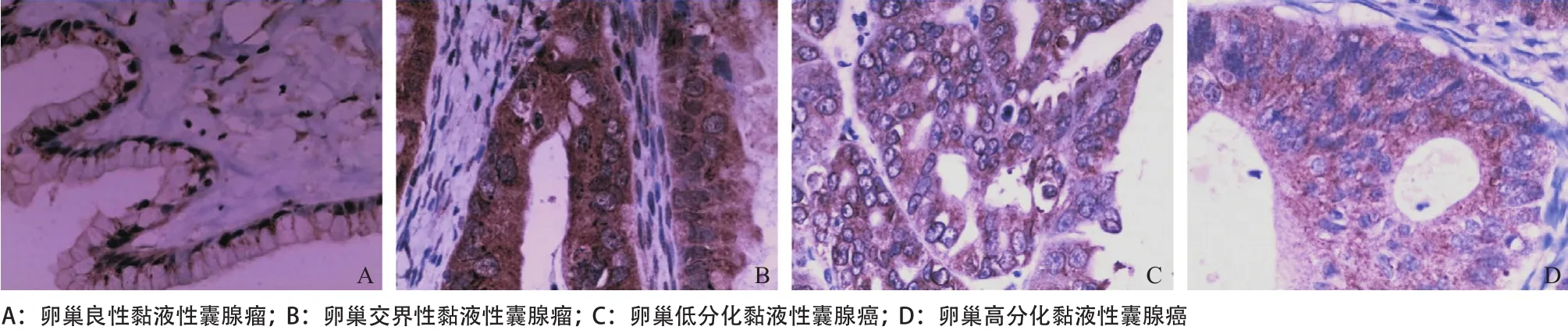
图1 ABCG2在肿瘤组织中的表达(PV-9000两步法,×400)
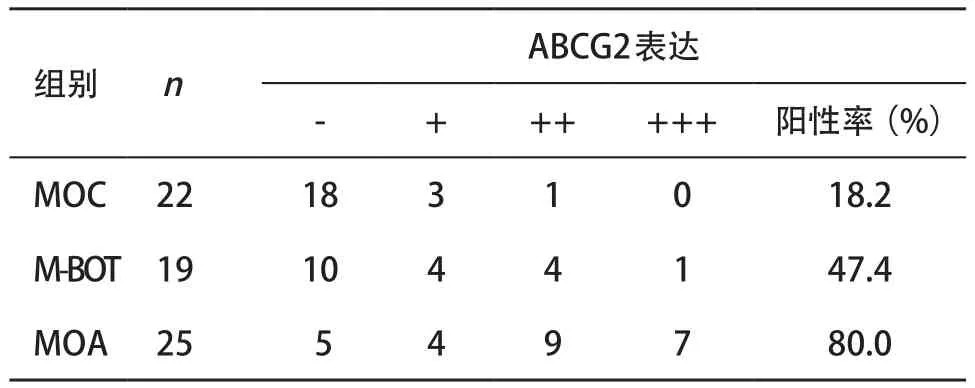
表1 ABCG2在各组肿瘤组织中的表达情况
2.2 ABCG2表达与MOA临床病理特征的关系 在MOA中,ABCG2的阳性表达水平在不同的病理分级、临床分期之间差异有统计学意义(P<0.05),在不同年龄之间差异无统计学意义(P>0.05),见表2。
3 讨论
研究表明,卵巢黏液性肿瘤从良性到交界性再到恶性是一个连续变化的过程。多数MOA术后需要辅助化疗,但较多研究表明MOA对一线化疗药铂类等耐药。PISANO等[5]回顾性分析MOA对化疗药物的敏感性,结果显示MOA容易对一线化疗药物铂类耐药。SHIMADA等[6]在回顾性研究中发现,MOA的预后显著差于浆液性癌,3年生存率分别为27.8%和61.5%,二者对化疗药物的敏感性分别为12.5%及67.7%,MOA对铂类的反应性明显低于浆液性癌。因此,探讨耐药性MOA产生耐药的机制是未来研究的热点。卵巢癌耐药细胞的过度增殖能力与CSCs相似,有学者提出CSCs的存在是卵巢癌复发及对化疗药物耐药的原因之一[7]。有研究表明,化疗药物能够杀死绝大多数的肿瘤细胞,但是却不能杀死占极少数的CSCs,残留的CSCs通过自我更新及多向分化潜能,在卵巢癌的复发及耐药中起关键作用[8-9]。
ABCG2是ABC转运体超家族成员之一,主要定位于细胞膜上,是耐药相关的半转运蛋白,依靠ATP提供能量,将化疗药物泵出体外,使肿瘤耐药[10]。近年来ABCG2作为肿瘤干细胞表面标志物受到广泛关注。文献报道,在前列腺癌[11]、胰腺癌[12]等肿瘤中能分离培养出ABCG2表达阳性的CSCs。近年来研究表明肿瘤中ABCG2的表达与临床预后相关,HANG等[13]研究发现,ABCG2可作为食管鳞状细胞癌预测预后的独立指标;LEE等[14]研究发现ABCG2高表达在胰腺癌中可作为早复发和预后差的独立预测指标。本研究结果显示,MOA组中ABCG2表达阳性率显著高于M-BOT及MOC组,M-BOT组中ABCG2表达阳性率显著高于MOC组,提示ABCG2在卵巢黏液性肿瘤良性、交界性及恶性转化中可能起着一定作用,随着MOA组织分化程度降低,ABCG2阳性表达率也随之增高,其蛋白检测可能用于卵巢黏液性肿瘤恶性程度的判断。根据FIGO分期,III~IV期中ABCG2阳性表达率比I~II期高,提示ABCG2可能参与MOA疾病的进展。此外,研究针对ABCG2的靶向治疗可能抑制肿瘤发展、减少肿瘤化疗耐受和提高患者生存率。SHEN等[15]研究发现,miR-142-3p通过下调CD133、Lgr5及ABCG2在结肠癌的表达从而抑制结肠癌的生长;联合应用ABCG2的抑制剂和化疗药物,可能提高肿瘤对化疗药物的敏感性。因此,针对ABCG2阳性细胞的靶点治疗有望成为卵巢癌治疗的新方向。
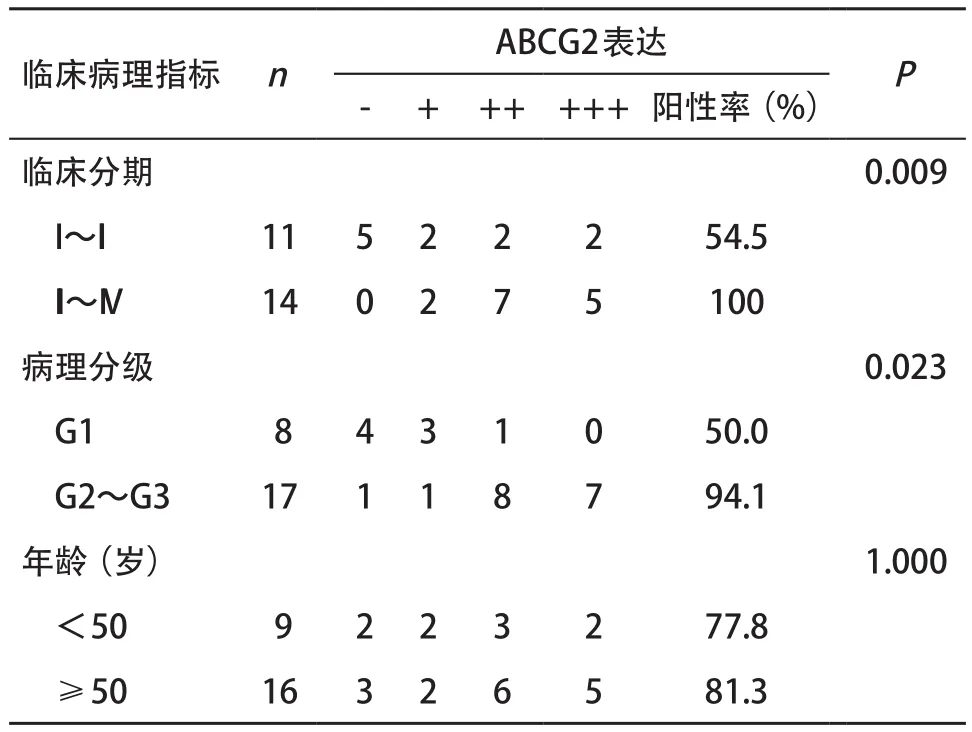
表2 ABCG2的表达与MOA临床病理特征的关系

