持续泵注盐酸右美托咪定对腹腔镜下结、直肠癌根治术患者围手术期动态肺顺应性和外周血中Toll样受体2和4表达的影响*
杨悦,马铃,代玉婷,杨曦仑,陈方园
(中国医科大学附属盛京医院 麻醉科,辽宁 沈阳 110001)
结、直肠癌患者围手术期免疫功能的变化可影响预后,研究调控围手术期患者免疫功能的方法有重要的临床价值。术前焦虑、手术创伤、输入异体血、低温、疼痛以及麻醉药物等因素均能引起明显的免疫抑制。腹腔镜手术具有微创、术后恢复快和出血少等优势,可减少围手术期创伤和并发症[1]。但任何一种手术,对于机体均是一种创伤应激,术中各项操作所造成的创伤除了会引起血流动力学波动外,还会引起不同程度的机体和腹腔的炎症反应以及免疫抑制,从而影响患者的预后[2]。围手术期许多麻醉药物均具有较大的免疫调节作用,盐酸右美托咪定作为一类新型的α2肾上腺素能受体选择性激动剂,具有镇痛、镇静、抑制应激反应等作用,国内研究显示[3],术中应用右美托咪定能够有效地降低手术创伤对其免疫功能的抑制,促进患者免疫功能的恢复。还有研究显示[4-5]盐酸右美托咪定可有效抑制单肺通气患者围手术期的炎症反应,减轻其肺缺血-再灌注损伤。而Toll样受体(toll-like receptors,TLR)2和4是作为TLRs家族中重要的成员,通过启动细胞内信号通路,激活核因子κB(nuclear factor kappa B,NF-κB),来诱发炎症反应[6]。本研究拟探讨持续泵注0.4μg/(kg·h)盐酸右美托咪定对腹腔镜下行结、直肠癌根治术患者围手术期动态肺顺应性(dynamic compliance,Cdyn)和外周血中TLR-2和TLR-4表达的影响。
1 资料与方法
1.1 一般资料
选择2015年7月-2016年6月在中国医科大学附属盛京医院择期行腹腔镜下结直肠癌根治术患者20例,用随机数字表法,将其分为两组:对照组(C组10例)和盐酸右美托咪定组(D组10例)。C组腹腔镜下右半结肠癌根治术3例,腹腔镜下乙状结肠癌根治术3例,腹腔镜下直肠癌根治术(Dixon)4例;D组腹腔镜下右半结肠癌根治术4例,腹腔镜下乙状结肠癌根治术1例,腹腔镜下直肠癌根治术(Dixon)5例。手术时间2~5 h,年龄33~68岁,ASAⅠ、Ⅱ级,体重指数(BMI)<30 kg/m2。排除标准:①肝肾功能异常者;②伴有高血压、糖尿病者;③伴有严重心脏病者;④应用肾上腺素受体激动剂者;⑤使用肾上腺皮质激素者。本研究经中国医科大学附属盛京医院伦理委员会审批,免知情同意。
1.2 麻醉方法
患者术前禁食8 h、禁饮4 h,不给任何术前药物,患者入室后开放静脉通路,输注乳酸钠林格氏液10~15 ml/(kg·h)。在患者前额正中、眉弓上方及眼角外侧粘贴专用BIS传感电极,常规监测平均动脉压(MAP)、心率(HR)、血氧饱合度(SpO2)、呼气末二氧化碳分压(PETCO2)和七氟醚呼气末浓度(ETsevo)。两组患者均采用常规静吸复合麻醉。麻醉诱导:枸橼酸舒芬太尼注射液0.3~0.5 mg/(kg·h);依托咪酯0.2 mg/kg;顺式阿曲库铵0.2 mg/kg;麻醉维持:连接Primus麻醉机(Draeger公司,德国) 控制呼吸,每组呼吸参数设置为VT 6~8 ml/kg,维持PetCO2在30~45 mmHg,R12次/分。七氟醚(sev,1.5%)+瑞捷(注射用盐酸瑞芬太尼remif,用生理盐水溶成 20 ml∶ 1 mg)0.5 ~ 1.0 mg/(kg·min),术中控制BIS值在40~60之间,呼气末吸入麻醉药浓度稳定在1.0~1.3MAC。根据手术需要间断追加顺式阿曲库铵和舒芬太尼,D组于手术开始时泵注盐酸右美托咪定0.4μg/(kg·h);C组于同一时段泵注等量的生理盐水,于手术结束前30 m in停止泵注盐酸右美托咪定或生理盐水,并静脉给予盐酸雷莫司琼0.3 mg和 酮咯酸氨丁三醇30 mg。若术中血压高于基础值30%或高于180/110 mmHg,即给予盐酸尼卡地平注射液0.5~1.0 mg静注,BP降低超过基础值的20%或SBP<80 mmHg给予麻黄碱5~10 mg静注,HR<50次/分给予阿托品0.3~0.5 mg静注。术中补液按照421法则进行补液,给予晶体为乳酸钠林格氏液,胶体为羟乙基淀粉(万汶),尿量维持1~2 ml/(kg·h)。手术结束时两组均停止吸入七氟醚,并将氧浓度调至100%,流量为8 L/min。术毕患者清醒后拔出气管导管,送麻醉恢复室(PACU)。
1.3 观察指标
①患者年龄、性别、身高、体重、ASA分级等一般情况;计算BMI,BMI=体重(kg)/身高2(m2)。②记录时间点:T0,入室后麻醉诱导前;T1,插管后5 min;T2,手术开始后30 min;T3,手术开始后60 min;T4,手术开始 后90 min;T5,手术结束前30 min;T6,拔管时 ;T7,拔管后 3 min;T8,术后1 d。③ 记录手术时间、麻醉时间、二氧化碳CO2气腹时间,记录睁眼、拔管距离手术结束的时间及不良事件的发生情况(如拔管后需再次插管)。④记录T0、T2、T4、T6、T7时点的MAP、HR。⑤记录 T1~ T6时点的气道压(Paw),肺顺应性(Cdyn)。⑥记录舒芬太尼、瑞芬太尼、顺式阿曲库铵以及盐酸右美托咪啶的用量。⑦T0、T4、T7、T8时点抽取静脉血,应用双抗体夹心酶联免疫法(ELISA)检测患者外周血中TLR-2、TLR-4及TNF-α浓度。见附图。
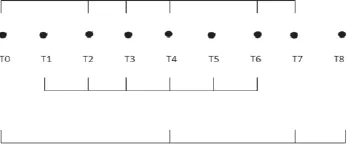
附图 围术期观察指标及测量指标时点示意图
1.4 检测方法
1.4.1 标本收集20 例患者在 T0、T4、T7、T8时点采集外周静脉血3 ml,经3 000 r/min,离心20 min后留取上清液,收集上清液于EP管内,-20℃冰箱保存,待集中测定,且避免反复冻融。
1.4.2 炎症因子的检测TNF-α检测采用双抗体夹心ELISA法,试剂盒由eBioscience公司提供,TLR-2、TLR-4采用RayBiotech公司生产的试剂盒进行ELISA法检测。用MULTISKANMK3型自动酶标仪比色分析获取样本的吸光率OD值,根据标准曲线,将测试样本的OD值转化为浓度值(TLR-2、TLR-4:ng/ml;TNF-α:pg/ml) 操作过程严格按照试剂说明书进行。
1.5 统计学方法
采用SPSS 22.0统计软件进行数据分析。计量资料以均数±标准差(±s)表示,两组不同时间点的比较采用重复测量设计的方差分析,两两比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
两组患者性别构成比、年龄、BMI、术中入液量、出血量、尿量、手术时间、麻醉时间、睁眼时间及拔管时间比较差异无统计学意义(P>0.05)(见表1);与C组比较,D组瑞芬太尼用量减少(P<0.05)(见表2)。
2.2 血流动力学比较
C组与D组之 间MAP的比较差异无统计学意义(F=1.659,P=0.214);每组内不同时间点的比较差异无统计学意义(F=1.235,P=0.299);组间与时间变化趋势的比较差异无统计学意义(F=2.020,P=0.172)。C组与D组之间HR的比较差异有统计学意义(F=5.958,P=0.025);每组内不同时间点的比较差异有统计学意义(F=3.830,P=0.017);组间与时间变化趋势的比较差异无统计学意义(F=1.212,P=0.285)。见表 3。
2.3 动态肺顺应性和气道压比较
C组与D组动态肺顺应性(Cdyn)之间的比较差异有统计学意义(F=6.913,P=0.017);每组内不同时间点的比较差异无统计学意义(F=1.489,P=0.230);组间与时间变化趋势的比较差异无统计学意义(F=0.908,P=0.353)。C组与D组之间气道压(Paw)的比较差异无统计学意义(F=0.047,P=0.832);每组内不同时间点的比较差异无统计学意义(F=0.329,P=0.768);组间与时间变化趋势的比较差异无统计学意义(F=0.657,P=0.428)。见表4。

表1 两组患者一般情况和术中情况各指标的比较 (n =10)
表2 两组患者舒芬太尼、瑞芬太尼、顺式阿曲库铵用药的比较 (±s)

表2 两组患者舒芬太尼、瑞芬太尼、顺式阿曲库铵用药的比较 (±s)
注:†与C组比较,P <0.05
组别 舒芬太尼用量/mg 瑞芬太尼用量/mg 右美托咪啶用量/μg 顺式阿曲库铵用量/mg C 组 27±5.87 0.72±0.255 - 23.2±5.3 D组 23.5±3.6 0.433±0.16† 68.2±21.6 20.7±5.9 F值 1.64 2.012 - 0.734 P值 0.119 0.007 - 0.33
表3 两组患者术中MAP及HR的比较 (n =10,±s)
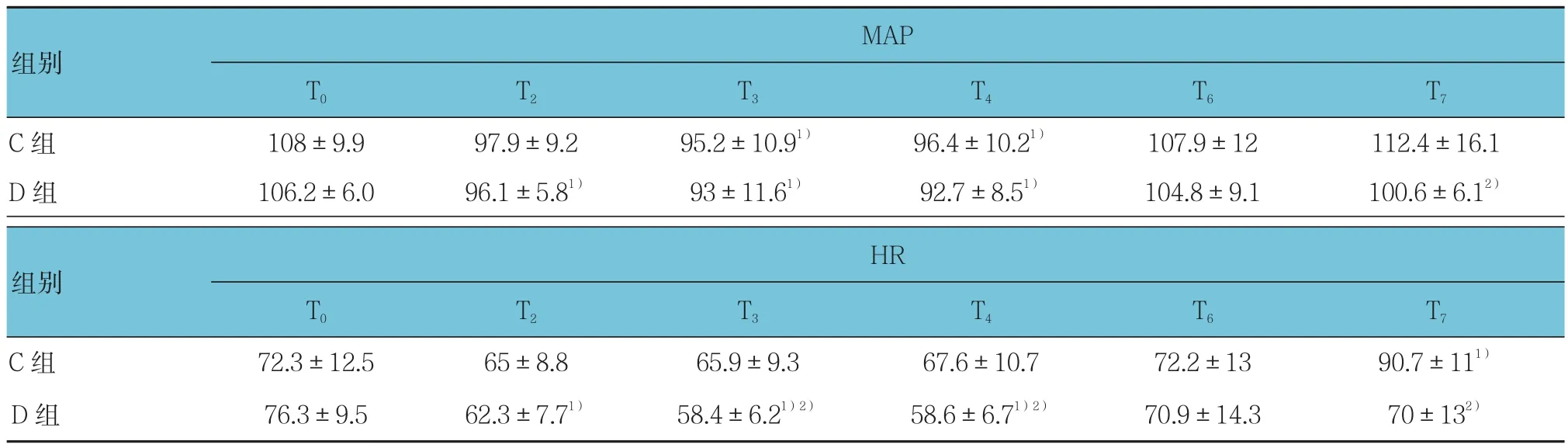
表3 两组患者术中MAP及HR的比较 (n =10,±s)
注:与本组T0比较,1)P <0.05;与C组同时点比较,2)P <0.05
MAP T0 T2 T3 T4 T6 T7 C组 108±9.9 97.9±9.2 95.2±10.91) 96.4±10.21) 107.9±12 112.4±16.1 D 组 106.2±6.0 96.1±5.81) 93±11.61) 92.7±8.51) 104.8±9.1 100.6±6.12)组别HR T0 T2 T3 T4 T6 T7 C 组 72.3±12.5 65±8.8 65.9±9.3 67.6±10.7 72.2±13 90.7±111)D 组 76.3±9.5 62.3±7.71) 58.4±6.21)2) 58.6±6.71)2) 70.9±14.3 70±132)组别
表4 两组患者术中Cdyn及Paw的比较 (n =10,±s)

表4 两组患者术中Cdyn及Paw的比较 (n =10,±s)
注:1)与本组T0比较,P <0.05;2)与C组同时点比较,P <0.05
组别Cdyn/(ml·cmH2O)T1 T2 T3 T4 T5 T6 C 组 47.0±10.0 26.3±7.1a 24.9±5.5a 26.4±9.3a 30.9±5.5a 33.3±11.7a D 组 46.3±9.1 27.7±4.1a 30.3±5.9ab 35.6±9.3ab 38.8±13.2 43.4±11.2 Paw/cmH2O T1 T2 T3 T4 T5 T6 C 组 11±2 20±3a 21±4a 21±4a 19±4a 17±3 D 组 12±3 19±5a 21±3a 21±3a 19±4a 15±3组别
2.4 TLR比较
C组与D组之间的比较差异有统计学意义(F=21.232,P=0.002);每组内不同时间点的比较差异无统计学意义(F=3.592,P=0.084);组间与时间变化趋势的比较差异无统计学意义(F=1.489,P=0.082)。见表 5。
2.5 TNF-ɑ比较
C组与D组之间TNF-ɑ的比较差异有统计学意义(F=26.272,P=0.001 );每组内不同时间点的比较差异无统计学意义(F=0.937,P=0.438);组间与时间变化趋势的比较差异无统计学意义(F=1.295,P=0.288)。见表 6。
表5 不同时点血清中TLR-2和TLR-4浓度的比较 (n =10,ng/ml,±s)
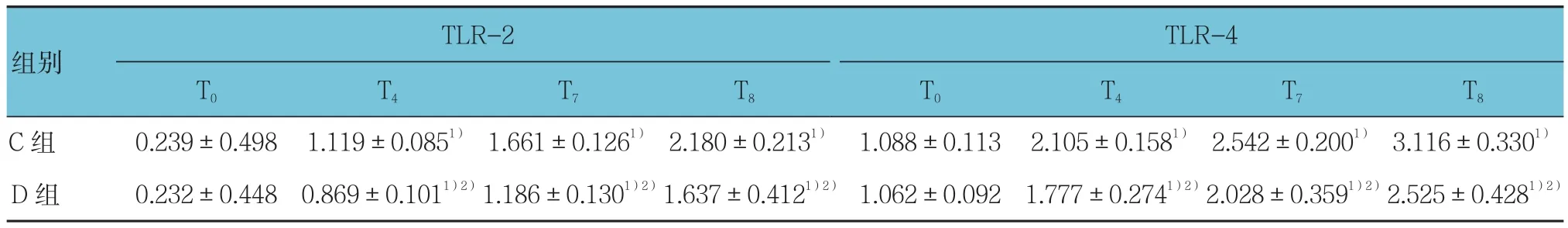
表5 不同时点血清中TLR-2和TLR-4浓度的比较 (n =10,ng/ml,±s)
注:1)与本组T0比较,P <0.05;2)与C组同时点比较,P <0.05
TLR-2组别TLR-4 T0 T4 T7 T8 T0 T4 T7 T8 C 组 0.239±0.498 1.119±0.0851) 1.661±0.1261) 2.180±0.2131) 1.088±0.113 2.105±0.1581) 2.542±0.2001) 3.116±0.3301)D 组 0.232±0.448 0.869±0.1011)2)1.186±0.1301)2)1.637±0.4121)2) 1.062±0.092 1.777±0.2741)2)2.028±0.3591)2)2.525±0.4281)2)
表6 两组患者围手术期血清TNF-α浓度的比较 (n =10,pg/ml,±s)
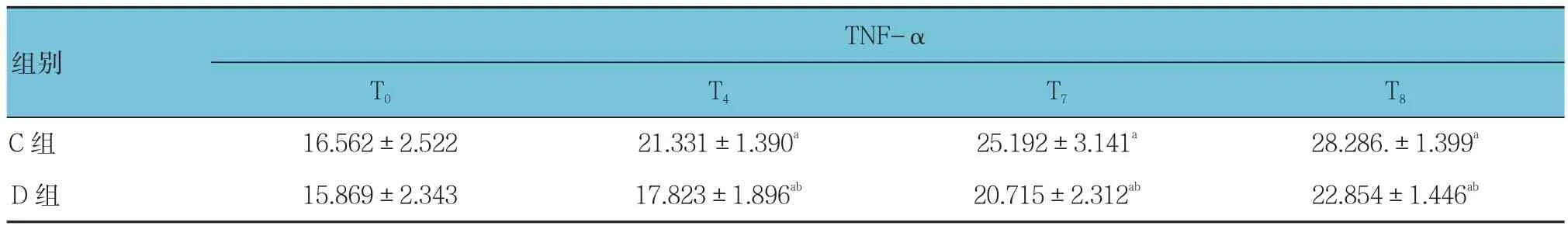
表6 两组患者围手术期血清TNF-α浓度的比较 (n =10,pg/ml,±s)
注:与本组T0比较,1)P <0.05;与C组同时点比较,2)P <0.05
组别TNF-α T0 T4 T7 T8 C 组 16.562±2.522 21.331±1.390a 25.192±3.141a 28.286.±1.399a D 组 15.869±2.343 17.823±1.896ab 20.715±2.312ab 22.854±1.446ab
3 讨论
右美托咪定是一种新型α2肾上腺素能受体激动剂,能够缓解手术创伤所造成的氧化应激,同时稳定术中生命体征、减少静脉麻醉药物和吸入麻醉药物的用量[7-8]。本研究中D组盐酸瑞芬太尼的用量低于C组。而两组睁眼时间、拔管时间差异无统计学意义。
腹腔镜手术中,CO2气腹的建立会激活交感神经,通过神经体液因素的改变造成生命体征以及血流动力学的改变。在本研究中,观察两组患者的血流动力学指标可知:C组拔管后3 min(T7)HR升高。而D组拔管后3 min(T7)MAP、HR均低于C组,提示腹腔镜手术中持续泵注0.4μg/(kg·h)右美托咪定能够减小围拔管期血流动力学的波动。国内外学者也有类似的文献报道[8-9]。
人工气腹的建立除了会引起血流动力学波动外,还会使肺的通气/血流比例失调。其机制可能是由于腹内高压引起的膈肌上移、使功能残气量减少、气道压力上升。动态肺顺应性(Cdyn)可较敏感地反映肺实质的病理改变。Cdyn愈小肺功能愈差。本研究结果表明,在CO2气腹后,气道压增加,Cdyn降低。而D组给予右美托咪定60和90 min后Cdyn显著升高,提示盐酸右美托咪定 可改善腹腔镜手术患者的肺顺应性。
郑勇萍[10]等发现全身麻醉维持期间泵注0.4μg/(kg·h)的右美托咪定可明显降低单肺通气引起的炎症因子IL-6浓度升高。也有研究显示[11]小剂量右美托咪定未能抑制单肺通气引发的炎症反应。根据右美托咪定的药代动力学显示,持续静脉泵注右美托咪定1 h后可达峰浓度,停止泵注后终末半衰期为2 h[12]。而注射右美托咪定的早期, 机体会出现短暂的两相心血管反应(即短暂的血压升高和反射性的心率减慢),最初的反应持续5~10 min,随后由于中枢交感神经的抑制,突触前α2受体被激动, 去甲肾上腺素的释放减少, 从而引起血压下降和心率减慢[13]。有研究显示[14],右美托咪定对循环系统的影响多发生于泵入负荷剂量之后,而缓慢给予或不给予负荷剂量能够避免起初的高血压和反射性的心动过缓[15]。所以本研究采用手术开始时,持续泵注0.4μg/(kg·h)的右美托咪定而不给于负荷剂量。
TLRs是天然免疫受体,与内源性和(或)外源性配体结合后,通过一系列信号转导途径激活NF-kB,诱导炎症因子的分泌[16],从而产生炎症反应,最终导致TNF-α、IL-6等炎症因子合成与释放[17]。动物实验表明[18-19],TLR-4是启动炎症反应的“门户”,肺炎球菌感染后TLR-2和TLR-4的mRNA表达水平增高[20]。有动物离体研究认为,右美托咪定的镇痛作用能减轻围手术期的应激反应,其机制可能是作用于TLR-4/NF-kB,通过抑制NF-kB的活性,下调TLR-4 mRNA的表达,从而抑制炎症介质释放减轻炎症反应[21-22]。本临床研究中,持续泵注0.4μg/(kg·h)的盐酸右美托咪定能降低腹腔镜下结、直肠癌根治术患者外周血中TLR-2和TLR-4的表达,从而抑制了中性粒细胞NF-kB的激活,最终使血清中TNF-α浓度降低,有助于减轻炎症反应。
在腹腔镜全身麻醉手术中辅助应用右美托咪定可抑制交感神经的活性和肾上腺素、去甲肾上腺素等儿茶酚胺的释放,可减轻CO2气腹造成的应激反应[23]、减少机体促炎因子TNF-α以及IL-6 等的合成与释放,促进抑炎因子IL-10等的生成[24-25],通过抑制机体炎症氧化应激反应,减轻肺缺血再灌注损伤,改善肺功能,从而发挥肺保护作用。本研究中,术中持续泵注0.4μg/(kg·h)的盐酸右美托咪定,外周血中TNF-α浓度降低、TLR-2和TLR-4的表达下调,手术60和90 min后Cdyn升高,因此,盐酸右美托咪定改善腹腔镜手术患者肺顺应性的机制可能为通过发挥盐酸右美托咪定的抗炎作用,改善动态肺顺应性,保护肺功能。
综上所述,腹腔镜结、直肠癌根治术中持续泵注0.4μg/(kg·h)盐酸右美托咪定有助于稳定围拔管期血流动力学,改善术中动态肺顺应性,缓解炎症性应激反应,且不影响苏醒和拔管时间。
[1]ESTEBAN F, CERDAN F J, GARCIA-ALONSO M, et al.A multicentre comparison of a fast track or conventional postoperative protocol following laparoscopic or open elective surgery for colorectal cancer surgery[J]. Colorectal Dis, 2014,16(2): 134-140.
[2]THOMASSEN I, VAN-GESTEL Y R, AALBERS A G, et al.Peritoneal carcinomatosis is less frequently diagnosed during laparoscopic surgery compared to open surgery in patients with colorectal cancer[J]. Eur J Surg Oncol, 2014, 40(5): 511-514.
[3]李晓光, 赵同航, 张宗旺. 术中应用右美托咪定影响结直肠癌患者T淋巴细胞亚群和NK细胞活性的双盲随机临床试验[J]. 中国现代手术学杂志, 2013, 17(10): 321-323.
[4]骆志忠, 肖源芬. 右美托咪定对肺癌根治术患者的肺保护作用[J]. 实用心脑肺血管病杂志, 2013, 21(4): 77-78.
[5]吕庆安. 右美托咪定对单肺通气患者术中氧化应激的影响[J].中国医师进修杂志, 2012, 35(17): 61-63.
[6]KELLUM J A, J0HNSON J P, KRAMER D, et al. Diff usive vs.convective therapy:eff ects on mediators of infl ammation in patient with severe systemic inflammatory response syndrome[J]. Crit Care Med, 1999, 26(12): 1995-2000.
[7]袁风雷, 刘岩, 胡春晖. 右美托咪啶对老年结肠癌根治术患者术后谵妄的影响[J]. 中国实验诊断学, 2014, 18(1): 135-137.
[8]TECHANIVATE A, DUSITKASEM S, ANUWATTANAVIT C. Dexmedetomidine compare with fentanyl for postoperative analgesia in outpatient gynecologiclaparoscopy: a randomized controlled trial[J]. J Med Assoc Thai, 2012, 95(3): 383-390.
[9]陈丽安, 陈骏萍. 右美托咪定符合乌拉地尔在鼻内镜手术控制性降压中的应用[J]. 现代实用医学, 2014, 26(6): 662-663.
[10]郑勇萍, 郭伟, 张宗泽, 等. 不同剂量的右美托咪定对全麻开胸手术患者苏醒期应激反应的影响[J]. 武汉大学学报, 2015,36(2): 312-316.
[11]张荣智, 石翊飒, 张亚敏. 不同剂量右美托咪啶对单肺通气患者围手术期炎性反应的影响[J]. 中华麻醉学杂志, 2011,31(12): 1443-1445.
[12]徐蓉蓉, 黄文起. 右美托咪定药代动力学和药效动力学的研究进展[J]. 广东医学, 2012, 33(4): 1037-1039.
[13]BHANA N, GOA K L, MCCLELLAN K J. Dexmedetomidine[J].Drugs, 2000, 59(2): 263-270.
[14]VENN R, NEWMAN P, GROUNDS R. A phase Ⅱ study to evaluate the efficacy of dexmedetomidine fo r sedation in the medical intencive care unit[J]. Intensive Care Med, 2003, 29(2):201-207.
[15] ICKERINGILL M, SHEHABI Y, ADAMSON H, et al.Dexmedetomidine infusion without loading dose in surgical patients requiring mechanical ventilation haemodynamic eff ects and effi cacy[J]. Anaesth Intensive Care, 2004, 32(6): 741-745.
[16]LAKHANI S A, BOGUE C W. Toll-like receptor signaling in sepsis[J]. Current Opinion in Pediatrics, 2003, 15(3): 278-282.
[17]李百强, 孙海晨. Toll样受体4与急性肺损伤关系的研究进展[J]. 中国急救医学, 2009, 29(8): 744-745.
[18]李克忠, 姚尚龙, 王志刚, 等. 不同潮气量机械通气对大鼠肺组织TLR 4表达的影响[J]. 中华麻醉学杂志, 2006, 26(10):888-890.
[19]张进祥, 王慧, 徐建波, 等. Toll样受体4在急性肺损伤中的作用[J]. 中华急诊医学杂志, 2006, 15(8): 692-695.
[20]XU F, DROEMANN D, RUPP J, et al. Modulation of the infl ammatory response to streptococcus pneumoniae in a model of acute lung tissue infection[J]. Am J Respir Cell Mol Biol,2008, 39(5): 522-529.
[21]葛亮, 冷玉芳, 高毅, 等. 右美托咪定对神经病理性痛大鼠脊髓Toll样受体4和NF-kB表达的影响[J]. 中华麻醉学杂志,2013, 3(6): 704-707.
[22]蔡明娇, 刘华跃, 钟丽敏, 等. 右美托咪定对脓毒症大鼠脑组织炎性反应的影响[J].中华麻醉学杂志, 2013, 33(6): 749-751.
[23]李煜, 张永福. 右美托咪定对腹腔镜手术围手术期血儿茶酚胺及血流动力学的影响[J].中国微创外科杂志, 2011, 11(2): 119-122.
[24]雷振营. 右美托咪定对LPS诱导急性肺损伤的保护作用[J].河南医学高等专科学校学报, 2016(28): 68-69.
[25]李宁涛, 吴晓静, 夏中元. 右美托咪定对大鼠胸部撞击性肺损伤血清肿瘤坏死因子α 和白细胞介素1β的影响[J]. 中华急诊医学杂志, 2011, 20(5): 485-488.

