过敏性鼻炎患者外周血嗜酸性粒细胞富集群中IL-18、IL-18BP和IL-18R的表达
崔夫波,柴文戍,张慧云,王君灵,胡雅琳,王 玲,何韶衡
1)锦州医科大学附属第一医院变态反应与临床免疫研究中心 辽宁锦州 121001 2)锦州医科大学附属第一医院呼吸内科 辽宁锦州 121001 3)苏州市相城人民医院中心实验室 江苏苏州 215100
据报道[1]中国大陆人口过敏性鼻炎(allergic rhinitis,AR)的患病率为4%~38%,全球患病率为10%~25%,且20%~30%的AR患者常伴哮喘。AR作为一种常见病、多发病,影响着患者的生活质量和人类健康[2]。AR发病机制复杂,人们曾提出Th1/Th2/Th17/Treg细胞模式学说[3],认为机体高表达Th2细胞因子,进而诱导IgE生成、增强气道嗜酸性粒细胞浸润和提高气道反应性等是AR的重要原因[4]。IL-18作为炎症因子可调节Th1/Th2平衡,广泛参与包括鼻炎、哮喘等过敏性疾病[5-7]。研究[6,8]表明,AR患者血清IL-18水平升高。IL-18结合蛋白(IL-18 binding protein,IL-18BP)作为IL-18的天然抑制剂,可通过中和IL-18而抑制IL-18与IL-18受体(IL-18R)结合[9-10],进而降低表达IL-18R的效应细胞(Th1、Th2和Th17等)的功能。有报道[4]称,AR患者用过敏原鼻腔激发4~6 h后,可出现以鼻塞为主并伴有鼻黏膜内嗜酸性粒细胞浸润和活化的迟发相反应,提示过敏原和嗜酸性粒细胞参与AR发病。本研究旨在用流式细胞仪检测AR患者外周血经过敏原刺激前后嗜酸性粒细胞富集群中IL-18、IL-18BP和IL-18R的表达情况,希望为以后IL-18、IL-18BP和IL-18R与嗜酸性粒细胞的相关研究提供方向。
1 材料与方法
1.1实验材料PE/Cy7-CD14抗体、PerCP-CD16抗体、死细胞去除染料、BV510-驴抗兔IgG、FcR阻断剂、红细胞裂解液、布雷非德菌素A(BFA)购自Biolegend公司(美国),PE-IL-18、APC-IL-18R购自R&D Systems公司(美国),兔抗人IL-18BP购自Abcam公司(英国),蒿草花粉提取液、尘螨提取液和梧桐花粉提取液购自北京新华联协和药业有限责任公司(中国),PBS购自Solarbio公司(美国),Cytofix/CytopermTM固定/透膜试剂盒购自BD Biosciences Pharmigen公司(美国),皮肤点刺试验过敏原购自ALK-ABELLO公司(丹麦),其他常用化学试剂均为分析纯。低温高速离心机(美国Thermo Scientific公司),水浴锅(中国精宏公司),FACSVerse流式细胞仪(美国BD Biosciences公司)。
1.2研究对象和样本采集募集AR急性发作期入院患者和体检健康者(正常对照组)为志愿者。30位志愿者的一般资料见表1。AR的诊断标准符合2015年美国耳鼻咽喉头颈外科学会专家组发布的过敏性鼻炎临床实践指南[11]。AR患者均处于急性发作期,且至少2周前停止服用治疗鼻炎的药物。所有志愿者至少一个月内未发生过呼吸道感染。本研究获得了锦州医科大学附属第一医院伦理委员会的批准,并与志愿者均签订了知情同意书。每位志愿者采集10 mL外周静脉血于含EDTA抗凝剂的采血管中待测。

表1 30例志愿者的一般资料
年龄、病史和发病年龄均为中位数(极小值~极大值)
1.3血液嗜酸性粒细胞富集群中IL-18、IL-18BP和IL-18R的表达全血分成4份,分别加入BFA、尘螨、蒿草花粉或梧桐花粉过敏原粗提液(质量浓度为1.0 mg/L),37 ℃水浴振荡孵育1 h;1 400 r/min离心后弃去上清,加入死细胞去除染料与FcR阻断剂,均匀混合后,避光孵育15 min,然后加入抗CD14、CD16和IL-18R抗体,避光孵育15 min后裂解红细胞,离心后用固定/透膜液固定细胞,然后加入抗IL-18和抗IL-18BP抗体孵育,透膜洗液清洗后加入BV510-驴抗兔IgG,最后上流式细胞仪检测嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞比例及平均荧光强度(MFI)。
1.4统计学处理用SPSS 13.0处理数据。采用k个相关样本的秩和检验分析过敏原刺激前后正常对照组或AR组以上指标的差异,采用秩和检验比较2组刺激前以上指标的差异,用秩相关系数分析AR组IL-18BP+细胞和IL-18+细胞MFI的关系,检验水准α=0.05。
2 结果
2.1 2组IL-18+、IL-18BP+和IL-18R+细胞比例及MFI的比较见表2、3。激发前,与正常对照组比较,AR患者嗜酸性粒细胞富集群中IL-18+细胞比例无变化,但IL-18BP+和IL-18R+细胞比例分别是正常对照组的1.879倍和1.698倍。梧桐花粉粗提液刺激后AR患者外周血IL-18+细胞比例升高约33%。正常对照组激发前后,外周血嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞比例和MFI差异均无统计学意义。
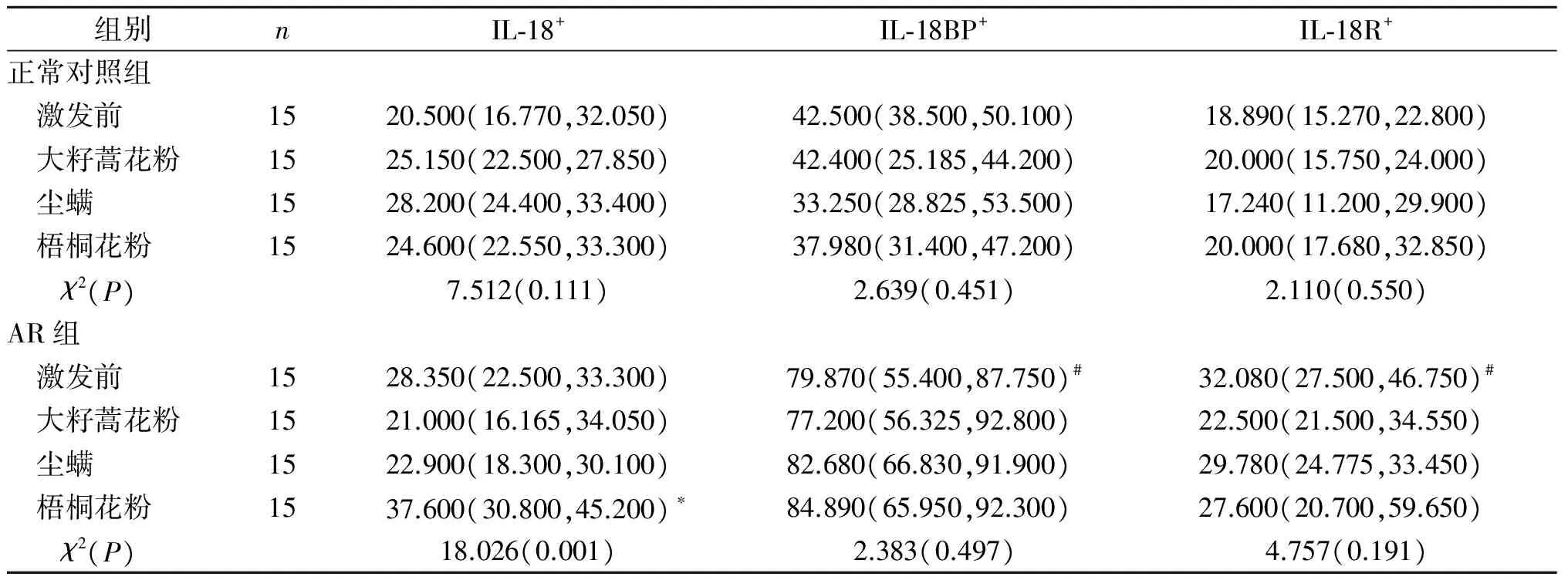
表2 2组嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞比例的比较 %
#: 与正常对照组激发前相比,P<0.05;*:与AR组激发前相比,P<0.05
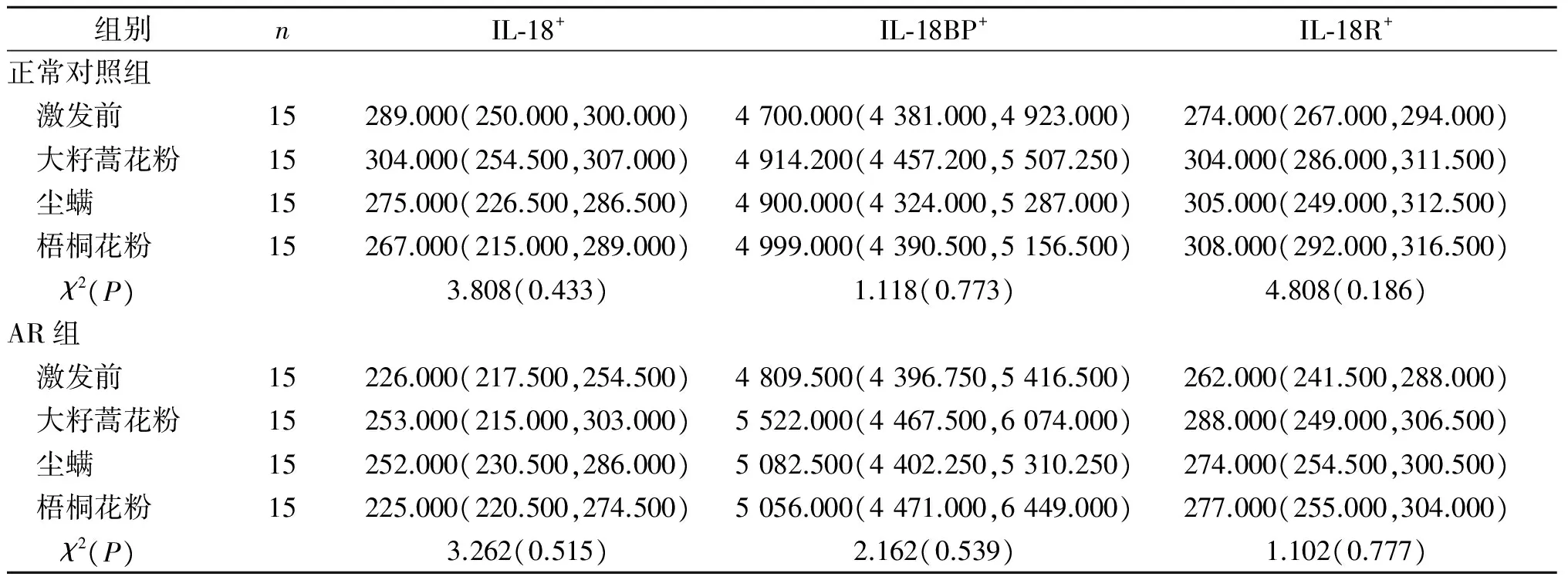
表3 2组嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞MFI的比较
2.2AR患者IL-18BP+细胞和IL-18+细胞MFI的关系AR患者嗜酸性粒细胞富集群中IL-18BP+细胞和IL-18+细胞MFI高度相关(rS=0.783,P<0.001)。
3 讨论
大量的研究[12-13]认为IL-18可协同IL-12抑制Th2细胞的增殖,减少Th2细胞释放炎症递质,从而抑制气道炎症。也有研究[5,8]表明IL-18可促进特异性IgE生成及诱导Th2细胞分泌Th2细胞因子(如IL-4、IL-5和IL-13等),且其血液水平随过敏性疾病炎症程度的加重有增高的趋势。本研究结果显示,AR患者外周血嗜酸性粒细胞富集群中IL-18+细胞比例与正常对照组相比差异无统计学意义,然而经梧桐花粉过敏原刺激后IL-18+细胞比例升高约33%,提示梧桐花粉过敏原可能诱导了嗜酸性粒细胞释放IL-18。
IL-18通过与细胞表面的IL-18R相互作用在机体防御及致病过程中发挥其生物学功能。哮喘儿童肺组织中嗜酸性粒细胞升高并伴有IL-18R表达增加[14]。之前的研究[7]发现OVA致敏鼠腹腔注射IL-18后可诱导小鼠腹腔灌注液中肥大细胞IL-18R表达上调。以上研究提示嗜酸性粒细胞、肥大细胞表面的IL-18R可能在过敏性疾病中起重要作用。本研究结果显示AR患者外周血嗜酸性粒细胞富集群中IL-18R的表达约为正常对照组的1.7倍,进一步提示嗜酸性粒细胞表面的IL-18R可能在AR中起重要作用。
IL-18可与IL-18BP结合而降低IL-18BP的生物学活性,目前人们对IL-18BP的抗炎作用进行了广泛研究[9-10,15-16]。我们的研究发现AR患者嗜酸性粒细胞富集群中IL-18BP+细胞约为正常对照组的1.8倍。有研究[10]显示,类风湿关节炎滑膜成纤维细胞中IL-18与IL-18BP的表达高度相关。本研究结果显示AR患者嗜酸性粒细胞群中IL-18BP+细胞MFI和IL-18+细胞MFI高度相关,提示IL-18BP可能通过正反馈机制中和IL-18进而抑制AR发病。
综上所述,嗜酸性粒细胞源的IL-18、IL-18BP和IL-18R可能在AR中起重要作用,IL-18、IL-18BP及IL-18R可能是治疗AR的潜在靶点。
[1] ZHANG Y,ZHANG L.Prevalence of allergic rhinitis in China[J].Allergy Asthma Immunol Res,2014,6(2):105
[2] BOUSQUET J,SCHÜNEMANN HJ,SAMOLINSKI B,et al.Allergic Rhinitis and its Impact on Asthma(ARIA): achievements in 10 years and future needs[J].J Allergy Clin Immunol,2012,130(5):1049
[3] MILNER JD.IL-17 producing cells in host defense and atopy[J].Curr Opin Immunol,2011,23(6):784
[4] ELIASHAR R,LEVI-SCHAFFER F.The role of the eosinophil in nasal diseases[J].Curr Opin Otolaryngol Head Neck Surg,2005,13(3):171
[5] KRUSE S,KUEHR J,MOSELER M,et al.Polymorphisms in the IL 18 gene are associated with specific sensitization to common allergens and allergic rhinitis[J].J Allergy Clin Immunol,2003,111(1):117
[6] SANDERS NL,MISHRA A.Role of interleukin-18 in the pathophysiology of allergic diseases[J].Cytokine Growth Factor Rev,2016,32:31
[7] WANG J,ZHANG H,ZHENG W,et al.Correlation of IL-18 with tryptase in atopic asthma and induction of mast cell accumulation by IL-18[J].Mediators Inflamm,2016,2016:4743176
[8] VERHAEGHE B,GEVAERT P,HOLTAPPELS G,et al.Up-regulation of IL-18 in allergic rhinitis[J].Allergy,2002,57(9):825
[9] MAROTTE H,AHMED S,RUTH JH,et al.Blocking ERK-1/2 reduces tumor necrosis factor alpha-induced interleukin-18 bioactivity in rheumatoid arthritis synovial fibroblasts by induction of interleukin-18 binding protein A[J].Arthritis Rheum,2010,62(3):722
[10]MAROTTE H,TSOU PS,RABQUER BJ,et al.Blocking of interferon regulatory factor 1 reduces tumor necrosis factor α-induced interleukin-18 bioactivity in rheumatoid arthritis synovial fibroblasts by induction of interleukin-18 binding protein a:role of the nuclear interferon regulatory factor 1-NF-κB-C-jun complex[J].Arthritis Rheum,2011,63(11):3253
[11]SEIDMAN MD,GURGEL RK,LIN SY,et al.Clinical practice guideline:allergic rhinitis[J].Otolaryngol Head Neck Surg,2015,152(1 Suppl):S1
[12]ARIANO R,MERENDINO RA,MINCIULLO PL,et al.Specific immunotherapy effect on interleukin-18 and CD30 serum levels in monosensitized patients with rhinitis[J].Allergy Asthma Proc,2003,24(3):179
[13]DINARELLO CA,NOVICK D,KIM S,et al.Interleukin-18 and IL-18 binding protein[J].Front Immunol,2013,4:289
[14]ODA H,KAWAYAMA T,IMAOKA H,et al.Interleukin-18 expression, CD8(+) T cells, and eosinophils in lungs of nonsmokers with fatal asthma[J].Ann Allergy Asthma Immunol,2014,112(1):23
[15]BANDA NK,VONDRACEK A,KRAUS D,et al.Mechanisms of inhibition of collagen-induced arthritis by murine IL-18 binding protein[J].J Immunol,2003,170(4):2100
[16]KIM SH,EISENSTEIN M,REZNIKOV L,et al.Structural requirements of six naturally occurring isoforms of the IL-18 binding protein to inhibit IL-18[J].Proc Natl Acad Sci U S A,2000,97(3):1190

