食管鳞癌组织中GSK3β表达的临床意义
刘怡文,孙 蔚,齐义军,高社干
河南科技大学第一附属医院临床医学院;河南省肿瘤表观遗传重点实验室 河南洛阳 471003
食管癌是世界上最常见的八大恶性肿瘤之一,而中国每年新增的食管癌患者约占全球的一半。在我国,约90%食管癌为食管鳞癌。食管癌具有显著的地域性分布差异,高发区与低发区发病率和死亡率可相差500倍,预后极差,5 a生存率仅10%左右[1]。河南省林州、安阳、卫辉等是中国及世界上食管癌发病率和死亡率最高的地区之一[2]。糖原合成酶激酶3(glycogen synthase kinase 3,GSK3)是一个广泛表达的丝氨酸/苏氨酸激酶,包括GSK3α和GSK3β两种亚型。虽然GSK3α和GSK3β由不同的基因所编码,但二者具有85%的同源性,催化结构域具有93%的同源性,在哺乳动物中执行不同的功能[3]。GSK3β是信号转导通路中的关键激酶之一,参与慢性炎症的调控,并与多种肿瘤的发生发展关系密切[4-15]。本研究旨在分析GSK3β在52例食管鳞癌组织中的表达及其临床意义。
1 对象与方法
1.1研究对象52例食管鳞癌及相应癌旁(距肿瘤边缘>5 cm)组织标本来自2011年2月至11月于河南科技大学第一附属医院接受手术治疗且经病理学确诊的食管鳞癌患者。其中男33例,女19例;≤60岁25例,>60岁27例;有吸烟史33例,无吸烟史19例;有饮酒史42例,无饮酒史10例;高分化、中分化和低分化分别有15、27与10例;有淋巴结转移13例,无转移39例;浸润深度≤深肌层21例,>深肌层31例;TNM分期为Ⅰ、Ⅱ和Ⅲ期者分别有10、29与13例。手术切除组织离体后经福尔马林固定或冷冻保存。患者术前均未接受放化疗及免疫治疗。该项目经过河南科技大学第一附属医院伦理委员会的同意,并于术前获得患者书面知情同意。
1.2GSK3βmRNA的检测上述冻存食管鳞癌及癌旁组织标本经液氮冷冻后研磨为粉末,加入适量Trizol(美国Invitrogen公司)提取RNA,取1 μg RNA进行反转录(试剂盒购自北京鼎国生物技术有限责任公司)合成cDNA,采用实时荧光定量PCR(试剂盒购自诺唯赞公司)检测GSK3β mRNA。GSK3β特异性引物序列为:上游5’-ATGCCACAG CAGCGTCAG-3’,下游5’-GGTCTGTCCACGGTCTCC-3’;内参GAPDH引物序列为:上游5’-GCCA CATCGCTCAGACACC-3’,下游5’-GATGGCAA CAATATCCACTTTACC-3’。GSK3β和GAPDH退火温度均为60 ℃,经40个循环扩增,计算2-ΔΔCt,以此表示GSK3β mRNA的表达水平。
1.3GSK3β蛋白的Westernblot法检测将冻存组织如上研磨为粉末,加入适量蛋白裂解液(美国Invitrogen公司),离心后取上清,BCA法进行蛋白定量。120 g/L SDS-聚丙烯酰胺凝胶电泳,转膜,脱脂奶粉封闭PVDF膜(上海密理博公司)1 h,加GSK3β抗兔单克隆抗体(稀释度11 000,美国CST公司)或内参GAPDH抗兔多克隆抗体(稀释度为12 000),4 ℃过夜,辣根过氧化物酶标记山羊抗兔二抗(稀释度为13 000)室温孵育2 h(抗体均购自北京康为世纪生物科技有限公司),使用ECL(美国Invitrogen公司)显影剂处理PVDF膜后于凝胶成像系统(美国BIO-RAD公司)检测目的蛋白条带,应用Image Lab软件测定条带灰度值,以目的蛋白与内参蛋白条带灰度值的比值表示目的蛋白的表达水平。
1.4GSK3β蛋白的免疫组化法检测固定组织经石蜡包埋、切片后,于60 ℃溶蜡1 h,二甲苯脱蜡,梯度乙醇水化,柠檬酸液修复抗原,采用免疫组化SP超敏试剂盒(北京中杉金桥生物技术有限公司)检测GSK3β蛋白,一抗为抗兔单克隆抗体(稀释度1200,美国CST公司)。苏木精复染,梯度乙醇脱水,透明,中性树胶封片。阳性细胞表现为胞质或胞核棕黄色颗粒状着色。于高倍镜下挑选5个视野观察,根据细胞染色强度评分:未着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;根据阳性细胞百分比评分:≤5%为0分,>5%且≤25%为1分,>25%且≤75%为2分,>75%为3分。两项评分的乘积为免疫评分,取5个视野免疫评分的均值,0分为阴性,1~12分为阳性。
1.5统计学处理运用SPSS 19.0对数据进行统计学处理。食管鳞癌及相应癌旁组织中GSK3β蛋白阳性表达率的比较采用配对卡方检验,GSK3β mRNA及蛋白表达水平的比较采用配对符号秩和检验。采用Cox回归模型筛选食管鳞癌术后预后影响因素。检验水准α=0.05。
2 结果
2.1食管鳞癌及癌旁组织中GSK3β的表达GSK3β mRNA及蛋白表达水平(图1、表1)结果显示,食管鳞癌组织中两者的表达水平均高于癌旁组织。免疫组化染色结果(图2)显示,GSK3β蛋白主要表达于肿瘤细胞胞质,部分胞核也可见阳性着色;食管鳞癌组织中GSK3β 蛋白阳性表达率(63.5%)高于癌旁组织(19.2%),见表2,且GSK3β着色强度和着色范围随着食管鳞癌组织分化程度的降低逐渐增加。

T:癌组织;N:癌旁组织图1 Western blot法检测GSK3β蛋白表达
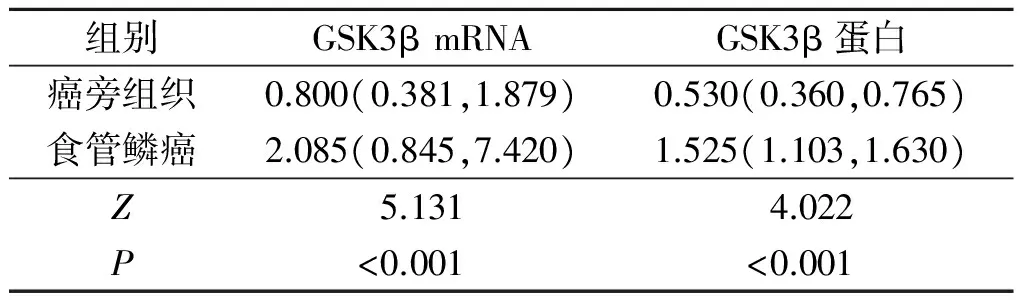
组别GSK3βmRNAGSK3β蛋白癌旁组织0.800(0.381,1.879)0.530(0.360,0.765)食管鳞癌2.085(0.845,7.420)1.525(1.103,1.630)Z5.1314.022P<0.001<0.001
表中数据为中位数和上下四分位数
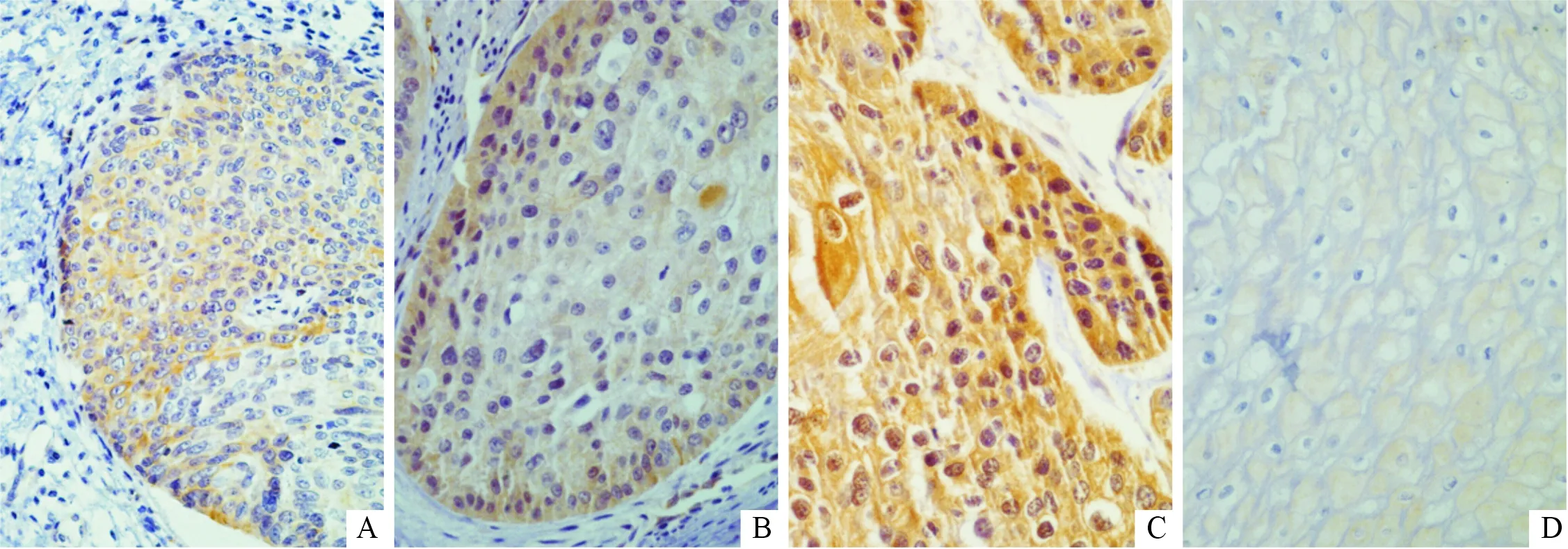
A、B、C:分别为高分化、中分化、低分化食管鳞癌组织;D:癌旁组织图2 食管鳞癌及癌旁组织中GSK3β蛋白的表达(SP,×400)
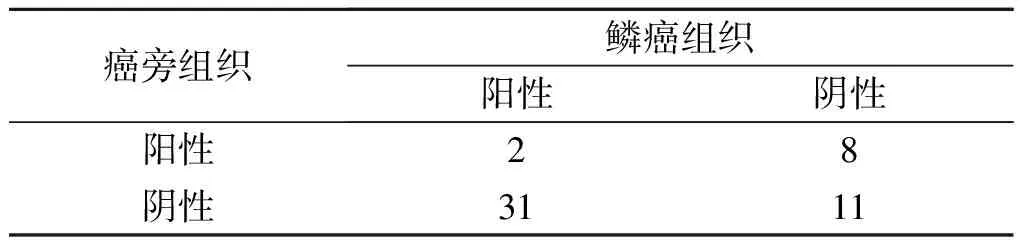
χ2=13.564,P<0.001
2.2食管鳞癌患者预后影响因素分析52例食管鳞癌患者中共有50例成功完成术后随访,随访时间1~30个月,另2例因为联系方式改变或拒绝访问而失访。以食管鳞癌导致的死亡为终点事件,以食管鳞癌组织中GSK3β蛋白表达水平(“≥中位数”=1,“<中位数”=0),以性别(“男”=1,“女”=0)、年龄(“>60岁”=1,“≤60岁”=0)、吸烟(“有吸烟史”=1,“无吸烟史”=0)、饮酒(“有饮酒史”=1,“无饮酒史”=0)、淋巴结转移(“阳性”=1,“阴性”=0)、浸润深度(“>深肌层”=1,“≤深肌层”=0)、TNM分期(“Ⅲ期”=1,“Ⅰ+Ⅱ期”=0)为自变量,进行Cox回归分析,结果(表3)显示,GSK3β蛋白高表达为食管鳞癌患者术后预后的独立危险因素。
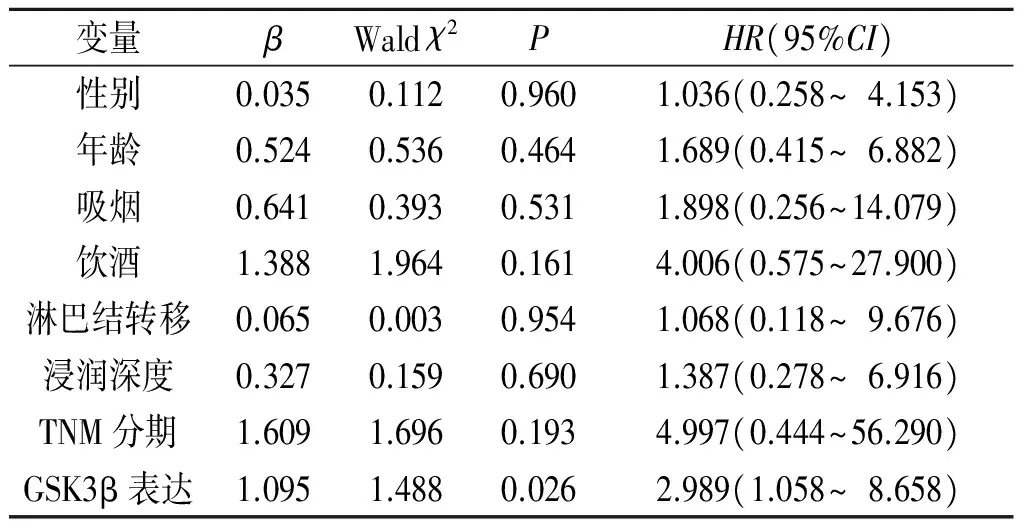
表3 食管鳞癌患者术后预后影响因素的Cox回归分析
3 讨论
GSK3β是一种多功能的丝氨酸/苏氨酸蛋白激酶,它不仅可通过抑制磷酸化糖原合成酶的活性,升高机体血糖浓度,还可通过调控多种转录因子(如AP-1、NF-κB、c-Myc、β-catenin、P53和STATs等)的活性或稳定性参与多种生理及病理过程,包括细胞增生、分化、迁移、黏附、凋亡及炎症因子产生等,与多种肿瘤的发生发展关系密切[3-4]。然而,GSK3β在肿瘤发生及演进过程中的作用目前报道不一。有报道[3,5]其促进了结直肠癌、胰腺癌、骨肉瘤、肝癌、卵巢癌、白血病等肿瘤的发生发展,而在口腔癌、皮肤癌、肺癌、乳腺癌等中则发挥肿瘤抑制作用。
在生长因子、佛波酯、TLRs、T细胞受体、CD28、白介素等因子的刺激下,蛋白激酶Akt、P70S6K、P90RSK、PKC、PKA等能够通过磷酸化GSK3β的21位和(或)9位丝氨酸残基而导致其失活[5-12]。NFκB转录活性升高能够促进炎症及肿瘤发生发展,而GSK3β可调控NFκB的转录活性,从而参与肿瘤的演进过程[5,10]。GSK3β还参与了Wnt信号转导通路,GSK3β失活可使β-catenin在胞质内积聚同时转入细胞核,激活下游基因转录,促进细胞周期进程[8-9]。GSK3β抑制剂LiCl能够调控细胞周期蛋白表达,抑制食管鳞癌细胞EC109的增殖活性[9]。
在非小细胞肺癌组织中,GSK3β主要表达于胞质,表达水平显著低于正常肺组织,并与患者的性别、年龄、吸烟及组织病理类型相关,与淋巴结转移无关[13]。LI等[14]应用免疫荧光法检测发现,GSK3β在前列腺癌组织中主要表达于胞质,而在正常前列腺组织中主要表达于胞核;前列腺癌组织中GSK3β表达明显高于正常前列腺组织,且GSK3β的表达与前列腺癌患者预后有关。Zhou等[15]应用免疫组化法检测发现,GSK3β在食管癌组织中的表达较正常食管上皮明显升高,并与淋巴结转移相关。本研究采用免疫组化法检测到GSK3β蛋白主要表达于食管鳞癌细胞胞质,部分胞核也可见阳性着色,且随着分化程度的降低,GSK3β着色强度和着色范围逐渐增加;定量检测结果显示食管鳞癌组织中GSK3β mRNA及蛋白表达水平均高于相应癌旁组织;多因素Cox回归分析结果表明GSK3β蛋白高表达为食管鳞癌患者术后预后的独立危险因素。
综上所述, GSK3β高表达可能促进了食管鳞癌的发生,GSK3β可能成为食管鳞癌靶向治疗的分子靶点之一。
[1] YUAN X,HE J,Sun F,et al.Effects and interactions of MiR-577 and TSGA10 in regulating esophageal squamous cell carcinoma[J].Int J Clin Exp Pathol,2013,6(12):2651
[2] MA S,BAO JY,KWAN PS,et al.Identification of PTK6, via RNA sequencing analysis, as a suppressor of esophageal squamous cell carcinoma[J].Gastroenterology,2012,143(3):675
[3] FRAME S,COHEN P.GSK3 takes centre stage more than 20 years after its discovery[J].Biochem J,2001,359(Pt 1):1
[4] MUKAI F,ISHIGURO K,SANO Y,et al.Alternative splicing isoform of tau protein kinase Ⅰ/glycogen synthase kinase 3beta[J].J Neurochem,2002,81(5):1073
[5] MISHRA R.Glycogen synthase kinase 3 beta: can it be a target for oral cancer[J].Mol Cancer,2010,9:144
[6] EMBI N,RYLATT DB,COHEN P.Glycogen synthase kinase-3 from rabbit skeletal muscle. Separation from cyclic-AMP-dependent protein kinase and phosphorylase kinase[J].Eur J Biochem,1980,107(2):519
[7] WOODGETT JR,COHEN P.Multisite phosphorylation of glycogen synthase.Molecular basis for the substrate specificity of glycogen synthase kinase-3 and casein kinase-Ⅱ(glycogen synthase kinase-5)[J].Biochim Biophys Acta,1984,788(3):339
[8] DOBLE BW,WOODGETT JR.GSK-3:tricks of the trade for a multi-tasking kinase[J].J Cell Sci,2003,116(Pt 7):1175
[9] KOCKERITZ L,DOBLE B,PATEL S,et al.Glycogen synthase kinase-3:an overview of an over-achieving protein kinase[J].Curr Drug Targets,2006,7(11):1377
[10]WANG H,BROWN J,Martin M.Glycogen synthase kinase 3:a point of convergence for the host inflammatory response[J].Cytokine,2011,53(2):130
[11]FORDE JE,DALE TC.Glycogen synthase kinase 3: a key regulator of cellular fate[J].Cell Mol Life Sci,2007,64(15):1930
[12]ALI A,HOEFLICH KP,Woodgett JR.Glycogen synthase kinase-3:properties,functions,and regulation[J].Chem Rev,2001,101(8):2527
[13]XU X,SUN PL,LI JZ,et al.Aberrant Wnt1/β-catenin expression is an independent poor prognostic marker of non-small cell lung cancer after surgery[J].J Thorac Oncol,2011,6(4):716
[14]LI R,ERDAMAR S,DAI H,et al.Cytoplasmic accumulation of glycogen synthase kinase-3 beta is associated with aggressive clinicopathological features in human prostate cancer[J].Anticancer Res,2009,29(6):2077
[15]ZHOU XB,LU N,ZHANG W,et al.Expression and significance of beta-catenin in esophageal carcinoma[J].Ai Zheng,2002,21(8):877

