中老年肾癌患者内脏型肥胖与肿瘤分级的关系
杜依青,刘士军,叶雄俊,杨 波,李 清,于路平,张晓威,盛正祚,殷华奇,王 强,秦彩朋,徐 涛
北京大学人民医院泌尿外科,北京 100044
肾细胞癌(renal cell carcinoma,RCC)简称肾癌,是泌尿系常见肿瘤之一,其发病率占所有恶性肿瘤的2%~3%,且近年来呈持续上升趋势,成为发病率上升最快的肿瘤之一。在过去十几年中,RCC的全球发病率以每年2%的速度增长[1],在我国,2005年RCC发病率为3.96/10万,而2012年这一比例已上升至9.47/10万[2]。RCC常为隐匿性发病,许多RCC患者发病初期无明显症状,在疾病晚期才被诊断,其5年生存率仅为50%~60%。
尽管RCC具有较高的发病率和病死率,但其病因仍不完全清楚。现认为除了遗传因素,生活方式在该病的发生发展中也扮演着十分重要的角色[1]。近年来一些研究结果提示肥胖与RCC的发生发展相关[3]。Wang等[4]综合分析了21项关于体质量指数(body mass index,BMI)和RCC发病风险的研究,发现BMI与RCC发病风险相关,BMI每增加1 kg/m2,RCC发病风险增加4%。有趣的是,另一项关于BMI与RCC预后关系的Meta分析结果显示,高BMI能明显改善患者总生存率[风险比(hazard ratio,HR)=0.57, 95% CI: 0.43~0.76]、肿瘤特异生存率(HR=0.59, 95% CI:0.48~0.74)和无进展生存率(HR=0.49, 95% CI:0.30~0.81)。面对这一相反的结果,笔者认为有必要深入研究肥胖和RCC之间的关系。
在既往研究中,大多以BMI作为评估肥胖的指标,虽然其能够反映患者的整体营养状况,但无法体现体脂分布的异常。众所周知,脂肪组织主要分为两部分,内脏脂肪(visceral adipose tissue,VAT)和皮下脂肪(subcutaneous adipose tissue,SAT)[5],两者在功能上有很大差异。故本研究采用BMI、VAT、SAT、总脂肪(total adipose tissue, TAT)、VAT占TAT比例(VAT%)等多种肥胖评估指标,探讨不同类型脂肪含量及体脂分布情况与RCC病理学分级的相关性。
1 对象与方法
1.1 对象
2009年1月至2014年9月北京大学人民医院因RCC行肾切除或部分肾切除手术的278例患者,回顾性分析其临床资料。纳入研究的标准为:(1)术后病理证实为RCC;(2)患者年龄≥50岁;(3)患者术前2周内的腹部平扫CT资料可获得;(4)术前无腹部手术、免疫治疗或靶向治疗病史。本研究获得北京大学人民医院伦理委员会批准。
1.2 数据采集方法
一般临床资料采集方法:年龄、性别、吸烟史、身高、体重、BMI和肿瘤直径等由病历资料中获得。
脂肪含量测定方法:VAT、SAT和TAT的定量方法参照文献[6],即选取患者术前仰卧位腹部平扫的脐平面CT,首先手动描绘出腹壁肌层,以此为界限区分内脏和皮下脂肪,然后采用Image J软件自动计算CT值在-190至-30 HU的组织面积即为相应的VAT或SAT含量(图1)。脂肪含量的测定由1名放射科医生在不知道患者临床病理信息的条件下测定。内脏型肥胖的程度由VAT占TAT的比例表示,即VAT%=[VAT/(VAT+SAT)] ×100%。
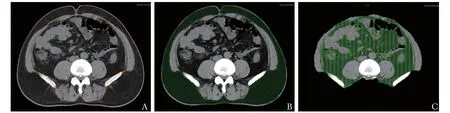
图1CT测量内脏和皮下脂肪
首先描绘出腹壁肌层范围(A),以此为界限区分内脏和皮下脂肪,然后采用Image J软件自动计算CT值在-190至-30 HU的组织面积即为相应的皮下脂肪(B)或内脏脂肪(C)含量
肾癌组织学分级标准:根据1997年世界卫生组织(World Health Organization,WHO)推荐的Fuhrman分级标准[7],由两名不知道脂肪测定结果的病理科医生分别进行评估,如有意见分歧则讨论决定或咨询第3名病理医生的意见。由于本研究纳入的病例中Furhman Ⅳ级的比例较低(2.5%),故将Furhman Ⅰ级和Ⅱ级归为低级别肿瘤,将Furhman Ⅲ级和Ⅳ级归为高级别肿瘤。
1.3 统计学处理
采用SPSS 13.0软件进行统计学分析。计量资料以均数±标准差表示,计数资料以百分数表示。计量资料间的相关性采用Pearson相关系数进行分析。高级别肿瘤和低级别肿瘤组间各变量的差异比较:正态分布的连续变量采用t检验,非正态分布的连续变量采用Mann-WhitneyU检验,分类变量采用卡方检验;各变量与高级别肿瘤之间的相关性采用单因素Logistic回归分析,计算比值比(odds ratio,OR)及95% CI,然后将P<0.1的变量纳入多因素Logistic回归分析。P<0.05为差异具有统计学意义。
2 结果
2.1 患者一般情况
本研究共纳入278例RCC患者,平均年龄(63.55±8.80)岁,其中男性183例(65.83%),吸烟者91例(32.73%)。采用现行的亚太地区肥胖标准划分,89例(32.01%)患者为偏瘦或正常体重(BMI<23 kg/m2),63例(22.66%)为超重(23 kg/m2≤BMI<25 kg/m2),126例(45.32%)为肥胖(BMI≥25 kg/m2);平均BMI为(25.06±3.47) kg/m2,平均TAT为(15 812.13±5965.03)mm2,平均VAT为(6891.80±2914.86)mm2,平均SAT为(8920.33±3949.61)mm2,平均VAT%为(43.72±10.14)%。肿瘤平均直径为(4.25±2.38)cm,其中透明细胞癌267例(96.04%),高级别肿瘤29例(10.43%)(表1)。
2.2 肥胖指标间相关性分析

表 1 278例肾癌患者一般资料
BMI:体质量指数;TAT:总脂肪;VAT:内脏脂肪; SAT:皮下脂肪
Pearson相关系数分析结果显示,TAT(r=0.786,P<0.01)、VAT (r=0.657,P<0.01) 和SAT(r=0.694,P<0.01)均与BMI相关,但VAT%与BMI无明显相关性(r=0.016,P=0.799)。VAT%与患者年龄和肿瘤直径亦无明显相关性,但其与性别相关,男性患者平均VAT%明显高于女性患者(47.42%比36.59%,P<0.01)(图2)。
2.3 肿瘤分级与肥胖指标间相关性分析
根据肿瘤Furhman分级将278例RCC患者分为高级别肿瘤组和低级别肿瘤组,两组在年龄、性别、有无吸烟史、身高、体重、BMI、TAT、VAT和SAT等方面均无明显差异,但高级别肿瘤患者具有较高的VAT% [(47.80± 8.33)%比(43.24±10.24)%,P=0.022)、较低的SAT%[(52.20± 8.33)%比(56.78±10.26)%,P=0.021]和较大的肿瘤直径[(5.42± 2.99)cm比(4.11±2.27)cm,P=0.021](表2)。
单因素Logistic回归分析结果显示,VAT%与高级别肿瘤相关(OR=1.048,95% CI:1.007~1.091,P=0.023),同时肿瘤直径与高级别肿瘤亦存在相关性(OR=1.202,95% CI:1.049~1.376,P=0.008),而BMI和TAT与高级别肿瘤无明显相关性。在多因素Logistic回归分析中,将单因素分析中P<0.1的变量纳入分析,矫正吸烟史和肿瘤直径后,VAT%仍与高级别肿瘤相关(OR=1.045, 95% CI: 1.002~ 1.090,P=0.042),同时在本研究中也再一次证实肿瘤直径与肿瘤分级相关(OR=1.202, 95% CI: 1.049~1.377,P=0.008)(表3)。
进一步根据美国癌症联合会(American Joint Committee on Cancer,AJCC)分期及肿瘤直径进行亚组分析。结果显示,在进展性RCC(Ⅲ期或Ⅳ期)和较大肿瘤(肿瘤直径>4 cm)病例中,VAT%与高级别肿瘤呈正相关(OR=1.131, 95% CI:1.017~1.256,P=0.023;OR=1.061, 95% CI:1.005~ 1.121,P=0.032),但在局限性RCC或较小肿瘤(肿瘤直径≤4 cm)病例中,VAT%与高级别肿瘤无明显相关性(表4,5)。
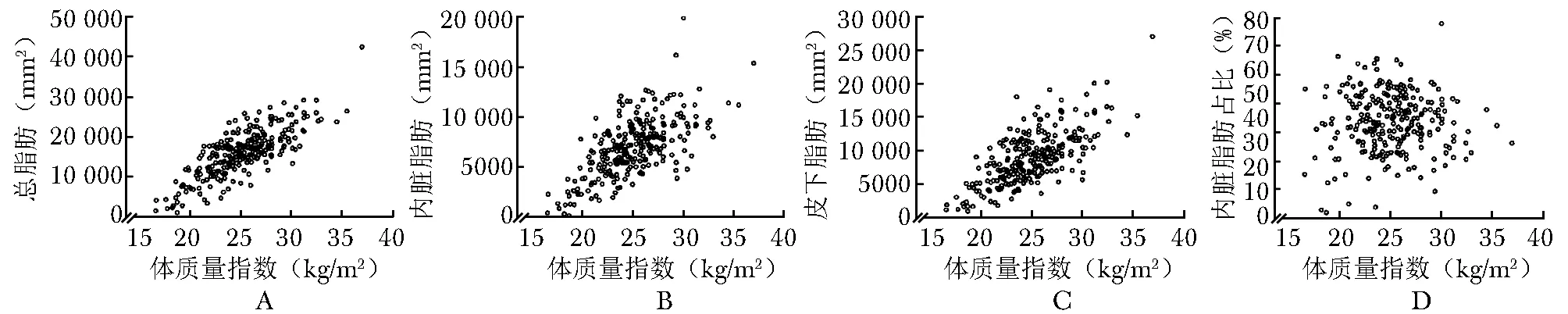
图2体质量指数与总脂肪(A)、内脏脂肪(B)、皮下脂肪(C)和内脏脂肪占比(D)的相关性分析
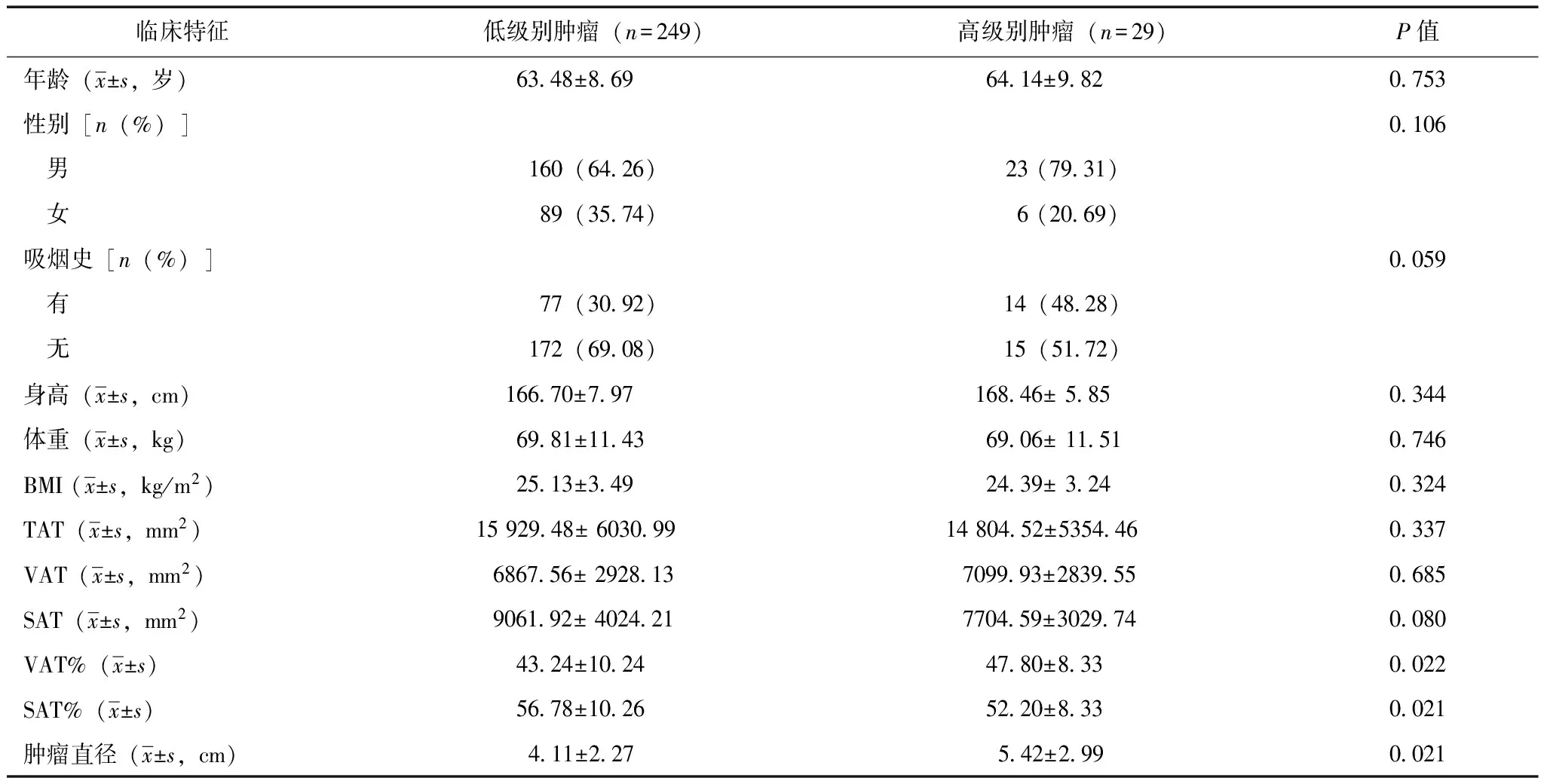
表 2 两组肾癌患者临床资料比较
BMI、TAT、VAT、SAT:同表1
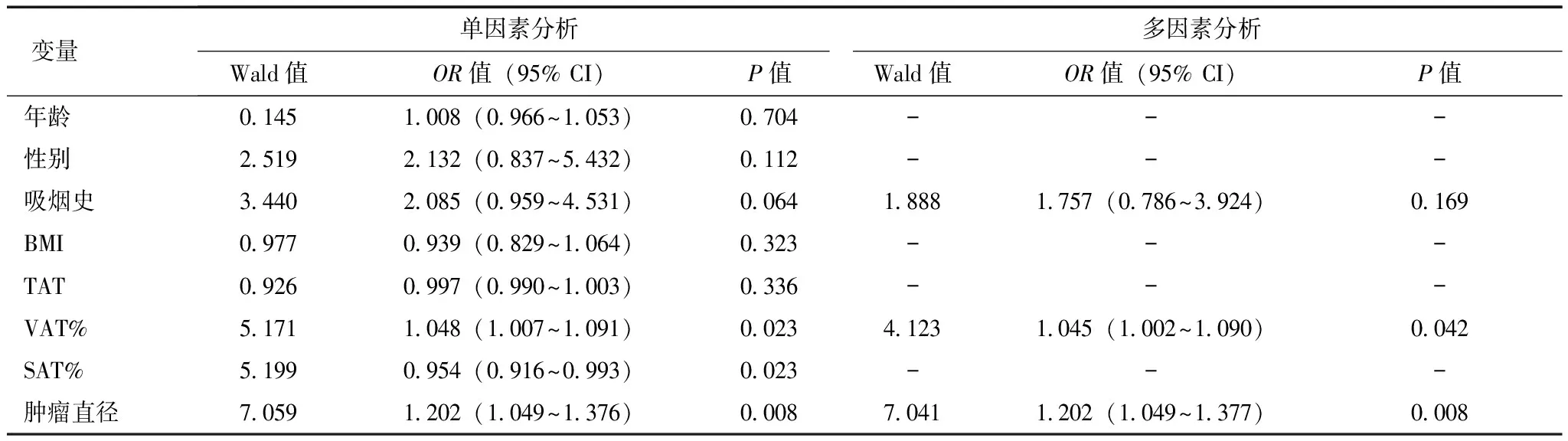
表 3 29例高级别肿瘤患者与临床指标相关性回归分析结果
BMI、TAT、VAT、SAT:同表1
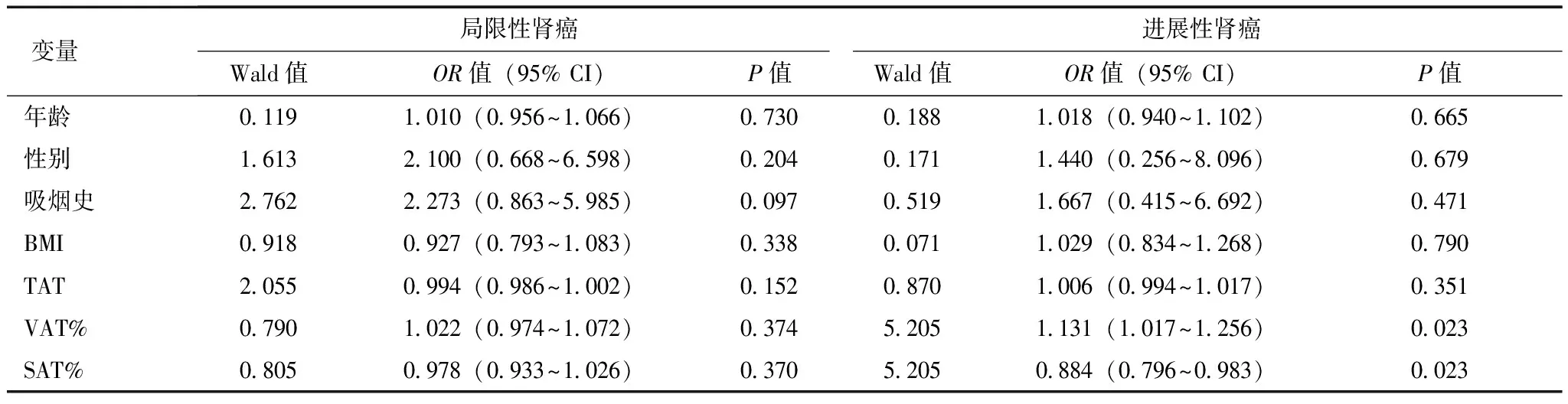
表 4 29例高级别肿瘤患者根据AJCC分期分层后与临床指标相关性回归分析结果
AJCC:美国癌症联合会;BMI、TAT、VAT、SAT:同表1
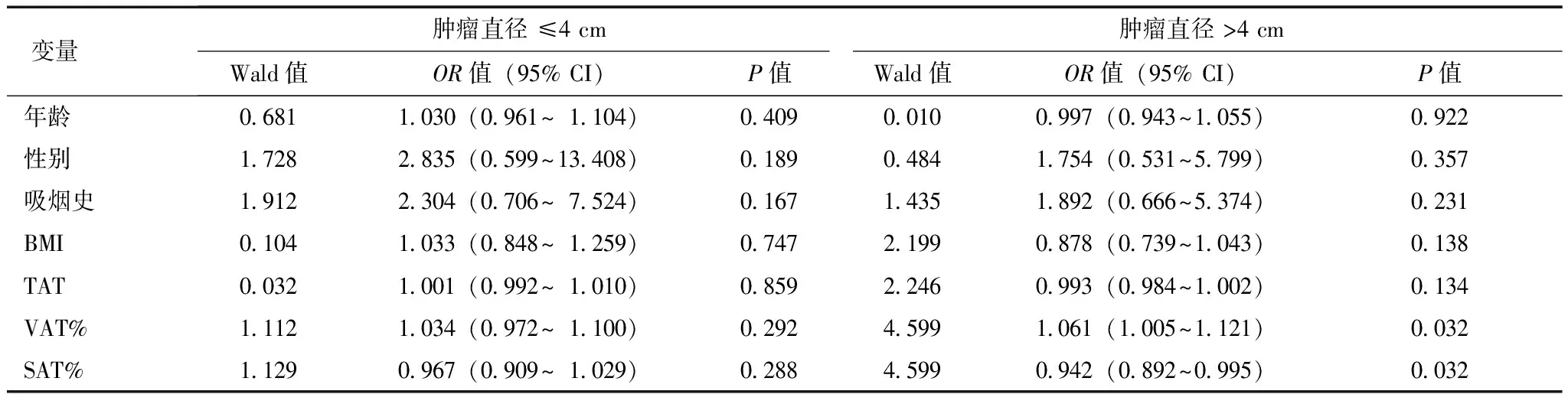
表 5 29例高级别肿瘤患者根据肿瘤大小分层后与临床指标相关性回归分析结果
BMI、TAT、VAT、SAT:同表1
3 讨论
肥胖已成为困扰全球的健康和社会问题。研究显示,一些疾病如冠心病、糖尿病、高血压和某些恶性肿瘤在肥胖者中高发,其中也包括RCC[8]。现有的流行病学研究结果提示,BMI与RCC发病率呈正相关[9]。在一项纳入超过900 000例美国成年人的前瞻性流行病学研究中,研究者发现肥胖可增加RCC的发病风险,在男性中相对风险为1.70,女性中为4.75[10]。Renehan等[3]纳入 17个相关研究的Meta分析进一步证实了肥胖与RCC的发病风险相关。而有趣的是,尽管较高的BMI可增加RCC的发病风险,但Parker等[11]的研究结果提示具有较高BMI的RCC患者其肿瘤的恶性程度较低。这一矛盾的结果提示肥胖与RCC之间的关系较为复杂,需要进一步深入研究。
众所周知,肥胖是由过多的脂肪聚积所致。近年来研究发现脂肪组织可以分为2种类型,即VAT和SAT,两者由不同类型的脂肪细胞构成,在功能方面存在很大差异[5],如内分泌功能、脂解活性和对胰岛素等激素的反应性均不同。而BMI作为最常用的评估肥胖的指标,虽然可以反映总的脂肪蓄积水平,却无法区分不同脂肪类型和脂肪分布情况。本研究结果也证实,虽然BMI与VAT、SAT和TAT均具有较好的相关性,但其无法反映VAT%的水平(图2)。因此,在进行肥胖与RCC关系的研究中,除了体重、BMI等常用指标,不同类型的脂肪含量及其占总脂肪的比例也应纳入分析中。
既往,在肥胖与RCC相关性研究中,VAT、SAT或VAT%作为评估肥胖的指标效果优于BMI。Wang等[2]分析了487例局限性RCC的资料,发现VAT水平较高的患者透明细胞癌的发生风险较高,且其预测RCC病理类型的效果优于BMI。Kaneko等[12]的研究显示,在局限性RCC患者中,VAT水平与无复发生存时间呈正比,而BMI则与生存期无相关性,Nava等[13]的研究结果也进一步证实了上述结果。另一项纳入706例局限性RCC的研究发现,VAT%与疾病复发风险呈U型相关[14]。本研究结果亦显示,在278例RCC患者中,VAT%水平与高级别肿瘤相关,但BMI与肿瘤分级无相关性。此外,本研究根据肿瘤分期及直径不同进行了亚组分析,分析结果提示在进展性肿瘤或肿瘤直径较大(>4 cm)的病例中,VAT%与肿瘤级别的相关性更为显著。
尽管本研究发现在中老年RCC患者中,尤其是进展性肿瘤或较大肿瘤患者中,内脏型肥胖与高级别肿瘤具有相关性,但本研究仍存在很多不足。首先,本研究为样本量较小的单中心研究,且在所有纳入的病例中高级别肿瘤患者比例仅占10.4%,所得结论可能具有较大偏倚,仍需进一步多中心大样本研究证实。其次,本研究为回顾性分析,只能得到相关性结论而无法判断因果关系。最后,本研究纳入的患者均为中国人,与西方人群相比,在同样的BMI水平下亚洲人更易出现内脏型肥胖[15],故本研究结论仍需在其他种族中证实。
综上,在中老年肾癌患者中,尤其是进展性肾癌和肿瘤直径较大的患者中,内脏型肥胖与肿瘤分级相关,内脏型肥胖可能是高级别肾癌的危险因素。
[1] Ljungberg B, Bensalah K, Canfield S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J]. Eur Urol,2015,67:913- 924.
[2] Wang HK, Song XS, Cheng Y, et al. Visceral fat accumulation is associated with different pathological subtypes of renal cell carcinoma(RCC): a multicentre study in China[J]. BJU Int,2014,114:496- 502.
[3] Renehan AG, Tyson M, Egger M, et al. Body-mass index and incidence of cancer: a systematic review and meta-analysis of prospective observational studies[J]. Lancet,2008,371:569- 578.
[4] Wang F, Xu Y. Body mass index and risk of renal cell cancer: a dose-response meta-analysis of published cohort studies[J]. Int J Cancer,2014,135:1673- 1686.
[5] Ibrahim MM. Subcutaneous and visceral adipose tissue: structural and functional differences[J]. Obes Rev,2010,11:11- 18.
[6] Ladoire S, Bonnetain F, Gauthier M, et al. Visceral fat area as a new independent predictive factor of survival in patients with metastatic renal cell carcinoma treated with antiangiogenic agents[J]. Oncologist,2011,16:71- 81.
[7] Fuhrman SA, Lasky LC, Limas C. Prognostic significance of morphologic parameters in renal cell carcinoma[J]. Am J Surg Pathol,1982,6:655- 663.
[8] Mokdad AH, Ford ES, Bowman BA, et al. Prevalence of obesity, diabetes, and obesity-related health risk factors, 2001[J]. JAMA,2003,289:76- 79.
[9] Bergstrom A, Hsieh CC, Lindblad P, et al. Obesity and renal cell cancer-a quantitative review[J]. Br J Cancer,2001,85:984- 990.
[10] Calle EE, Rodriguez C, Walker-Thurmond K, et al. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults[J]. N Engl J Med,2003,348:1625- 1638.
[11] Parker AS, Lohse CM, Cheville JC, et al. Greater body mass index is associated with better pathologic features and improved outcome among patients treated surgically for clear cell renal cell carcinoma[J]. Urology,2006,68:741- 746.
[12] Kaneko G, Miyajima A, Yuge K, et al. Visceral obesity is associated with better recurrence-free survival after curative surgery for Japanese patients with localized clear cell renal cell carcinoma[J]. Jpn J Clin Oncol,2015,45:210- 216.
[13] Naya Y, Zenbutsu S, Araki K, et al. Influence of visceral obesity on oncologic outcome in patients with renal cell carcinoma[J]. Urol Int,2010,85:30- 36.
[14] Park YH, Lee JK, Kim KM, et al. Visceral obesity in predicting oncologic outcomes of localized renal cell carcinoma[J]. J Urol,2014,192:1043- 1049.
[15] Kadowaki T, Sekikawa A, Murata K, et al. Japanese men have larger areas of visceral adipose tissue than Caucasian men in the same levels of waist circumference in a population-based study[J]. Int J Obes(Lond),2006,30:1163- 1165.

