耐碳青霉烯类肺炎克雷伯菌的分子流行病学分析
史玮炀, 刘 洋, 韩逸超, 郑丹丹, 戴尔宽, 郑 冰, 李 敏
(上海交通大学医学院附属仁济医院检验科,上海 200127)
肺炎克雷伯菌为临床常见的革兰阴性菌,是引起医院感染的主要致病菌之一。目前临床使用碳青霉烯类抗菌药物治疗肺炎克雷伯菌所致感染,但随着此类药物的广泛使用,肺炎克雷伯菌对其耐药性不断增强。许多国家均已发现耐碳青霉烯类肺炎克雷伯菌(carbapenemresistant Klebsiella pneumoniae, CRKP)菌株[1],近年来我国肺炎克雷伯菌对碳青霉烯类抗菌药物的耐药性也呈逐年增强的趋势,给临床治疗带来了极大的挑战[2]。本研究对上海交通大学医学院附属仁济医院分离的CRKP的耐药性及同源性进行分析,旨在为CRKP感染的临床治疗和医院感染控制提供依据。
1 材料和方法
1.1 菌株来源及鉴定
受试菌株为上海交通大学医学院附属仁济医院检验科于2013年1月—2015年8月从临床样本中分离的CRKP(107株)。样本来源为痰液、血液、引流液、中段尿、胆汁、咽拭和脓液样本。
1.2 质控菌株
药物敏感性试验质控菌株为大肠埃希菌(ATCC 25922),聚合酶连反应(polymerase chain reaction,PCR)和脉冲场凝胶电泳(pulsed-field gel electrophoresis,PFGE)质控菌株为肺炎克雷伯菌 (ATCC 700603),均购自上海市临床检验中心。
1.3 试剂及仪器
血琼脂平板购自美国BD公司。药物敏感性纸片、水解酪蛋白胨平板购自英国Oxoid公司。PCR扩增仪购自美国应用生物系统公司。SeaKem GOLD琼脂糖粉购自美国Lonza公司,GelRed核酸染料购自美国Biotium公司,脉冲场电泳仪购自美国Bio-Rad公司,凝胶成像系统购自上海天能科技有限公司。
1.4 细菌分离鉴定与体外药物敏感性试验
细菌分离培养与鉴定按照《全国临床检验操作规程》(第3版)的要求进行。采用美国临床实验室标准化协会(the Clinical and Laboratory Standards Institute, CLSI)推荐的纸片扩散法测定受试菌株对亚胺培南、厄他培南、阿米卡星、青霉素、氨苄西林、氨苄西林-舒巴坦、哌拉西林、头孢唑啉、头孢克洛、头孢呋辛、头孢噻肟、头孢他啶、环丙沙星、复方磺胺甲噁唑、磷霉素、头孢哌酮-舒巴坦、哌拉西林和头孢吡肟的敏感性。采用微量肉汤稀释法测定美罗培南和替加环素的最低抑菌浓度(minimum inhibitory concentration,MIC)并判定敏感性。纸片扩散法及美罗培南的MIC测定结果参照CLSI 2015年标准判读[3]。替加环素的MIC测定结果参照美国食品与药品监督管理局(U. S. Food and Drug Administration,FDA)判定折点[4]判读。
1.5 碳青霉烯酶耐药基因的扩增
采用煮沸法提取107株菌株DNA,参照文献[5-7]选取引物、PCR反应体系及反应条件,扩增碳青霉烯酶耐药基因(blaKPC-2、blaOXA-48、blaVIM-1、blaVIM-2、blaIMP-1、blaIMP-2、blaNDM-1)。检出阳性基因的菌株取1株测序确认,并将其作为阳性对照,将质控菌株肺炎克雷伯菌 (ATCC 700603)作为阴性对照。引物序列见表1。
1.6 PFGE
从水解酪蛋白胨平板上挑取已培养过夜的纯菌落,用1 mL细菌悬浮液混匀,吸取200 μL加入10 μL蛋白酶K。取0.1 g SeaKem GOLD琼脂糖粉加入10 mL三羟甲基氨基甲烷-乙二胺四乙酸(methylaminomethane-ethylenediaminetetraacetic acid,TE)缓冲液,54 ℃水浴30 min。将胶与菌悬液混合,加入模具中制备胶块,使用含蛋白酶K的细胞裂解液消化4 h,弃去细胞裂解液,用预热至55 ℃的超纯水和TE缓冲液各洗3次,每次15 min。弃去液体,切下2 mm胶块,加入含ApaI的酶切缓冲液100 μL,37 ℃酶切3 h。弃去酶切缓冲液,加入0.5×三羟甲基氨基甲烷-硼酸-乙二胺四乙酸(methylaminomethane-boric acid-ethylenediaminetetraacetic acid,TBE)缓冲液200 μL。用0.5×TBE缓冲液配制1%琼脂糖凝胶,把包埋有细菌的胶块放入梳孔中。将胶块至于电泳仪中进行脉冲场电泳,电泳条件:相对分子质量30 000~600 000,6 V/cm,脉冲时间5~20 s,14 ℃,电场角度120°,总时间为19 h。电泳结束后,使用GelRed核酸染料染色胶块。将胶块置于凝胶成像系统中成像,并转换成图像格式保存。

表1 耐药基因PCR扩增的相应引物序列
1.7 统计学方法
采用NTSYS(2.1)软件中UPGMA算法进行聚类分析,得到聚类图。将具有85%以上相同条带(相关系数>0.85)的菌株归入同一型别[8]。
2 结果
2.1 样本种类与病区分布
2013年1月—2015年8月上海交通大学医学院附属仁济医院共分离1 821株肺炎克雷伯菌,其中CRKP 107株(5.9%)。样本来源包括痰液(62.6%,67/107)、血液(11.2%,12/107)、引流液(11.2%,12/107)、中段尿(9.4%,10/107)、胆汁(2.8%,3/107)、咽拭(1.9%,2/107)和脓液(0.9%,1/107)。107株CRKP分离病区居前3位的分别为神经外科(18.7%,20/107)、外科重症监护病房(intensive care unit,ICU)(18.7%,20/107)和普外科(15.9%,17/107)。见表2。

表2 各病区CRKP分布及PFGE分型结果
2.2 耐药性检测
微量肉汤稀释法测定MIC的结果显示,在107株CRKP中对美罗培南耐药的菌株占99.1%(106/107),中介的菌株占0.9%(1/107),敏感的菌株占0.0%(0/107),对替加环素耐药的菌株占0.0%(0/107),中介的菌株占0.0%(0/107),敏感的菌株占100.0%(107/107)。纸片扩散法结果显示,受试菌株对复方磺胺甲噁唑(29.0%)和磷霉素(74.7%)的耐药率最低,对青霉素、氨苄西林、哌拉西林、头孢唑啉、头孢克洛、头孢呋辛、头孢他啶、头孢噻肟、头孢吡肟、亚胺培南及厄他培南的耐药率为100.0%,对阿米卡星、头孢哌酮-舒巴坦、氨苄西林-舒巴坦、环丙沙星及哌拉西林的耐药率均>95.0%。见表3。
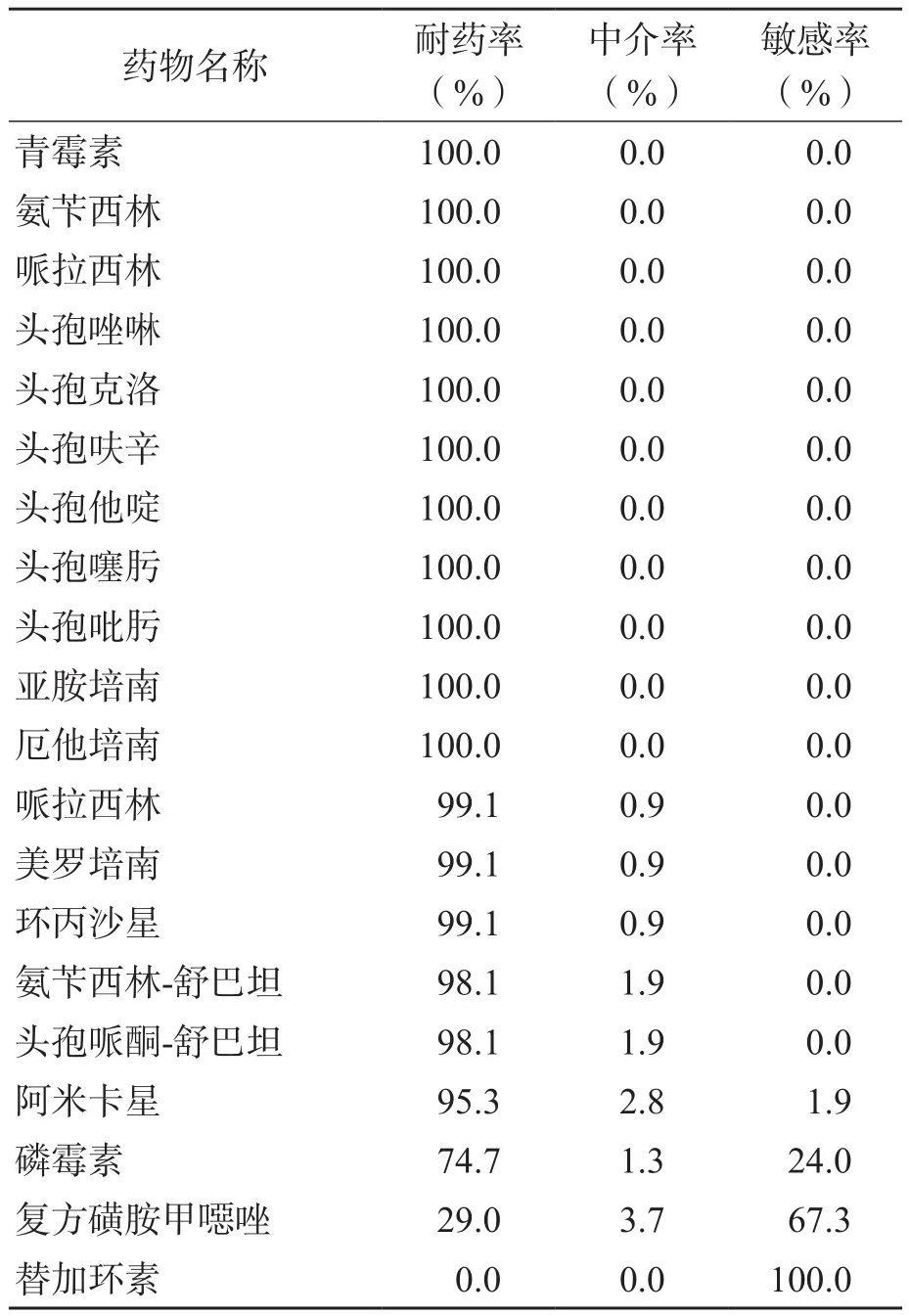
表3 107株CRKP对20种抗菌药物的耐药情况
2.3 耐药基因检测结果
在107株CRKP中检出blaKPC-2基因阳性率为100.0%(107/107),blaIMP-1基因阳性率为0.9%(1/107),未检测出blaOXA-48、blaVIM-1、blaVIM-2、blaIMP-2和blaNDM-1基因。
2.4 PFGE结果
107株CRKP经PFGE得到电泳图谱,部分结果见图1。经NTSYS(2.1)软件分析得出聚类图(图2)。将具有85%以上相同条带(相关系数>0.85)的菌株归入同一带型,107株CRKP被分为24个型别:A型[19.6%(21/107)]、B型[13.1%(14/107)]、C型[11.2%(12/107)]、D型[8.4%(9/107)]、E型[5.6%(6/107)]、F型[5.6%(6/107)]、G型[5.6%(6/107)]、H型[4.7%(5/107)]、I型[4.7%(5/107)]、J型[3.7%(4/107)]、K型[3.7%(3/107)]、L型[3.7%(3/107)]、M型[1.9%(2/107)]和N~X型各1株。A型、B型、C型为主要型别。A型21株菌株主要来自神经外科(38.1%,8/21)。B型14株菌株主要来自神经外科(28.6%,4/14)和急诊内科留观室(28.6%,4/14)。C型12株菌株,分别分离自6个病区(表2)。在107株CRKP中,27株分离自无菌体液(包括血液12株、引流液12株和胆汁3株),含A型5株(18.5%)、C型4株(14.8%)、D型3株(11.1%)、F型3株(11.1%)、B型2株(7.4%)、E型2株(7.4%)、G型2株(7.4%),H型2株(7.4%)及I、M、O和U型各1株。
微量肉汤稀释法,结果显示替加环素耐药CRKP共36株,包括A型7株,F型6株,C型4株,B型3株,D、E、H和M型各2株,G、I、J、O、P、Q和X型各1株。
21株A型CRKP中有15株(71.4%)分离于1个月内(2015年5月29日—6月29日),其中神经外科6株、门诊3株、血液科2株、老年科2株、外科ICU 1株和泌尿外科1株。在6株F型CRKP中有4株分离于2周内(2015年4月2—15日),普外科和老年科各2株。其余22型(B~E型,G~X型)共80株CRKP均散发于不同时期和不同病区,离散性较大。

图1 部分CRKP的PFGE电泳图

图2 107株CRKP的PFGE聚类分析图
3 讨论
碳青霉烯类抗菌药物可以有效治疗肺炎克雷伯菌感染,但临床不合理应用抗菌药物使耐碳青霉烯类革兰阴性杆菌数量逐年增加。AGODI等[9]报道CRKP检出率由2008年的0.0%增加至2013年的59.2%。CRKP的耐药机制包括产抗菌药物灭活酶、使抗菌药物渗透障碍(生物被膜和外膜膜孔蛋白缺失)、基因变异导致药物作用靶位改变、主动外排泵系统的亢进作用等[10]。同时CRKP也可对β-内酰胺类、喹诺酮类等抗菌药物产生耐药。
目前国内外临床治疗CRKP选用的一线药物包括碳青霉烯类、头孢类(第3代、第4代)和喹诺酮类等抗菌药物,二线药物包括替加环素、多黏菌素类、磺胺类和氨基糖苷类等抗菌药物[11]。国内外对CRKP耐药性的研究显示,CRKP对复方磺胺甲噁唑、替加环素和阿米卡星的敏感性较高。张丽等[12]报道所检CRKP敏感性最高的抗菌药物为替加环素(83.3%);UZ ZAMAN等[13]报道所检CRKP敏感性最高的抗菌药物为阿米卡星(8.7%);BONURA等[14]报道对CRKP敏感性较高的抗菌药物为多黏菌素(42.6%)、阿米卡星(40.4%)和庆大霉素(40.4%)。本研究受试CRKP对试验中应用的碳青霉烯类、青霉素类、喹诺酮类和头孢类抗菌药物均不敏感,仅部分 CRKP对替加环素(100%)、磷霉素(24.0%)和阿米卡星(1.9%)具有敏感性。本研究受试CRKP对替加环素敏感率最高,与国内外报道相一致。对阿米卡星敏感率较低,与国内外研究报道存在一定差异,可能与上海交通大学医学院附属仁济医院临床药物使用方法和习惯不同有关。值得注意的是,本研究有67.3%的受试CRKP对复方磺胺甲噁唑敏感,与目前国内外研究相比敏感性较高,这对上海交通大学医学院附属仁济医院临床治疗有指导意义。因此,建议上海交通大学医学院附属仁济医院临床治疗CRKP感染患者首选替加环素或复方磺胺甲噁唑,同时应注意减少治疗时碳青霉烯类等各类抗菌药物的滥用,防止CRKP耐药形势的进一步恶化。
自1996年首次发现blaKPC酶以来,各国均有产blaKPC酶型CRKP流行的报道[15],我国多地也报道了产blaKPC-2酶型CRKP的高检出率,产blaKPC-2酶已成为我国肺炎克雷伯菌对碳青霉烯类药物耐药的重要原因[16]。本研究分离的CRKP均检出blaKPC-2基因,其余基因阳性率极低甚至无阳性,表明blaKPC-2酶是上海交通大学医学院附属仁济医院CRKP感染患者对碳青霉烯类抗菌药物耐药的主要原因。医务人员应对CRKP的传播与感染提高警惕,尽早采取措施检测患者感染菌的耐药情况,根据CRKP常见类型与特性选取合适的治疗手段。
在多种肺炎克雷伯菌的流行病学分型方法中,PFGE是一种有效、应用广泛的技术,采用PFGE进行分型可以研究菌株之间的遗传差异,并为监测传染病的暴发流行、追踪传染源提供依据。
本研究采用PFGE将107株CRKP分为A型~X型,其中在A型21株CRKP中有15株(71.4%)分离于1个月内(2015年5月29日—6月29日),在F型6株CRKP中有4株分离于2周内(2015年4月2—15日)。医院感染暴发定义为在医疗机构或其科室的患者中,短时间内发生3例以上同种同源感染病例[17]。因此根据本研究数据得出结论,上海交通大学医学院附属仁济医院于2015年5月29日—6月29日与2015年4月2—15日期间分别发生CRKP感染暴发,A型与F型菌株是导致上海交通大学医学院附属仁济医院在这2个时期内出现CRKP感染暴发的重要原因。其余22型菌株散发于不同时期和不同病区,判断为散发菌株。
JIAO等[18]提出CRKP感染暴发与使用碳青霉烯类、糖肽类、β-内酰胺酶抑制剂、第3代头孢菌素抗菌药物,有气管切开史和年龄增长等危险因素有关。因此临床应格外重视抗菌药物(尤其是碳青霉烯类、第3代头孢菌素等抗菌药物)的合理使用,重视接受侵袭性操作患者的感染防治,重视老年患者的有效护理与合理治疗方案的制定。此外,神经外科、外科ICU等高危病区患者自身情况较差,所患疾病较严重,多数患者有既往手术史,更易发生感染并迁延不愈,且长期使用各类抗菌药物,易致病菌耐药性增强,临床应加强对此类患者的护理,减少其与感染源接触的机会,切断感染途径。
目前,上海交通大学医学院附属仁济医院2013年1月—2015年8月CRKP的传播来源与传播途径尚未明确。有研究指出医务人员双手、医疗器械和环境表面可直接传播耐药菌株[19],是病菌院内传播的主要原因。
肺炎克雷伯菌是一种重要的医院感染致病菌,CRKP的出现增加了上海交通大学医学院附属仁济医院临床对肺炎克雷伯菌感染患者治疗的难度,而院内人员大量流动以及科室间使用抗菌药物习惯不同等多方面因素也将导致医院CRKP型别的不断演变,甚至出现新型别的流行传播。因此,医护人员应合理使用抗菌药物,规范医疗操作步骤,控制肺炎克雷伯菌的耐药状态,同时注意病区内与病区间预防措施的实施,避免此类病菌的院内传播和不断演变。
[1]TSAKRIS A, KRISTO I, POULOU A, et al.First occurrence of KPC-2-possessing Klebsiella pneumoniae in a Greek hospital and recommendation for detection with boronic acid disc tests[J]. J Antimicrob Chemother, 2008, 62(6): 1257-1260.
[2]胡付品, 朱德妹, 汪复, 等. 2014年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志,2015,15(5): 401-410.
[3]Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing[S]. M100-S25, CLSI, 2015.
[4]王辉, 俞云松, 王明贵, 等. 替加环素体外药敏试验操作规程专家共识[J]. 中华检验医学杂志,2013, 36(7): 584-587.
[5]SHIBATA N, DOI Y, YAMANE K, et al. PCR typing of genetic determinants for metallo-betalactamases and integrases carried by gram-negative bacteria isolated in Japan, with focus on the class 3 integron[J]. J Clin Microbiol, 2003, 41(12):5407-5413.
[6]KRÜTTGEN A, RAZAVI S, IMÖHL M,et al.Real-time PCR assay and a synthetic positive control for the rapid and sensitive detection of the emerging resistance gene New Delhi metallo-β-lactamase-1(bla(NDM-1))[J]. Med Microbiol Immunol,2011, 200(2): 137-141.
[7]SMITH MOLAND E, HANSON N D, HERRERA V L, et al. Plasmid-mediated, carbapenemhydrolysing beta-lactamase, KPC-2, in Klebsiella pneumoniae isolates[J]. J Antimicrob Chemother,2003, 51(3): 711-714.
[8]TALON D, CAILLEAUX V, THOUVEREZ M,et al. Discriminatory power and usefulness of pulsedfield gel electrophoresis in epidemiological studies of Pseudomonas aeruginosa[J]. J Hosp Infect, 1996,32(2): 135-145.
[9]AGODI A, BARCHITTA M, QUATTROCCHI A, et al. Antibiotic trends of Klebsiella pneumoniae and Acinetobacter baumannii resistance indicators in an intensive care unit of Southern Italy, 2008-2013[J].Antimicrob Resist Infect Control, 2015, 4: 43.
[10]SHAIKH S, FATIMA J, SHAKIL S, et al.Antibiotic resistance and extended spectrum betalactamases: types, epidemiology and treatment[J].Saudi J Biol Sci, 2015, 22(1): 90-101.
[11]NEUNER E A, YEH J Y, HALL G S, et al.Treatment and outcomes in carbapenem-resistant Klebsiella pneumoniae bloodstream infections[J].Diagn Microbiol Infect Dis, 2011, 69(4): 357-362.
[12]张丽, 朱元祺, 张小兵, 等. 耐碳青霉烯类肺炎克雷伯菌的耐药基因检测[J]. 中华医院感染学杂志, 2014,24(23): 5734-5736.
[13]UZ ZAMAN T, ALDREES M, AL JOHANI S M, et al. Multi-drug carbapenem-resistant Klebsiella pneumoniae infection carrying the OXA-48 gene and showing variations in outer membrane protein 36 causing an outbreak in a tertiary care hospital in Riyadh, Saudi Arabia[J]. Int J Infect Dis, 2014,28: 186-192.
[14]BONURA C, GIUFFRÈ M, ALEO A, et al. An update of the evolving epidemic of blaKPC carrying Klebsiella pneumoniae in Sicily, Italy, 2014:emergence of multiple non-ST258 clones[J]. PLoS One, 2015, 10(7): e0132936.
[15]MUNOZ-PRICE L S, POIREL L, BONOMO R A, et al. Clinical epidemiology of the global expansion of Klebsiella pneumoniae carbapenemases[J]. Lancet Infect Dis, 2013, 13(9): 785-796.
[16]CHENG L, CAO X L, ZHANG Z F, et al.Clonal dissemination of KPC-2 producing Klebsiella pneumoniae ST11 clone with high prevalence of oqxAB and rmtB in a tertiary hospital in China:results from a 3-year period[J]. Ann Clin Microbiol Antimicrob, 2016, 15: 1.
[17]中华人民共和国卫生部. 医院感染管理办法[J]. 中国护理管理, 2006,6(7): 5-7.
[18]JIAO Y, QIN Y, LIU J, et al. Risk factors for carbapenem-resistant Klebsiella pneumoniae infection/colonization and predictors of mortality: a retrospective study[J]. Pathog Glob Health, 2015,109(2): 68-74.
[19]BEARMAN G M, ROSATO A, ELAM K,et al.A crossover trial of antimicrobial scrubs to reduce methicillin-resistant Staphylococcus aureus burden on healthcare worker apparel[J]. Infect Control Hosp Epidemiol, 2012, 33(3): 268-275.

