植物防御素基因家族结构、功能及调控研究进展
官丽莉 崔琪 李声钊 董程 李海龙 彭建豪 李校堃
(1. 吉林农业大学生命科学学院,长春 130118;2. 吉林农业大学生物反应器与药物开发教育部工程研究中心,长春 130118)
自然界几乎所有生物群体体内中都含有防御素,而天然防御素是由自身进行长期的抗逆斗争进化而来,并逐渐成为免疫系统必不可少的成分之一。植物防御素广泛分布在植物的根、茎、叶、果实、块茎和种子中,可抑制杀死多种病原真菌,因此可用来研制新型的杀菌剂或新型的抗生素类药物。目前,在植物防御素的结构、功能和抗真菌机制等方面都已取得了较大的研究进展,但有关于植物防御素抗肿瘤、抑制酶活、作为离子阻断剂等相关机制还值得更深入的研究。
1 植物防御素概述
1.1 植物防御素的发现与发展
1966年,Zeya等[1]首次于哺乳动物老鼠和豚鼠的多形核的嗜中性白细胞中发现了防御素,称其为“溶酶体阳离子蛋白”。1985年,Robert等[2]首次对防御素进行了定义,即用来阐述存在于人体中的嗜中性白细胞内的一类抗恶性细胞和广谱微生物的离子肽。1989年,法国学者Hoffmann等[3]对昆虫进行研究,从中分离纯化得到与兔子肺吞噬细胞防御素同源的昆虫防御素。与哺乳动物和昆虫防御素相比,植物防御素的发现相对较晚。1990年,Mendez等[4]首次从小麦、大麦种子中分离提纯并得到具有防御作用的离子肽 r1-P和 r1-H。1995年,Terras等[5]从胡萝卜种子中分离纯化得到一个长度为5 kD新的富含半胱氨酸的抗真菌蛋白家族(Antifungal Proteins,AFPs),鉴于它们的高级结构与哺乳动物、昆虫防御素类似,这种分子量较小的防御相关蛋白被正式命名为植物防御素。
最初研究表明,植物防御素只存在特定植物的种子中。但是经过十几年的研究,科学家们证实了植物防御素存在于每个植物的不同器官和组织中。研究表明植物防御素在番茄[6]、结球白菜[7]、白色芸豆[8]、甘蓝型油菜[9]等植物生长发育、生理代谢中具有重要作用。
1.2 植物防御素的结构
目前为止,植物中提取的植物防御素有数百种之多,虽然不具有完全相同的的结构,但其大体结构基本相类似。可以概括为:植物防御素是一类小型的离子多肽,包含45-54个氨基酸残基,含有半胱氨酸(Cys)稳定的αβ模序(Cysteine-stabilized alpha beta motif,Csαβ)[10](图 1),其中保守半胱氨酸残基8个,且这8个半胱氨酸形成4对二硫键,其三维结构呈小球形,包括1个α-螺旋和3个β-折叠片层结构。其中含有的4 对二硫键连接方式分别为:Cys1-Cys8、Cys2-Cys5、Cys3-Cys6和Cys4-Cys7。
随着研究进一步深入,逐渐从不同植物的花器官中发现有些植物防御素一级结构中不仅含有N端酸性信号肽,还含有额外结构域。例如,研究发现,发育中玉米籽粒防御素ZmESR6,含有额外的酸性C末端结构域。目前此附加结构域具体功能尚不清楚,但推测它在中和毒性蛋白中发挥重要作用。从最初拟南芥中提取的15种植物防御素中发现AtPDF3.1和AtPDF3.2的序列在信号肽和成熟防御素结构域之间含有富含酸性半胱氨酸的结构域,目前仍然需要确定此额外的结构域是否属于前结构域,是否潜在地参与靶向或在蛋白质合成期间起到中和潜在的毒性碱性效应物的作用。
当然也存在一些特殊结构的植物防御素,林军岳等[11]通过相关的预测软件 I-TASSER发现,手掌参植物防御素Gcthionin的二硫键排布与其他植物防御素相比有其自身的特异性,除了Cys3与 Cys47,Cys14与 Cys34,Cys24与Cys43形成3对二硫键外,两个游离巯基Cys20与Cys41未形成二硫键(图 2)。

图1 植物防御素的三级结构示意图
1.3 植物防御素的分类
1.3.1 按结构分类 虽然植物防御素的基因序列具有较高的保守性,但是总的来说组成植物防御素的氨基酸平均保守性非常差,仅限于在11位置上的芳香族残基、13位置的甘氨酸残基、29位置的谷氨酸残基。所以根据氨基酸保守性进行分类就显得不是很现实。李鑫等[12]对115种植物防御素序列进行测序发现,氨基酸序列具有较高的同源性。因此根据成熟序列差异可将防御素分为两大类,与拟南芥PDF1家族同源性较高的植物防御素被归为第一类,与拟南芥PDF2家族同源性较高的植物防御素被归为第二类。据研究,其中绝大多数植物防御素属于第二类。一些较特殊的被归为第一类,包括番茄、耧斗花中的各一个基因与蒺藜苜蓿、油菜中的多个防御素基因。

图2 Gcthionin与典型植物防御素二硫键排布的比对
1.3.2 按结构和功能结合分类 早在1998年Segura等[13]就根据植物防御素成熟序列的差异和抗真菌活性的不同,将其进行了分类。包括两大类和4个亚族,其中每大类中都包含两个亚族。因第一亚族和第二亚族具有较高同源性被归为第一大类,第三亚族和第四亚有较高同源性族被归为第二大类。第一亚族包括能致使大刀镰刀菌属(Fusarium culmorum)菌丝产生多分支且能诱导菌丝体体尖端膨大生长的植物防御素。第二亚族包含对菌丝多分枝生长无作用但能抑制大刀镰刀菌属菌体生长的植物防御素。第三亚族包含除了能抑制毛盘孢菌(Colletotrichum lagenarium)、大刀镰刀菌属等丝状真菌生长外,还能抑制格兰氏阴阳性细菌生长的植物防御素。第四亚族包含对病原体无抗真菌作用的植物防御素。
1.4 植物防御素的功能
1.4.1 抗菌作用 大部分植物防御素都具有抗真菌的作用,其抑制真菌的IC50范围为0.1 μmol/L到6.2 μmol/L(但也取决于不同真菌种类和不同来源的植物防御素)[14]。例如,胡萝卜种子植物防御素RsAFP2抑制稻瘟病菌的活性IC50仅为0.1 μmol/L就可以达到良好的效果(表1)。当然也有一部分具有抗细菌的作用但是并没有抗真菌那么强烈,其 IC50一般要达到100 μmol/L以上。
1.4.2 抗肿瘤作用 抑制肿瘤细胞增殖是植物防御素倍受人们关注的原因之一。已发现有多种植物防御素具有抗肿瘤作用,如田豆类植物防御素Sesquin对白血病细胞株L1210和M1细胞株的繁殖抑制率为80%[16]、风轮菜防御素对人Hela癌细胞株抑制率为80%[16]、利马豆中防御素Limyin对人肝癌细胞株 Bel-7402 和人胶质细胞瘤 SHSY5Y 的 IC50浓度分别是 43 μmol/L 和 28 μmol/L[17]。

表1 植物防御素抗真菌活性IC50值(μmol/L)[15]
1.4.3 抑制酶的活性 有些植物防御素是酶活性的抑制剂,如大麦植物防御素能抑制蛋白质的翻译过程;绿豆的防御素VrD1在昆虫饲料中含量为0.2%时就能抑制昆虫α-淀粉酶的活性导致昆虫消化系统受损而死亡[18];腊肠树种子防御素5459具有抑制胰蛋白酶活性的作用[19]。
1.4.4 其他活性 植物防御素还有一些其他功能,如玉米种子防御素 γ1-zeathionin 和 γ2-zeathionin 可作为离子阻断剂,能抑制哺乳动物细胞GH3的电压门钠离子通道,其抑制钠离子电流的 IC50分别是62 μmol/L 和 33 μmol/L[20];菜豆防御素 PvD1可抑制亚马逊什曼原虫的生长[21];拟南芥防御素 AhPDF1.1可增强酵母对锌的耐受性等。
2 植物防御素的抗菌机理
植物防御素可作为最直接的作用就是抗菌作用,到目前为止其抗真菌机理也较为清晰。关于抗菌机理主要有以下4种解说:(1)植物防御素与真菌特异性质膜组分相互作用(2)植物防御素被摄取并识别细胞内特异性受体(3)植物防御素活化下游信号传导途径(4)易感酵母的耐受机制和真菌物种对植物防御素活性影响[22-23](图 3)。
植物防御素可与真菌特异性质膜组分结合,导致病原菌细胞膜凹陷,嵌入细胞膜或转运到细胞膜内,进而发生一系列的生物化学变化。即植物防御素与动物防御素和昆虫防御素的抗菌机理不同,并非直接与病原体表面受体发生作用而使细胞膜的通透性改变,从而造成膜内外化学电势差的改变来达到抗菌作用[24]。如10多年前,第一份研究报道植物防御素抗菌机制是其与真菌细胞膜上的复杂的含有鞘脂的肌醇磷酸(Inositol phosphoryl-containing sphingolipids,M(IP)2C)和葡糖苷(脂)酰鞘氨醇(Glucosylceramides,GlcCer)相结合,这些鞘脂不仅是真核细胞膜的重要组成成分,还作为第二信使调节细胞生存和死亡的微妙平衡。GlcCer不仅仅分布在真菌细胞膜上,也分布在真菌细胞壁中[25],说明植物防御素也可以对细胞壁起杀伤作用。
对植物防御素杀死真菌的研究证明了GlcCer的重要作用,并证实的有5种不同的植物防御素,即烟草防御素 NaD1[26]、萝卜防御素 RsAFP2[27]、蒺藜苜蓿防御素 MsDef1[28]、禾草防御素 Sd5[29]和豌豆 防 御 素 PsD1[30]。NaD1、RsAFP2、MsDef1、Sd5和PsD1都是与细胞壁上GlcCer相结合而发挥作用,不同的是MsDef1和sd5与之结合却不被吸收,而RsAFP2、NaD1和PsD1被吸收到易感真菌的细胞质中发生一系列变化从而导致细胞质被破坏甚至细胞死亡[31],如 Aerts等[32]报道,萝卜防御素 RsAFP2与白念珠细胞GlcCer相互作用后,导致胞内活性氧ROS值升高,从而激活胞内胱天冬蛋白酶或半胱天冬蛋白酶来引起真菌细胞凋亡;芥菜防御素HsAFP1可导致胞内ROS值升高并直接诱导真菌凋亡;豌豆防御素PsD1可导致细胞周期的变化而诱导真菌凋亡(图3-A)。
同时为了保护自己免受植物防御素的影响,病毒、易感酵母和真菌会有各种各样的阻断机制。如Hs AFP1耐受基因,就可牵连MAPK通路发挥关键作用,在不同的环境中维持细胞壁完整性的作用[33]。该诱导途径在极化生长条件下(受到热、低渗透压、细胞壁损伤和氧化应激)才被激活[34]。同样,萝卜防御素RsAFP2和苜蓿防御素Ms Def1也会牵连真菌禾谷镰刀菌发挥MAPK通路,从而保护病原体细胞壁的完整性[35](图 3-B)。
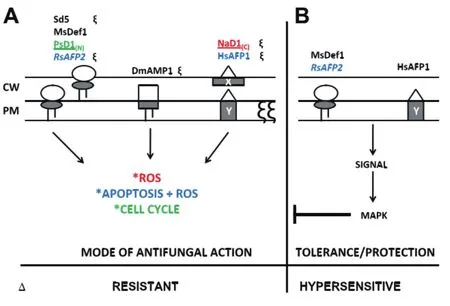
图3 植物防御素抗真菌机制和真菌耐受机制[36]
3 外源表达植物防御素的研究进展
目前真菌病原菌侵染的植物物种逐渐威胁人类健康和破坏生物多样性。受感染的主要是小麦、大豆、玉米和香蕉,导致了作物的产量下降,影响人们生活。因此,提高粮食安全和保护生物多样性成为我们追求的目标。在过去十几年中,我们发现转基因超表达的防御素在几种植物中明显增加了对真菌疾病的抗性,这也表明它们在植物中具有抗真菌的潜力。从表2中可看出大多数研究是基于植物防御异源表达研究其对病菌的抑制作用。
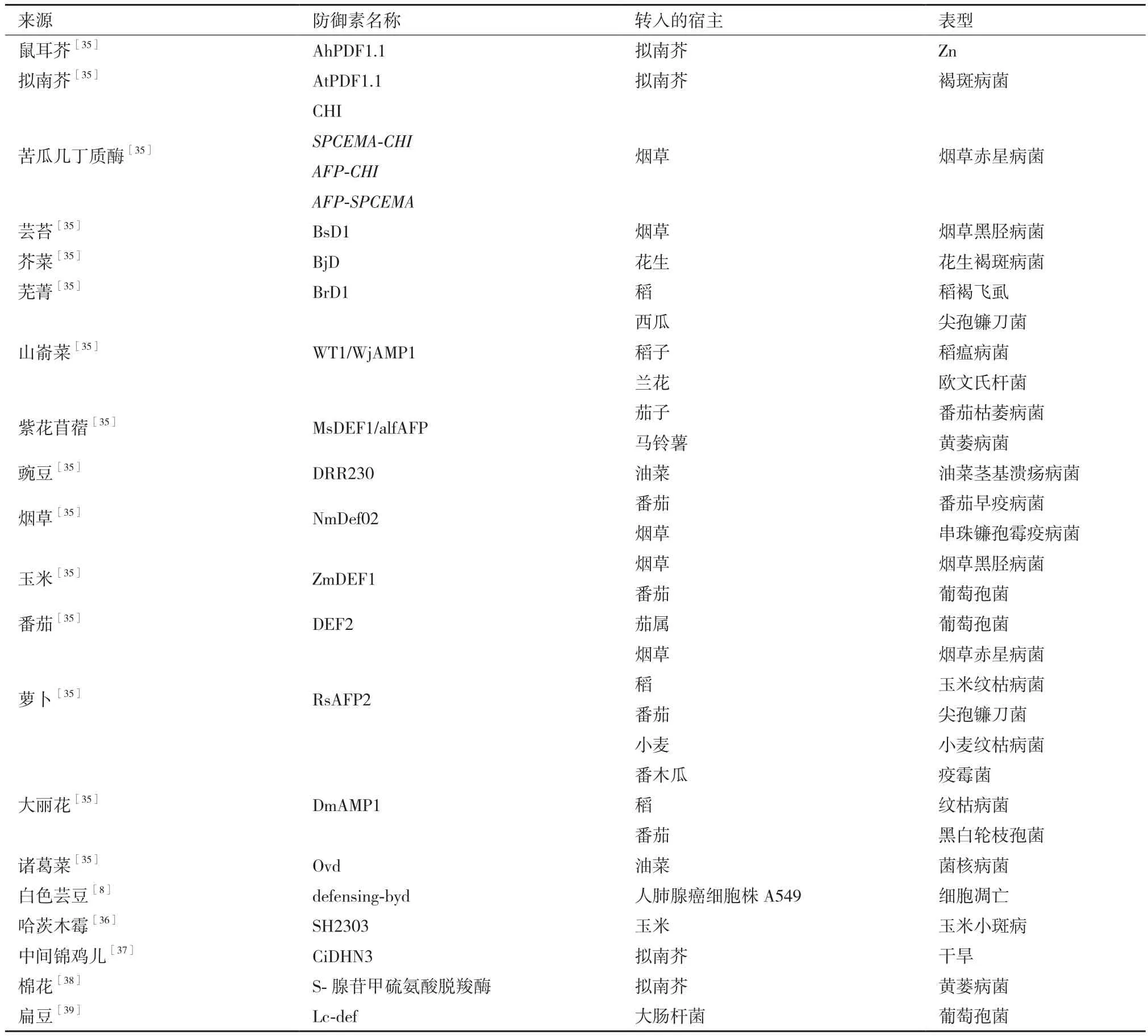
表2 外源表达植物防御素的概述
4 结语
植物防御素广泛的生物学功能具有无限的应用潜力,也必将对植物研究、生产、加工等诸多行业产生深远影响。随着对于植物防御素的研究的逐步加深、生物技术的不断进步以及生物产业的深化与改进,植物防御素的价值将会越来越多的展现。
[1]Zeya HI, Spitznagel JK. Cationic proteins of polymorphonuclear leukocyte lysosomes I. Resolution of antibacterial and enzymatic activities[J]. Bacteriol, 1996, 91:750-754.
[2]Robert L, GanT, Selsted ME, et al. Defensins natural peptide antibiotics of human neutrophils[J]. J Clin Invest, 1985, 76 :1427-1435.
[3]Hoffmann J, Keppi E, Dimarcq JL, et al. Insecimmunity isolation from immune blood of the dipteran phormiaterranovae of two insect antibacterial peptides with sequence homology to rabbit lungmacrophage bacterial peptides[J]. Proc Natl Acad Sci, 1989,86(1):262-266.
[4]Mendez E, Moreno A, Colilla F, et al. Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, gamma-hordothionin, from barley endosperm[J].Biochemistry, 1990, 194(2):533-539.
[5]Terras FR, Schoofs HM, De Bolle MF, et al. Analysis of two novel classes of antifungal proteins from radish(Raphanus sativus L.)seeds[J]. Biological Chemistry, 1992, 267(22):15301-15309.
[6]宰文珊, 叶曙光, 苗立祥, 等. 番茄全基因组防御素基因鉴定及表达分析[J]. 农业生物技术学报, 2015, 23(12):1588-1596.
[7]蒋明, 张志仙, 钱宝英, 等. 结球白菜和拟南芥防御素基因的鉴定与比较分析[J]. 植物病理学报, 2013, 43(4):368-375.
[8]刘劝, 陶永辉, 白瑞珍, 等. 白色芸豆防御素的促凋亡作用和抑制肺癌细胞株A549增殖效应[J]. 江苏医药, 2014, 40(8):884-885.
[9]高天姝, 郑小敏, 郭楠, 等. 甘蓝型油菜防御素基因的克隆与表达分析[J]. 作物学报, 2015, 41(5):725-732.
[10]Bruix M, Jimenez MA, Santoro J, et al. Solution structure of gamma1-H and gamma1-P thionins from barley and wheat endosperm determined by 1H-NMR:a structural motif common to toxic arthropod proteins[J]. Biochemistry, 1993, 32(2):715-724.
[11]林军岳. Gcthionin及其突变体的表达、纯化、抗真菌活性及作用机制研究[D]. 成都:电子科技大学, 2013:1-43.
[12]]李鑫, 侯和胜. 植物防御素基因的测序和序列分析[J]. 植物生理学通讯, 2008, 44(2):229-234.
[13]Segura A, Moreno M, Molina A, et al. Novel subfamily from spinach(Spinacia oleracea)[J]. Febs Letters, 1998, 435(2-3):159-162.
[14]朱立成, 罗辉, 任悍. 植物防御素结构与功能及其真菌机制研究进展[J]. 生物技术通报, 2014(3):9-14.
[15]Cândido EDS, Cardoso MHES, Sousa DA, et al. The use of versatile plant antimicrobial peptides in agribusiness and human health[J]. Peptides, 2014, 55(5):65-78.
[16]Anayalopez JL, Lopezmeza JE, Baizabalaguirre VM, et al.Fungicidal and cytotoxic activity of a Capsicum Chinese defensin expressed by endothelial cells[J]. Biotechnology Letters, 2006,28(14):1101-1108.
[17]Wang S, Rao P, Ye X. Isolation and biochemical characterization of a novel leguminous defence peptide with antifungal and antiproliferative potency[J]. Applied Microbiology and Biotechnology, 2009, 82(1):79-86.
[18]Chen KC, Lin CY, Kuan CC, et al. A Novel defensin encoded by a mung bean cDNA exhibits insecticidal activity against bruchid[J]. Agric Food Chem, 2002, 51(25):7258-7263.
[19]Wijaya R, neumann GM, Condron R, et al. Defense proteins from seed of Cassia fistula include a lipid transfer protein homologue and a protease inhibitory plant defensin[J]. Plant Science, 2000,159(2):243-255.
[20]Kushmerick C, Castro MS, Cruz JS, et al. Functional and structural features of γ-zeathionins, a new class of sodium channel blockers[J]. Febs Letters, 1998, 440(3):302-306.
[21]Mirouze M, Sels J, Richard O, et al. Putative novel role for plant defensins:adefensin from the zinc hyper-accumulating plant,Arabidopsis halleri, confers zinc tolerance[J]. Plant Journal,2006, 47(3):329-342.
[22]DeBrucker K, Cammue BP, Thevissen K. Apoptosis inducing antifungal peptides and proteins[J]. Biochemical Society Transactions, 2011, 39(5):1527-1532.
[23] Wilmes M, Cammue BPA, Sahl HG, et al. Antibiotic activities of host defense peptides:more to it than lipid bilayer perturbation[J]. Natural. Product. Reports, 2011, 42(49):1350-1358.
[24] Thevissen K, Terras FR, Broekaert WF. Permeabilization of fungal membranes by plant defensins inhibits fungal growth[J].Applied and Environment Microbiology, 1999, 65(12):5451-5458.
[25]Nimrichter L, Rodrigues ML. Fungal glucosylceramides:from structural components to biologically active targets of new antimicrobials[J]. Frontiers in Microbiology, 2011, 2(1):212.
[26]Thevissen K, Cammue BP, Lemaire K, et al. A gene encoding a sphingolipid biosynthesis enzyme determines the sensitivity of Saccharomyces cerevisiae to an antifungal plant defensin from dahlia(Dahlia merckii)[J]. Proc Natl Acad Sci, 2000, 97(17):9531-9536.
[27]Thevissen K, Warnecke DC, Francois IE, et al. Defensins from insects and plants interact with fungal glucosylceramides[J].Biological Chemistry, 2004, 279(6):3900-3905.
[28]Ramamoorthy V, Cahoon EB, Li J, et al. Glucosylceramide synthase is essential for alfalfa defensin-mediated growth inhibition but not for pathogenicity of Fusarium graminearum[J]. Molecular Microbiology, 2007, 66(3):771-786.
[29]Paula V, Razzera G, Medeiros L, et al. Evolutionary relationship between defensins in the poaceae family strengthened by the characterization of new sugarcane defensins[J]. Plant Molecular Biology, 2008, 68(4):321-335.
[30]Medeiros LN, Angeli R, Sarzedas CG, et al. Backbone dynamics of the antifungal Psd1 pea defensin and its correlation with membrane interaction by NMR spectroscopy[J]. Biochimica Et Biophysica Acta, 2010, 1798(2):105-113.
[31]Van NL, Lay FT, Anderson MA. The plant defensin, NaD1, enters the cytoplasm of Fusarium oxysporum hyphae[J]. Biological Chemistry, 2008, 283(21):14445-14452.
[32]Aerts AM, Gutierrez DC, Lefevre S, et al. The antifungal plant defensin RsAFP2 from radish induces apoptosis in a metacaspase independent way in Candida albicans[J]. Febs Letters, 2009,583(15):2513-2516.
[33]Aerts AM, Bammens L, Govaert G, et al. The antifungal plant defensin HsAFP1 from Heuchera sanguinea induces apoptosis in Candida albicans[J]. Frontiers in Microbiology, 2011, 2(47):47.
[34]Martin H, Flandez M, Nombela C, et al. Protein phosphatases in MAPK signalling :we keep learning from yeast[J]. Molecular Microbioogyl, 2005, 58(1):6-16.
[35]Barbara DC, Bruno PA, Karin T. Modes of antifungal action and in planta functions of plant defensins and defensin-like peptides[J]. Fungal Biology Reviews, 2013, 26(4):109-120.
[36]马佳, 王猛, 陈捷, 哈茨木霉SH2303诱导玉米抗小斑病菌研究[C]中国植物保护学会第十一次全国会员代表大会暨2013年学术年会论文集. 北京:中国植物保护协会, 2013.
[37]杨洋. 中间锦鸡儿两个逆境胁迫相关基因CiDef2和CiDHN3农业大学的克隆及表达分析[D]. 呼和浩特:内蒙古大学,2015:1-40.
[38]默辉娟, 王省芬, 张艳, 等. 棉花S-腺苷甲硫氨酸脱羧酶基因参与拟南芥黄萎病抗性[C]. 全国棉花青年学术研讨会论文汇编. 安阳:棉花学报, 2015.
[39]Zakhar O. Shenkarev, Albina K. Heterologous expression and solution structure of defensing from lentil Lens culinaris[J].Biochemical and Biophysical Research Communications, 2014, 24(7):104-108.

