一株酸奶发酵嗜热链球菌的筛选及特性研究
官雪芳,郑 怡,徐庆贤,钱 蕾,林 斌
(福建省农业科学院 农业工程技术研究所,福州 350001)
嗜热链球菌(Streptococcusthermophilus)是乳品发酵工业中重要的菌种[1],全球每年消费的嗜热链球菌乳制品市场价值约为400亿美元[2],是公认的食品级安全性菌株(Generally recognized as safe, GRAS)。该菌已被卫生部列为可用于食品的菌种名单(卫办监督发[2010]65号),同时也被列入国食药监注[2005]第202号发布的可用于保健食品的益生菌名单中,是兼具食品和保健性质的多功能益生菌。
嗜热链球菌在发酵前期可以产生风味物质双乙酰,在牛乳发酵及后熟过程中代谢产生胞外多糖[3]、细菌素和维生素[4];其代谢产生的乳酸、甲酸、CO2等物质可刺激嗜酸乳杆菌的生长[5],同时与保加利亚杆菌之间存在互生关系,在牛乳乳制品的生产中,该菌常作为引子与保加利亚乳杆菌(Lactobacillusbulgaricus)、瑞士乳杆菌(Lactobacillushelveticus)混合发酵生产酸奶以提高发酵乳品质、风味[6]及营养价值。
在热及低温杀菌的乳制品中能发现嗜热链球菌的存在,有些驯化菌能够在人体内耐受胃酸和胆盐,并且可抑制肠道致病菌[4,7-8],有利于肠道有益菌群的建立;同时可通过菌体同化作用、吸收和吸附、有机酸产物代谢等方式对胆固醇起到很好的降解作用[9-11];此外,该菌还可在牛乳中生长时将无色的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)还原为红色三苯甲瓒而作为指示菌, 有利于牛乳中抗生素的残留检测[4]。
酸奶的风味及营养价值与使用的乳酸菌种类密切相关,获得优质的乳酸菌菌种是发酵调配优质酸奶最核心的技术,因此筛选优质的酸奶发酵乳酸菌菌种一直是研究的热点。基于嗜热链球菌的以上特性,本研究致力于筛选能单独发酵或与实验室自有的酸奶发酵菌植物乳HLX37混合发酵生产酸奶的嗜热链球菌,为提高酸奶的品质、风味及益生价值提供新的发酵菌源。
1 材料与方法
1.1 材 料
福建省农业科学院农业工程技术研究所微生物能源与环保实验室自然发酵产生的具有酸奶风味的酸奶发酵液,鲜牛奶(福建长富乳业集团)。
1.2 主要试剂和仪器
细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司)。引物F(9-27)、R1525-1542(上海生工生物工程有限公司),2×TaqPCR Master Mix(天根生化科技(北京)有限公司),Eppendorf AG PCR仪器(艾本德中国有限公司),Cary-50型紫外可见分光光度计(美国瓦里安技术中国有限公司),YS100型显微镜(尼康仪器(上海)有限公司),JSM-6380LV扫描电镜(日本电子公司),Alphalmager EP凝胶成像系统(Alpha innotech Corporation),Neofuge 15R台式高速冷冻离心机(力康发展香港有限公司),生化培养箱(上海新苗医疗器械制造有限公司),QYC-200型恒温摇床(上海新苗医疗器械制造有限公司),SW-CJ-1F超净工作台(苏净集团苏州安泰空气技术有限公司),酸奶发酵机(北京日创电器有限公司),HT7700透视电镜(日立高新技术公司)。
1.3 培养基制备
MC培养基(1 L):大豆蛋白胨5.0 g,牛肉粉3.0 g,酵母粉3.0 g,葡萄糖20.0 g,乳糖20.0 g,碳酸钙10.0 g,琼脂20.0 g,中性红0.05 g。制法:将前面7种成分加入蒸馏水中,加热溶解,调节pH至6.0,加入中性红混合均匀,定容至1 L,分装后121 ℃高压灭菌20 min。固体培养基在这基础上加琼脂粉20.0 g。
鲜牛奶:115 ℃高压灭菌 20 min。
LB培养基(1 L):胰蛋白胨 10.0 g,氯化钠 10.0 g,酵母浸出汁 5.0 g,琼脂 20.0 g, pH调至7.5。
1.4 乳酸菌的筛选
参照中华人民共和国国家标准(GB 4789.35-2010)中嗜热链球菌计数法,采用MC培养基为筛选培养基,以自然发酵酸奶为样品,从中吸取1 mL 自然发酵乳,分别稀释10-5、10-6、10-7次方,各取0.1 mL涂布于含有MC固体培养基的平板上,待稀释液被平板吸收后,采用限制高温生长方法[12],50 ℃倒置培养24 h,挑选出疑似嗜热链球菌的暗红色单菌落,分别在MC固体平板上划线纯化培养3次,同时各挑一单菌落于MC液体培养基中42 ℃静置培养24 h,各取1 mL发酵菌液,分别接种入100 mL的鲜奶中,42 ℃发酵24 h,以鲜奶发酵凝固成固体并产生清香味为指标,挑选出达到这一指标的菌种,保存。继续将菌株分别接入鲜奶中反复接种,于42 ℃发酵培养5次,观察鲜奶发酵凝固成固体所需的时间,同时感官评价发酵酸奶的风味口感,挑选出1株能在42 ℃发酵10 h时使鲜奶发酵凝固成固体酸奶、风味口感最佳的疑似嗜热链球菌菌株,保存并命名为LCM46。
1.5 菌株LCM46的鉴定
1.5.1 菌株的形态观察 对菌体进行菌落形态观察、电子显微镜观察菌体革兰氏染色形态、JSM-6380LV扫描电镜及HT7700透视电镜观察菌体形态。
1.5.2 生理生化特征的鉴定 参照《伯杰细菌系统鉴定手册》(第8版)[12]。
1.5.3 16S rDNA序列分析 细菌基因组DNA的提取:采用TIANGEN公司的细菌基因组DNA提取试剂盒提取。16S rDNA序列的PCR扩增及测序:扩增16S rDNA基因,所用引物为F(9-27):5′-GAGTTTGATCCTGGCTCAG-3′;R1525-1542:5′-AGAAAGGAGGTGATCCAGC- C-3′。 PCR反应体系:2×Mix 12.5μL,引物及DNA各1.0 μL,ddH2O 9.5 μL。PCR扩增程序: 93 ℃预变性4 min;94 ℃变性30 s,56 ℃退火45 s,72 ℃延伸90 s,共30个循环;最后72 ℃充分延伸10 min,4 ℃保存。扩增产物克隆后进行序列测定,测序委托铂尚生物技术(上海)有限公司完成。
1.5.4 PCR产物检测及测序分析 取5 μL的PCR产物,在加入EB的0.01 g/mL琼脂糖凝胶中电泳分离,将含有目标片段的产物测序。将测得的序列提交到GenBank数据库中,同时在该数据库进行同源性分析。
1.5.5 系统发育分析 将测得的16S rRNA序列用NCBI的Blast程序进行序列同源性比对,用MEGA 4.1软件中的Maximum Parsimony方法构建基于16S rRNA序列的系统发育树。
1.6 菌株LCM46微生物学特性研究
嗜热链球菌母液制备:取φ=20%甘油保存的LCM46 100 μL接种于100 mL的MC液体培养基中,37 ℃发酵培养24 h,制成菌种母液,备用。
1.6.1 最适酸奶发酵时间的测定 取嗜热链球菌母液(下同)1 mL接种于含100 mL鲜牛奶(含0.08 g/mL蔗糖,105 ℃高压灭菌40 min)的发酵瓶中,置于酸奶机中42 ℃分别静置发酵10、11、12、13、15、17、34 h,制成酸奶制品,测定酸奶酸度(滴定法:GB5409-85)及嗜热链球菌落数。
1.6.2 生长曲线测定 取嗜热链球菌母液各100 μL分别接种于75管装有10 mL MC液体培养基的试管中,37 ℃静置发酵培养,以未接菌的培养基为对照,分别在发酵后1~96 h的不同时间段内取3管测定菌体OD600值。
1.6.3 最适发酵温度的测定 取嗜热链球菌母液各100 μL分别接种于装有10 mL MC液体培养基的试管中,于10、20、30、40、50和60 ℃静置发酵培养24 h,测定发酵液OD600,依据以上结果,以同样的方法,设计温度32.5、35、37.5、40.0和42.5 ℃,获得精确的最适发酵温度。
1.6.4 最适发酵pH的测定 取嗜热链球菌母液各100 μL分别接种于装有10 mL不同pH的MRS液体培养基的试管中,37 ℃静置发酵培养24 h,测定发酵液OD600值。
1.6.5 耐酸测定 取LCM46母液1 mL接种菌种于不同pH(pH梯度为2.5、3.0、3.5、4.0、4.5、5.0) 的10 mL MC液体培养基,42 ℃分别培养0、2、4 h,每一处理3个重复。各取1 mL样品菌液于9 mL生理盐水中混匀,制备10-3个稀释度溶液,取0.1 mL稀释液于MC中涂布, 42 ℃ 倒置培养48 h(每个处理3个平行),计算平板上的菌数。
1.6.6 菌株的黏附能力测定 培养嗜热链球菌(MC液体培养基)、大肠杆菌DH5α(LB液体培养基)24 h得发酵液,分别于3 000 r/min、4 ℃下离心10 min,收集菌泥,依次用pH 7.0的无菌磷酸盐缓冲液(PBS)洗涤菌泥2次(即在菌落中加入PBS,震荡混合均匀后,置于3 000 r/min、4 ℃下离心10 min,收集菌体)。自凝集率:用无菌的PBS将菌泥HLX37制成在波长600 nm处的吸光值为0.4±0.1(A0)的悬浮菌液,静置24 h后测定吸光值A24,自凝集率=(A0-A24)/A0×100%。他凝集率:将HLX37和大肠杆菌DH5α的悬菌液调节成在波长600 nm处的吸光值为0.6±0.1(A0)的混合悬浮菌液。静置24 h后测定吸光值A24,他凝集率=(A0-A24)/A0×100%。
2 结果与分析
2.1 疑似嗜热链球菌的获得
在50 ℃ MC固体培养基平板上,挑选出疑似嗜热链球菌的暗红色单菌落15个,其中能在42 ℃发酵24 h使鲜奶发酵凝固成固体并产生清香味的菌株有5株,反复接种5次后,最终挑选出1株能在42 ℃发酵10 h时使鲜奶发酵凝固成固体酸奶、通过感官品评获得的风味口感最佳,产生酸奶质地粘稠的乳酸菌菌株,保存并命名为LCM46。
2.2 菌种的鉴定
2.2.1 菌株LCM46的形态观察 LCM46菌株的主要形态特征如下:菌落圆,光滑,在MC培养基上呈暗红色、不透明,革兰氏阳性,菌体椭圆,宽0.7~0.9 μm,长0.8~1.9 μm,成对到长链(图1)。
2.2.2 生理生化特征的鉴定 LCM 46菌株生理生化特征见表1,具体为:VP试验、淀粉水解试验和奈试产氨试验呈阳性, MR、过氧化氢试验、明胶试验和吲哚试验显示阴性,说明该菌能分解利用大分子含氮物质,能产生淀粉酶将淀粉水解为糖类物质,能将葡萄糖分解产生丙酮酸,不能利用明胶。能发酵利用α-乳糖、葡萄糖、蔗糖产酸、不产气;不能利用麦芽糖、D-果糖。

A.菌落形态图 Colony characteristics inoculated in MC medium;B.革兰氏染色图 Gram staining;C.扫描电镜图谱 Scanning electron microscopy(SEM);D.透视电镜图谱 Transmission electron microscope(TEM)
图1菌株LCM46的形态
Fig.1ColonycharacteristicsandmorphologyofLCM46strain

表1 LCM46菌株的生理生化特征Table 1 Morphological and physiological characteristics of LCM46 strain
注: + 阳性;- 阴性。
Note:+. Positive; -. Negative.
2.2.3 LCM46菌的分子生物学鉴定 对菌株LCM46的16S rDNA序列PCR扩增产物进行琼脂糖凝胶电泳(图2),并测序获得该序列长度为1 416 bp,在NCBI数据中对该序列进行Blast比对分析,得到序列Streptococcusthermophilus的序列同源性为100%,采用 MEGA 5.2中的Neighbor-joining进行发育树的构建分析(图3),菌株LCM46与Streptococcusthermophilus对应遗传距离最近,结合形态观察和生理生化试验,确定菌株LCM46即为嗜热链球菌(Streptococcusthermophilus),序列在GenBank中申请得到的登录号为KR105939。
2.3 LCM46特性研究
2.3.1 LCM46菌最适酸奶发酵时间 由图4可知:经菌LCM46发酵后,发酵乳的酸度最高上升至(90.65±0.17)°T,发酵到11 h时,酸度为(80.77±0.17)°T,此时的发酵乳酸甜适宜,质地稳定,口感脆嫩,无乳清析出,散发出清淡的酸奶清香味,酸奶质量最佳。此时的菌落数为(11.71± 0.20)×108cfu/mL,当发酵到17 h时,菌落数达到最大值(34.00± 0.02)×108cfu/mL,酸度亦达到(89.36±0.17)°T,之后随着发酵时间的延长,菌落数迅速下降。

图2 菌的PCR扩增片段图谱Fig.2 The agarose electrophoresis of 16S rDNA PCR product

图3 菌株LCM46的系统发育树图谱Fig.3 Phyogenetic tree of LCM46 strain based on 16S rDNA sequences homology

图4 发酵时间对酸奶酸度及菌落数影响Fig.4 Effect of fermentation time on acidity and number of LCM46 in fermented milk
2.3.2 LCM46生长曲线 由图5可知:菌LCM46发酵到2 h时进入对数生长期,发酵到12 h 时进入稳定期,此时菌体OD600值为0.55±0.00。
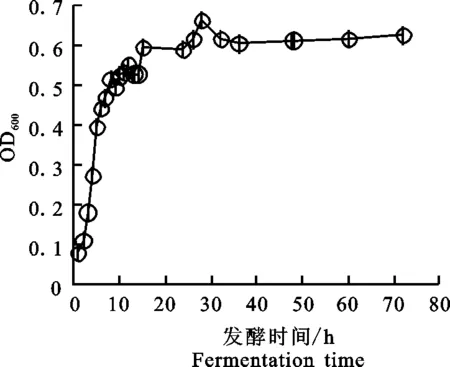
图5 菌株LCM46生长曲线Fig.5 The growth curve of LCM46 strain
2.3.3 LCM46最适发酵温度 由图6可知:菌株LCM46最适发酵温度为40 ℃,菌体OD600值为0.85±0.09,发酵到60 ℃时菌的OD600值降到0.17±0.01,说明该菌能在50 ℃的高温时生长,耐受温度亦达到60 ℃。
2.3.4 LCM46最适发酵pH 由图7可知:LCM46菌最适发酵初始pH为6.0,菌体OD600值为0.89±0.01,当初始pH小于4.3或大于7.5时,菌的OD600值均低于0.1,处于停滞生长状态,说明该菌适合生长的初始pH为4.3~7.5。MC培养基经LCM46发酵后,发酵菌液pH下降至3.8~5.0。说明菌LCM46具有一定的产酸能力。

图6 温度对菌LCM46生长的影响Fig.6 Effect of temperature on the growth of LCM46 strain
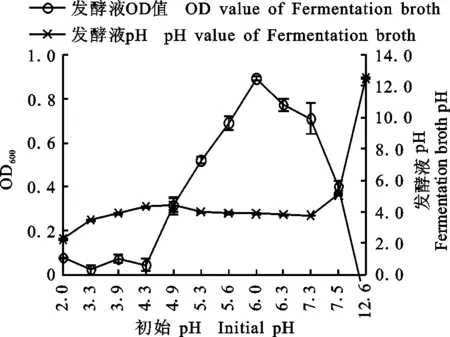
图7 初始pH对菌株LCM46生长的影响Fig.7 Effect of initial pH on the growth of LCM46 strain

图8 LCM46耐酸能力Fig.8 Acid resistant ability of LCM46 strain
2.3.5 LCM46耐酸能力 从图8可知:随着处理时间的增加及所处pH环境的下降,菌落数呈下降趋势,当pH≤4.5时,存活率均低于100%,当低于3.0时,菌不能生长;在临界pH=3.5,培养4 h后,菌落为(0.87±0.03)×105cfu/mL,存活率达63.04%±3.01%。 说明该菌有一定的耐酸能力,但酸的作用对菌的生长影响显著。
2.3.6 菌株HLX37的黏附能力 从表2可知:菌LCM46的自凝集率为19.28%,对大肠杆菌DH5α的凝集率为12.32%,黏附能力较差。

表2 菌株LCM46黏附能力Table 2 Adhesive ability of LCM46 strain
3 讨 论
在50 ℃的筛选条件下,采用MC培养基为筛选培养基,从自然发酵酸奶中获得1株能发酵产生优质酸奶的疑似嗜热链球菌,命名为LCM46,经形态学观察、生理生化特征鉴定、16S rDNA基因序列测定及系统发育树同源性分析,鉴定为嗜热链球菌(Streptococcusthermophilus),该菌最适发酵温度为40 ℃,耐受温度可达到60 ℃。说明采用MC为嗜热链球菌条件筛选培养基并配合高温条件筛选法比较容易获得嗜热链球菌菌种。
嗜热链球菌属于链球菌属(Streptococcus),本研究获得的嗜热链球菌LCM46对数生长期为2~12 h,最大OD600只有0.55,但在以牛乳为基质的发酵乳中,LCM46发酵到口感最佳状态菌落数可达到(11.71±0.20)×108cfu/mL,当发酵到17 h时,菌落数达到最大值,说明牛乳是该菌最适合生长的基质,而MC只适合作为嗜热链球菌的条件筛选培养基;测定菌LCM46最适发酵pH为6.0,适合生长初始pH为4.3~7.5,低于4.3时处于停滞生长状态,处在这一酸性环境下的时间越长,菌的致死率越大,在低于3.0时,处理2 h即可全部致死。因此,在牛乳发酵中由于大量的乳糖被发酵产生乳酸等酸性物质,使得发酵乳的酸度大大提高,在发酵到34 h时,发酵乳酸度已达到(89.36± 0.17)°T(测得的pH为3.5左右),菌落数只有(0.18±0.06)×108cfu/mL,存活率仅为0.53%,但依然超过活菌发挥功能特性的菌数临界值(106cfu/mL)[13],在应用该菌生产发酵乳时,为避免影响活菌的数量,发酵的时间不宜过长,发酵乳的酸度不宜过低。
检测菌LCM46的自凝集率和对大肠杆菌DH5α的凝集率分别为19.28%和12.32%,虽然黏附能力不强,产生的细胞蛋白有限,益生菌效果受到一定影响[14],但这一特性使得产生的发酵乳质地脆嫩,和高黏附力的菌种混合发酵生产的发酵乳有希望大大改善高黏附产生的质地粘稠的性状。
Reference:
[1] SIEEWERTS S,MOLENAAR D,BEFTHUZYEN M.Mixed-culture transcriptome analysis reveals the molecular basis of mixed-culture growth inStreptococcusthermophilusandLactobacillusbulgaricus[J].AppliedandEnvironmentalMicrobiology,2010,76:7775-7784.
[2] BOLTIN A,QUINQUIS B,RENAULT P,etal.Complete sequence and comparative genome analysis of the dairy bacteriumStreptococcusthermophilus[J].NatureBiotechnology,2004,22(12):1554-1558.
[3] 陈世贤,高鹏飞,张兴昌,等.不同球杆菌比例的发酵剂对发酵乳品质的影响[J].乳业科学与技术,2014,37(1):11-15.
CHEN SH X,GAO P F,ZHANG X CH,etal.Effect of starters consisting of different proportions ofStreptococcusthermophilestoLactobacillusdelbruechiisubsp.bulgaricuson the quality of fermented milk[J].JournalofDairyScienceandTechnology,2014,37(1):11-15.
[4] 李增魁,黄文明,卓 玛.嗜热链球菌的分离鉴定及牛乳样中抗菌药物残留的检测[J].动物医学进展,2012,33(8):127-130.
LI Z K,HUANG W M,ZHUO M.Isolation and identification ofStreptococcusthermophilesand detection of the antimicrobial residues in cow milk samples[J].ProgressinVeterinaryMedicine,2012,33(8):127-130.
[5] 赵瑞香,孙俊良,于 涛,等.嗜酸乳杆菌与嗜热链球菌共发酵互生机理的研究[J].生物技术,2005,15(3):28-31.
ZHAO R X,SUN J L,YU T,etal.Study on the symbiotic mechanism ofLactobacillusacidophilusandStreptococcusthermophillusfermented together[J].Biotechnology,2005,15(3):28-31.
[6] SMIT G,SMIT B A,EENELS W J M.Flavour formation by lactic acid bacteria and biochemical flavor profiling of cheese products[J].FEMSMicrobiologyReviews,2005,29(3):591-610.
[7] HA CH,SWEARING B,JEON Y K,etal.Effects of combined exercise on HOMA-IR,HOMA b-cell and atherogenic index in Korean obese female[J].SportSciencesforHealth,2015,11:49-55.
[8] ZIELINSKA D,RZEPKOWSKA A,RADAWSKA A,etal.In vitro screening of selected probiotic properties ofLactobacillusstrains isolated from traditional fermented cabbage and cucumber[J].CurrentMicrobiology,2015,70:183-194.
[9] 程秀芳,王丛丛,谷 巍.体外降胆固醇乳酸菌的筛选及其作用机制研究[J].现代预防医学,2013,40(13):2511-2514.
CHENG X F,WANG C C,GU W.Screening and cholesterol-degrading mechanism ofLactobacillusin vitro[J].ModernPreventiveMedicine,2013,40(13):2511-2514.
[10] SHOBHARANI P,HALAMI P M.In vitro evaluation of the cholesterol-reducing ability of a potential probioticBacillusspp[J].AnnalsofMicrobiology,2015,Doi:10.1007/s13213-015-1146-6.
[11] 李 昵,苏国成,周常义,等.降胆固醇乳酸菌的应用及其机理研究进展[J].中国微生态学杂志,2012,24(5):460-464.
LI N,SU G CH,ZHOU CH Y,etal.The progress in research on the application and mechanism of Lactic acid bacteria in reducing cholesterol[J].ChineseJournalofMicroecology,2012,24(5):460-464 .
[12] HOLT J G,KEIEG N R,SNEATH P H A,etal.Bergey’s Manual of Deteminative Bacteriology[M].8th ed.Maryland:Williams&Witkins Baltimore,1994:677-695.
[13] 汪 川,张朝武,刘益山,等.从人胃肠道源乳杆菌株中初步筛选耐酸耐胆盐优良株[J].中国微生态学杂志,2006,18(1):19-20.
WANG CH,ZHANG CH W,LIU Y SH,etal.ScreeningLactobacillusstrains having distinct acid and bile salt resistance from human gastrointestinalLactobacillus[J].ChineseJournalofMicroecology,2006,18(1):19-20.
[14] NAVATTE W W,SCHNEEWIND O.Surface proteins of gram-positive bacteria and mechanisms of their targeting to the cell wall envelope[J].MicrobiologyandMolecularBiologyReviews,1999,63(1):174-229.

