3,5-二硝基水杨酸法测定发酵型果露酒中总糖含量
杨 宁,王伟明,姚 琳,董 坤
(黑龙江省中医药科学院 中药研究所,黑龙江 哈尔滨 150036)
果露酒是果酒和露酒的统称。果酒是指除葡萄外采用其他水果为原料,经浸泡法、发酵法或浸泡结合发酵法酿制而成的低酒精度饮料[1]。露酒是指以蒸馏酒、发酵酒或食用酒精为酒基,食品添加剂作为呈味、呈香、呈色物质,按一定生产工艺加工而成的饮料[2],果露酒集文明、保健、营养、时尚于一体[3-4],因此人们对其的需求不断地提高。果露酒的总糖含量是影响其质量和区分种类的重要指标之一[5]。
目前,总糖的测定方法有滴定法、比色法和连续流动分析法,短波近红外光谱技术等新型的技术方法[6]。实验室常规的检测方法是滴定法和比色法。直接滴定法对酒液中总糖含量、滴定条件、滴定速度等都有要求,且实验人员操作熟练程度对结果影响也很大[7-9],况且果露酒酒体颜色较深,滴定时酒液消耗大,滴定终点受干扰肉眼很难判定。3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)比色法是半微量定糖法,杂质干扰较少,且操作简便快速,适宜批量检测,可用于果露酒产品研发过程和成品的总糖测定[10]。
本实验的原理是在氢氧化钠或丙三醇的的存在下,还原糖能将3,5-二硝基水杨酸(DNS)中的硝基还原成氨基,生成氨基化合物,此化合物在过量的氢氧化钠碱性溶液中呈橘红色。本实验利用盐酸将果露酒中总糖水解为还原糖,在一定波长下具有最大吸收,并且吸光度与还原糖含量存在线性关系从而计算总糖含量[11]。因此本研究考察波长、显色剂加量、沸水浴加热时间、显色时间等总糖水解液的检测条件,采用正交试验筛选最佳的果露酒总糖的水解条件,建立DNS法检测果露酒中总糖含量的方法,以期为此发酵型果露酒的实际研发生产和质量标准提供参考依据。
1 材料与方法
1.1 材料与试剂
发酵型果露酒:由黑龙江省中医药科学院中药研究所提供;D-无水葡萄糖对照品(含量≥99.06%,色谱纯):成都瑞芬思生物科技有限公司;3,5-二硝基水杨酸(化学纯):国药集团化学试剂有限公司;酒石酸钾钠、苯酚、盐酸、氢氧化钠、无水亚硫酸钠(均为分析纯):天津市科密欧化学试剂有限公司;超纯水:由DZG-303A艾科浦超纯水机制得。
1.2 仪器与设备
US/VIS Lambda 365紫外可见分光光度仪:美国Perkin Elmer公司;BSA224S-CW万分之一电子天平:德国Sartorius公司;HWS24电热恒温水浴锅、DHG9140A电热鼓风干燥箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 溶液的配制
DNS试剂的配制[12]:称取18.2 g酒石酸钾钠、0.63 g 3,5-二硝基水杨酸、2.1gNaOH、0.5g苯酚、0.5g无水Na2SO3,分别加少量超纯水溶解,将酒石酸钾钠溶液放于45℃水浴锅,然后依次加入上述溶解好的试剂,边加边搅拌,取出后冷却至室温,加超纯水定容至100 mL,贮存于棕色瓶内,暗处保存,一周后使用。
葡萄糖标准溶液的配制[13-14]:精密称取100 mgD-无水葡萄糖对照品,用超纯水定容至100 mL容量瓶中,摇匀,配制成1 mg/mL的葡萄糖对照品溶液备用。
1.3.2 检测条件的优化
检测波长考察:取3支25 mL具塞比色管编号分别为A、B、C。A:精密吸取1 mg/mL葡萄糖对照品溶液1 mL,分别加入1 mL超纯水、1 mL显色剂(DNS试剂);B:精密吸取2 mL超纯水,加1 mL显色剂。A、B比色管置于沸水浴中反应5 min,迅速冷却至室温,摇匀,定容至刻度,显色15 min;C:取25 mL果露酒酒液原样至比色管。A、B、C三组以空白超纯水作参比,在波长400~650 nm范围内进行光谱扫描,每隔20 nm采集吸光度值。分析光谱扫描图,根据“吸收最大,干扰最少”的原则选择最佳的波长作为检测波长。
DNS法显色条件的考察:于25 mL容量瓶中分别加入1 mL 1 mg/mL葡萄糖溶液、1 mL超纯水,考察显色剂添加量(0.5 mL、1.0 mL、1.5 mL、2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0mL)、沸水浴加热时间(1min、3min、5min、7min、9min、11 min、13 min、15 min)、显色时间(5 min、15 min、20 min、25 min、30 min、35 min、40 min)在波长540 nm处检测吸光度值。
1.3.3 果露酒中总糖水解条件考察
只有果露酒中的糖类充分水解,总糖含量测定结果才准确,影响水解的因素主要有水解时间、水解温度、酸的种类和添加量。本实验选择浓盐酸与超纯水按照体积比1∶1稀释后的盐酸溶液作为水解酒液糖类的酸,试验考察的因素为水解时间、水解温度及1∶1(V/V)盐酸添加量3个因素。在GB/T 15038—2006《葡萄酒、果酒通用分析方法》[15]水解条件(水解温度:68℃;水解时间:15 min;1∶1(V/V)盐酸加量:5 mL)的基础上,设计一个L9(33)3因素3水平的正交试验,正交试验设计因素水平见表1。

表1 水解条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for hydrolysis conditions
1.3.4 总糖含量计算方法
果露酒中总糖含量(以葡萄糖计)计算公式如下:

式中:C为葡萄糖标准回归方程计算所得果露酒中葡糖糖的质量浓度,mg/mL;V1为测定时吸取原酒液的体积,mL;V2为酒液稀释定容的体积,mL;0.9为以葡萄糖计算酒液总糖含量的换算系数。
2 结果与分析
2.1 检测条件优化结果分析
2.1.1 检测波长的选择
根据1.3.1节的操作方法将A、B、C组(分别为对照品+显色剂+水组、显色剂+水组、原酒液组)分别在波长400~650 nm范围内进行光谱扫描,每隔20 nm采集吸光度值,结果如图1。

图1 光谱扫描结果Fig.1 Spectral scanning results
由图1可知,A组:在波长460~650 nm范围内吸光度值持续减小,在波长460 nm处吸光度值最大。B组:在波长540~650 nm范围内光谱曲线与基线几乎重合,在波长400~540 nm范围内吸光度值急剧下降,在波长440 nm处值达最大;A、B两组在波长400~520 nm范围内曲线波动均较大,吸光度值不稳定。C组:在波长400~650 nm范围内吸光度值呈平稳下降趋势。综合考虑,选择原酒液色素吸光度值较小,显色剂吸收较小,对照品吸收较大且平稳的波长作为检测波长。因此最终选择540 nm为检测波长。
2.1.2 显色剂添加量的选择
为既能使显色剂与溶液充分反应,又避免显色试剂浪费,特选择最佳显色剂添加量,考察添加显色剂0.5~4.0mL对葡萄糖溶液在波长540 nm处吸光度值的影响,检测结果如表2。
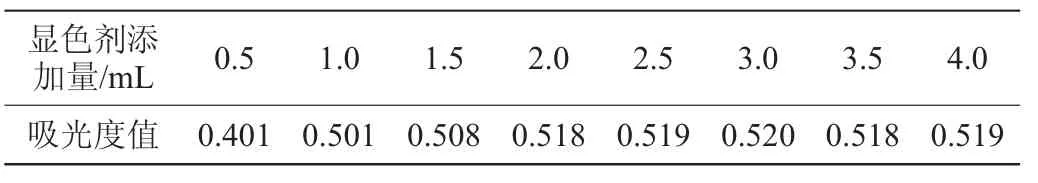
表2 显色剂添加量对葡萄糖溶液吸光度值的影响Table 2 Effect of color developing agent addition on the absorbance value of glucose solution
由表2可知,显色剂添加量在0.5~3.0 mL范围时,吸光度值逐渐增大;在3.0~4.0 mL范围时,吸光度值基本不变;显色剂添加量为3.0 mL时,葡萄糖对照品溶液的吸光度值达到最大,因此显色剂添加量选择3 mL。
2.1.3 沸水浴加热时间的选择
考察沸水浴加热时间对葡萄糖溶液在波长540 nm处吸光度值的影响,结果如表3所示。由表3可知,当沸水浴加热时间为1~9 min时,溶液的吸光度值不断增大;当沸水浴加热时间为9~15 min时,吸光度值略有减小;当沸水浴加热时间为9 min时,吸光度值达最大,因此确定沸水浴加热时间为9 min。

表3 沸水浴加热时间对葡萄糖溶液吸光值的影响Table 3 Effect of boiling water bath heating time on the absorption value of glucose solution
2.1.4 显色时间的选择
考察显色时间对葡萄糖溶液在波长540 nm处吸光度值的影响,结果如表4所示。由表4可知,吸光度值在0~40 min内变化不明显,当显色时间为20 min时,吸光度值相对较稳定,为保证显色的充分和稳定,选择显色20 min时测定吸光度值。

表4 显色时间对葡萄糖溶液吸光度值的影响Table 4 Effect of color developing time on the absorbance value of glucose solution
2.2 标准曲线的绘制与结果分析
在确定了最佳的检测条件后,进行葡萄糖标准曲线的绘制。精密吸取0.2mL、0.4mL、0.6mL、0.8mL、1.0mL1.3.1节已配制好的1 mg/mL的葡萄糖对照品溶液,分别加入至25 mL具塞比色管中,各加水至2 mL,另加3 mL显色剂,于沸水浴中加热9 min,立即冷却至室温,定容至刻度,显色20 min于波长540 nm处,超纯水为空白作参比检测吸光度值,以葡萄糖质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,结果如图2所示。由图2可知,葡萄糖标准曲线回归方程为:y=0.867 5x-0.051 9,线性相关系数R2=0.999 8,表明葡萄糖溶液在0.2~1.0 mg/mL质量浓度范围内与吸光度值呈现良好的线性关系。

图2 葡萄糖标准曲线Fig.2 Standard curve of glucose
2.3 总糖水解条件优化结果与分析
精密吸取10 mL稀释50倍的酒液于100 mL容量瓶中,采用正交试验设计对总糖水解条件进行优化,正交试验结果见表5,方差分析见表6。
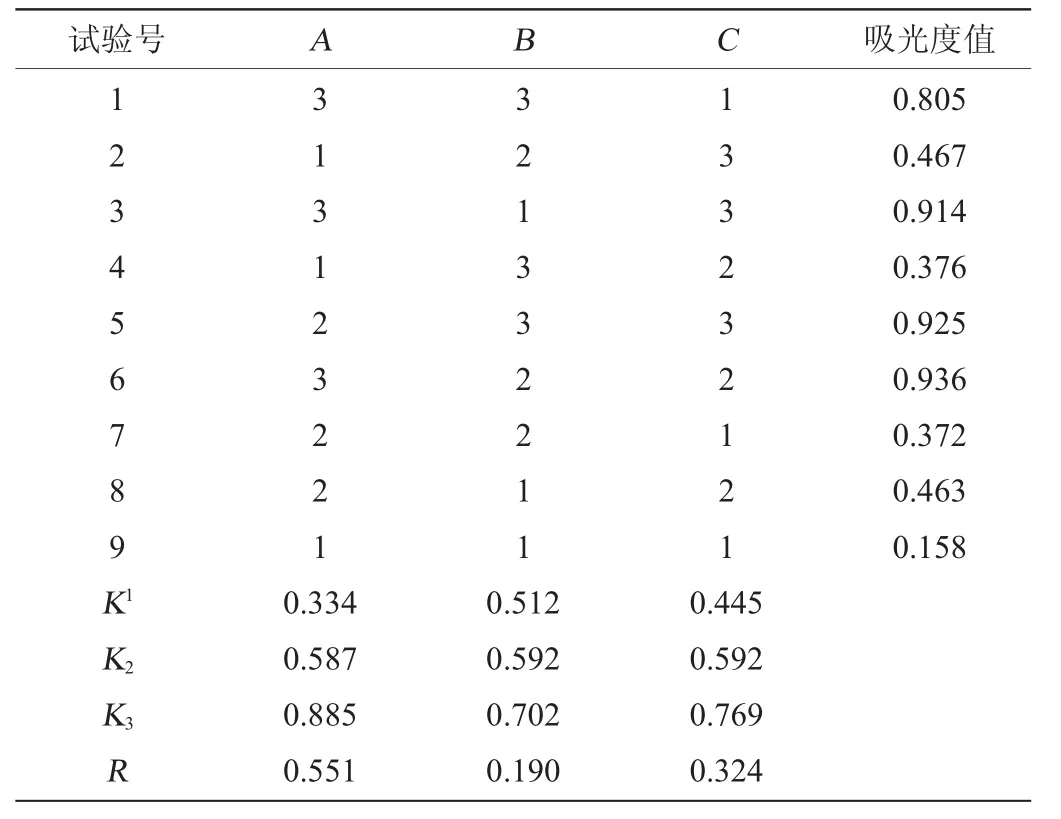
表5 水解条件正交试验结果与分析Table 5 Results and analysis of orthogonal experiments for hydrolysis conditions optimization
由表5可知,极差分析结果表明,对吸光度值的影响大小依次为A>C>B,即水解温度>1∶1(V/V)盐酸添加量>水解时间。果露酒总糖的最佳水解条件为A3B3C3,即水解温度80 ℃、水解时间20 min、1∶1(V/V)盐酸添加量7 mL。
由表6可知,水解温度对结果的影响较为显著(P<0.05);其他因素对结果均无显著性影响(P>0.05)。

表6 正交试验结果方差分析Table 6 Variance analysis of orthogonal experiment results
2.4 方法学考察
2.4.1 精密度试验
取同批次稀释50倍的果露酒液1份,按上述确定的检测条件和水解条件在波长540 nm处连续测定6次吸光度值。测定结果分别为0.776、0.777、0.780、0.778、0.779、0.778,计算相对标准偏差(relative standard deviation,RSD)值为0.18%<2%,说明仪器精密度良好。
2.4.2 重复性试验
取5份同批次稀释50倍的果露酒液,按上述确定的条件同时测吸光度值,检测结果为0.764、0.768、0.770、0.766、0.768,RSD值为0.30%<2%,说明DNS法测定果露酒中总糖含量重复性良好。
2.4.3 稳定性试验
取1份同批次稀释50倍的果露酒液,分别放置20 min、30 min、40 min、50 min、60 min时,根据已确定的检测条件,检测吸光度值,检测结果为0.772、0.774、0.780、0.782、0.783,RSD值为0.63%<2%,表明使用DNS法测定果露酒总糖含量在60 min内稳定性良好。
2.4.4 加标回收率试验
精密吸取稀释50倍的果露酒多糖水解液3份各0.5 mL,分别加入3份不同体积的1.0 mg/mL葡萄糖溶液,进行加标回收率试验[16],按照上述确定的检测条件测定吸光度值,计算回收率及RSD值,结果如表7所示。由表7可知,总糖含量检测结果的回收率在98.00%~99.17%,平均回收率为98.53%,RSD值为0.50%<2%,表明该方法具有良好的准确度。
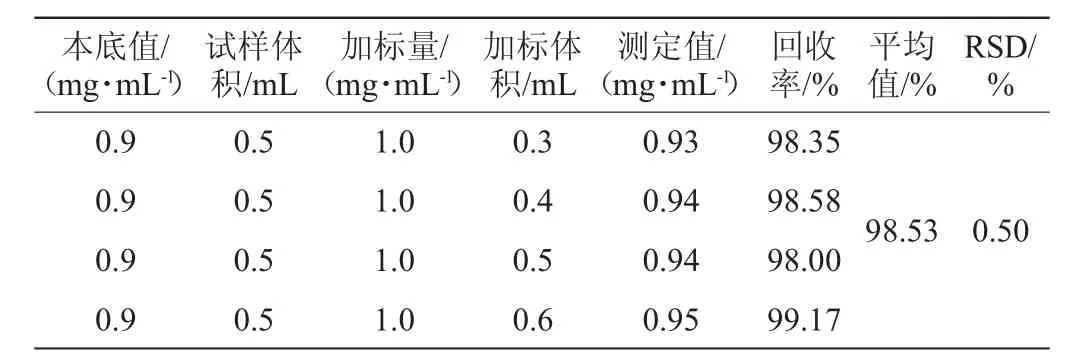
表7 加标回收率试验结果Table 7 Results of adding standard recovery rate tests
2.5 果露酒中总糖含量测定
精密吸取10 mL稀释50倍的3批不同的果露酒液于100 mL容量瓶,按照上述优化的条件对果露酒样品中总糖水解的葡萄糖质量浓度进行检测,并根据1.3.4中的公式计算果露酒中总糖的平均含量为45.12 mg/mL。
3 结论
本研究对果露酒中总糖的水解条件和还原糖的检测条件进行了优化,建立了3,5-二硝基水杨酸法(DNS法)测定发酵型果露酒中总糖含量。最终确定DNS法测定果露酒中还原糖的检测条件为:检测波长540 nm,沸水浴加热9 min,DNS显色剂3 mL,显色时间20 min;总糖的水解条件为添加7 mL 1∶1(V/V)盐酸溶液,80℃水解20 min;葡萄糖质量浓度在0.2~1.0 mg/mL范围内与吸光度值呈良好的线性关系(相关系数R2=0.999 8);试验精密度、重复性和稳定性试验结果的相对标准偏差(RSD)均<2%,平均加标回收率为98.53%,RSD值为0.50%。结果表明该检测方法可靠、准确、重现性好。因此,可使用DNS法检测果露酒中总糖含量并且可为总糖的测定及发酵生产提供依据和借鉴。
[1]李 松,周 岩.中国功能酒健康新蓝海[N].中国食品报,2017-1-4(9).
[2]黄书声,韩 娜,佟晓芳.中国保健酒的历史、现状和发展[J].酿酒,2008,35(4):16-21.
[3]杨启贤,徐莉莉.干型樱桃酒酿制及相关技术的研究[J].中国食品工业,2008,23(10):54-55.
[4]冯志彬,程显好,夏利江.樱桃果酒发酵工艺研究[J].中国酿造,2008,27(2):90-92.
[5]刘 杨,王 超,王 录.葡萄酒、果酒中总糖含量测定过程中调节溶液酸碱性的方法探讨[J].酿酒,2017,44(3):105-107.
[6]李晓明,魏法山.葡萄酒中总糖测定方法的研究进展[J].食品安全导刊,2016,45(30):59-60.
[7]黄国清,肖仔君.杨梅果酒总糖测定方法的改进初探[J].食品科技,2006,31(8):245-248.
[8]马洪涛,刘 华.葡萄酒及果酒中总糖检测的改进方法[J].中国质量技术监督,2011(8):61.
[9]武 平,赵文婧,徐晓娇,等.测定葡萄酒中总糖方法的探讨[J].中国酿造,2011,30(1):163-165.
[10]刘忠义,欧昌荣,汤海青,等.3,5-二硝基水杨酸法测定葡萄酒中总糖含量的条件优化[J].核农学报,2003,27(11):1717-1723.
[11]张 青,潘 英,童本定.3,5-二硝基水杨酸法测定灵芝多糖的含量[J].中国老年保健医学,2013,11(5):7-8.
[12]张忠义.葡萄酒中总糖测定方法探讨[J].中国公共卫生,2005,21(11):1398-1399.
[13]李卫兵,阳文辉.DNS法测定黄柏中总糖的含量[J].右江民族医学院学报,2008,30(1):13-14.
[14]俞明义,龚建锋.DNS法对金耳注射液多糖含量的测定[J].浙江中医杂志,2006,41(4):235.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2007.
[16]王会存,施 良.黄酒中总糖的测定方法探讨[J].中国卫生检验杂志,2005,15(7):813-814.

