不同高粱品种酿造酱香型白酒发酵特性的研究
郭 敏,保玉心*,黄永光,黄蕴利
(1.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025;2.遵义医学院,贵州 遵义 563000;3.贵州大学 贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
中国白酒是世界上最古老的蒸馏酒之一,通常由谷物发酵酿造而成。高粱因具有高含量的淀粉、低含量蛋白质和脂肪等特性,成为白酒酿造的首选原料。高粱对于白酒酿造的重要性,正如葡萄对葡萄酒和大麦对威士忌酿造一样[1-2]。在中国,传统白酒的年生产及消费量均非常大,因此对高粱的需求量也很大。由于白酒酿造耗粮大,大量国外高粱(如加拿大、澳大利亚等地产高粱)也进口到中国,作为白酒酿造原料。然而,进口高粱是否适宜酿造中国白酒、优质白酒,以及对中国白酒酿造质量的影响如何,仍未见详细报道。
原料是白酒酿造的物质基础,不同原料具有不同的成分结构、含量及酿造特性,用其酿酒,自然会产生不同的质量和风格[3]。高粱除富含淀粉、蛋白质外,还含有各种营养元素,如无机元素、维生素等,可为酿造微生物的生长、繁殖及代谢提供物质基础。又如高粱中含有的单宁,味苦涩、性收敛,对酶有钝化作用,降低发酵力,但适量的单宁可提高酒醅的发酵率。同时,单宁经蒸煮发酵,可转变成芳香物质,如丁香酸等,赋予白酒特殊的香气,并可抑制杂菌的生长[4]。高粱根据其淀粉组成结构及比例不同,可分为粳高粱和糯高粱。不同香型白酒、不同地域白酒的酿造,除就地择梁生产外,也多会选择其他地区种植的高粱。中国白酒根据其风格特征可分为浓香、清香、酱香、芝麻等12种香型白酒[5]。西南地区生产的以茅台酒为代表的酱香型白酒多以糯高粱为原料,而北方生产的酒多以粳高粱为原料酿制。近年,许多研究人员对高粱原料对白酒酿造特性及其产酒影响进行了研究,WU Q等[6-7]的研究表明,糯高粱、粳高粱原料所产酒的风味存在明显差异;田殿梅等[8]研究表明,不同淀粉结构高粱原料的酿造特性存在差异;袁蕊等[9]研究表明,糯高粱更容易糊化;李奇[10]报道支链淀粉含量高的高粱出酒率较高;蛋白质含量过高会导致氨基酸降解产生过多的杂油醇[11];AI Y等[12]研究发现,单宁含量低的高粱原料酿酒具有更高的乙醇生产速率。孙家芳[13]对白酒酿造原料的选用标准进行了初步探讨,但也只是根据当地企业的实际情况自行制定出一套针对原料基本理化指标的标准。
米曲霉(Aspergillus oryzae)是白酒酿造过程主要的糖化菌之一,可分泌各种酿酒过程所需酶类,如通过分泌产生糖化酶等酶类对原料进行利用,产生各种风味成分[14-17]。酿酒酵母(Saccharomyces cerevisiae)是酿酒过程最重要且最常见的功能微生物,对产乙醇、风味化合物、酒体质量和产量均具有显著影响[18]。因此,本课题主要对酿酒高粱原料的酿酒品质进行分析研究,拟从高粱原料酿造品质评价体系方面提供科技支撑,以米曲霉和酿酒酵母为发酵动力源,以不同产地的高粱为原料模拟固态发酵,研究不同高粱的酱香型白酒酿造发酵特性。拟进一步揭示不同原料对酱香型白酒酿造的影响,为其规模化应用提供参考基础。
1 材料与方法
1.1 材料与试剂
1.1.1 高粱样品
样品B1:四川产糯高粱;样品B2:贵州仁怀产红缨子糯高粱;样品B3、B4:中国北方产粳高粱;样品B5、B6:加拿大产粳高粱;样品B7、B8:澳大利亚产粳高粱;样品B9、B10:中国东北产粳高粱。
1.1.2 化学试剂
高温α-淀粉酶(酶活50 000 U/g):北京生东科技有限公司;糖化酶(酶活100 000 U/g):国药集团化学试剂有限公司;无水乙醇、三氯乙酸、无水氯化钙、氯化钠(均为分析纯):中国医药(集团)上海化学试剂有限公司;酵母粉(生化试剂):英国Oxoid公司;葡萄糖(分析纯):天津市永大化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose medium,YEPD)培养基:酵母粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,于121℃灭菌20 min备用。
察氏(Czapek-Dox)培养基:硝酸钠3 g/L,磷酸氢二钾1 g/L,硫酸镁(MgSO4·7H2O)0.5 g/L,氯化钾0.5 g/L,硫酸亚铁0.01 g/L,蔗糖30 g/L,琼脂20 g/L,蒸馏水1 000 mL,加热溶解,分装后121℃灭菌20 min。
米曲霉发酵培养基:将察氏培养基中的碳源调整为质量浓度为2.5 g/L的不同品种高粱淀粉,于121℃灭菌20 min备用。
固态发酵培养基:按3∶5比例将高粱与水混合,70~80℃浸泡24h,将水沥干,高温蒸煮糊化2h,于121℃灭菌15min备用。
高粱汁培养基:将高粱粉碎后,按照1∶4的比例将高粱与水混匀,加入高温α-淀粉酶(50 U/kg)进行2 h蒸煮糊化,迅速冷却至60℃以下后加入糖化酶(100 U/kg),于60℃水浴下进行4 h糖化,离心过滤取得上清液为高粱汁培养基,于121℃灭菌15 min备用。
1.1.4 菌株
菌株分离于贵州XJ公司生产用酱香大曲、堆积发酵酱香酒醅,根据前期菌株发酵特性研究结果,选酿酒酵母(Saccharomyces cerevisiae)YM1、YM2,米曲霉(Aspergillus oryzae)XJDJQM03菌株为本研究的试验菌株。
1.2 仪器与设备
1200型液相色谱仪:美国Agilent公司;DHP-9272A型恒温培养箱:上海跃进医疗器械一厂;Nanodrop 8000微量分光光度计:美国Thermo Scientific公司;电子天平:美国Mettler-Toledo公司;AvantiJ-E高速冷冻离心机:美国Beckman Coulter公司。
1.3 方法
1.3.1 模拟发酵方法及操作要点
固态发酵工艺参考黄永光[19]的方法,具体发酵工艺参数及操作要点参见文献[20-21]。
1.3.2 不同高粱原料米曲霉发酵特性
为研究不同高粱原料在白酒酿造过程的发酵特性,以不同来源和品种的高粱淀粉为碳源,进行米曲霉XJDJQM03菌株的不同高粱汁发酵实验,通过测定米曲霉XJDJQM03生物量和产葡萄糖含量,考察不同高粱原料的米曲霉发酵特性。
1.3.3 不同高粱原料酿酒酵母发酵特性
在白酒酿造过程,酿酒酵母(S.cerevisiae)是产生乙醇和风味物质的主要功能微生物。因此,为了研究、证实不同高粱原料的酿造发酵特性。本研究中重点对2种糯高粱样品B1、B2和4种粳高粱样品 B3、B4、B5、B6进行模拟酿造发酵对比分析。在初始还原糖浓度相同下,分别采用酿酒酵母菌株YM1、YM2进行发酵实验,通过测定酿酒酵母生物量、还原糖消耗量及乙醇产量,考察不同高粱原料的酿酒酵母发酵特性。
1.3.4 分析检测
米曲霉XJDJQM03生物量测定:将菌体悬液过滤并用蒸馏水离心洗涤,烘干至恒质量并称质量。酿酒酵母菌株YM1、YM2生物量的测定:采用YEPD平板培养计活菌数。
米曲霉XJDJQM03降解高粱淀粉分析:制备米曲霉XJDJQM03孢子悬浮液并计浓度,按5.0×105CFU/mL接种量接种于发酵培养基,30℃、250r/min条件下振荡培养72h。采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)方法进行还原糖测定[22]。
葡萄糖标准曲线制作:准确称量1.00 g无水葡萄糖,用去离子水溶解后定容至1000mL,制得质量浓度为1.00mg/mL葡萄糖储备液,分别吸取 0、1 mL、2 mL、3 mL、4 mL、5 mL、6mL葡萄糖储备液分别对应加入10 mL、9 mL、8 mL、7 mL、6 mL、5 mL、4 mL去离子水,制备成不同质量浓度的葡萄糖标准液,于波长520 nm条件下测定吸光度值。以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标绘制葡萄糖标准曲线。
乙醇含量测定:高效液相色谱法。色谱条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm),柱温:60℃,流动相:3mmol/L硫酸溶液,流速:0.6mL/min,进样量:10μL,检测器:示差折光检测器(differential refraction detector,RID)。乙醇标准曲线制定:配制不同浓度的乙醇标准溶液,根据乙醇质量浓度(x)和峰面积(y)制作乙醇标准曲线。
2 结果与分析
2.1 不同高粱品种米曲霉发酵
2.1.1 不同高粱品种米曲霉发酵的生物量变化
米曲霉XJDJQM03菌株的生长是发酵过程富集糖化动力糖化水解酶的基础。对发酵过程菌株XJDJQM03的生物量变化进行测定,进一步分析不同原料对菌株XJDJQM03生长的影响。菌株XJDJQM03生物量随发酵时间的变化结果见图1。

图1 不同高粱品种发酵过程中菌株XJDJQM03生物量的变化Fig.1 Changes of biomass of strain XJDJQM03 during fermentation process of different sorghum varieties
由图1可知,菌株XJDJQM03生长速率(曲线斜率)在24 h内迅速增大,总的生物量在48 h时达到最大,不同高粱原料中富集的XJDJQM03菌株生物量呈现出一定的差异;48 h后生物量开始出现整体下降。由发酵72 h的生物量可知,高粱样品B3、B4、B7、B8、B9和B10中菌株XJDJQM03生物量明显高于高粱样品B1和B2中菌株生物量。结果表明,粳高粱淀粉有利于菌株XJDJQM03的生长,在酿造过程菌株XJDJQM03有可能对粳高粱淀粉的利用率高于对糯高粱淀粉的利用,在以往的研究中粳高粱主要含有直链淀粉,糯高粱主要含有支链淀粉,且支链淀粉含量越高,淀粉的糊化越容易,这样就更利于酿酒微生物的生长繁殖[23]。因此,对于不同高粱原料米曲霉发酵的生物量的发酵机理仍需进一步研究。
但在白酒的实际酿造过程,由于酒曲提供了非常丰富的微生物,包括大量的细菌和霉菌,因此可提供的酶类也相对丰富,各酶类的作用可以彼此互补、调节,所以在白酒酿造过程中酶不容易钝化,在其他酶系的共酵下,对糯高粱的利用会更快。因此,在酱香型白酒酿造过程,当以支链淀粉含量更高的糯高粱作为酿造原料时,则要求在发酵过程中所使用的大曲必须提供更丰富的酶类,这可能就是高温大曲与糯高粱的有机结合,酿造优质酱香型白酒的缘由之一。
2.1.2 不同高粱品种米曲霉发酵过程葡萄糖变化
不同高粱品种菌株XJDJQM03发酵产葡萄糖含量结果见图2。
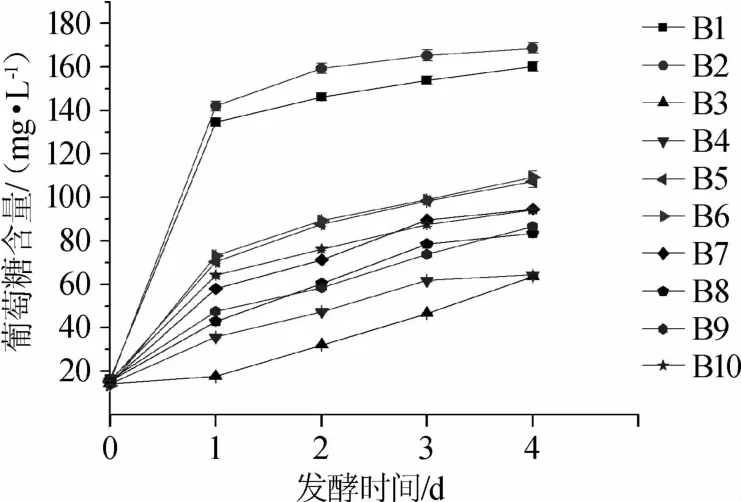
图2 不同高粱品种发酵过程中葡萄糖含量变化Fig.2 Changes of glucose contents during fermentation process of different sorghum varieties
由图2可知,随着发酵时间进程葡萄糖的含量出现逐渐上升趋势,在第4天时各高粱样品对应发酵的葡萄糖积累量最高。且样品B2对应发酵样的葡萄糖产量最高,达到了168.78 mg/L以上。样品B2为仁怀本地产红缨子糯高粱,具有直链淀粉含量低、支链淀粉含量高[24]、糖化发酵好等特点。在微生物发酵过程中,淀粉需要首先被糊化,即吸水膨胀后,晶体结构消失,分解为小分子糊精,才能继续被微生物所产生的酶分解利用。支链淀粉是树枝状的分支结构,而直连淀粉基本无分支,因此在糊化过程中,支链淀粉分支间的空隙更容易吸收水分子,进而膨胀糊化,在相同的糊化温度及水分条件下,与直连淀粉相比,支链淀粉被糊化的程度更完全[25],而在经过高温蒸煮之后的摊晾冷却过程中,直链淀粉更容易发生短期的老化回生,这样就可能导致微生物利用的困难。推测可能是发酵过程淀粉和其他成分更容易被米曲霉分泌酶系的利用,从而生成更多的葡萄糖,其深层次的发酵机理仍需进一步研究。相关研究也表明,直链淀粉含量较高的粳高粱不易被糊化[25],因此即使在相同的工艺下,也可能导致其被糖化的性能偏低,该推测在相关试验中也得到了相应的印证[26]。因此,以产糖结果来看,高粱样品B2在各实验高粱样品原料中占有明显优势,更适合酿造酱香型白酒,这与相关文献报道一致[9]。
2.2 不同高粱品种酿酒酵母发酵特性
2.2.1 不同高粱品种发酵对酿酒酵母生物量的影响
酿酒酵母YM1和YM2在不同高粱品种发酵过程中的生物量变化结果见图3。
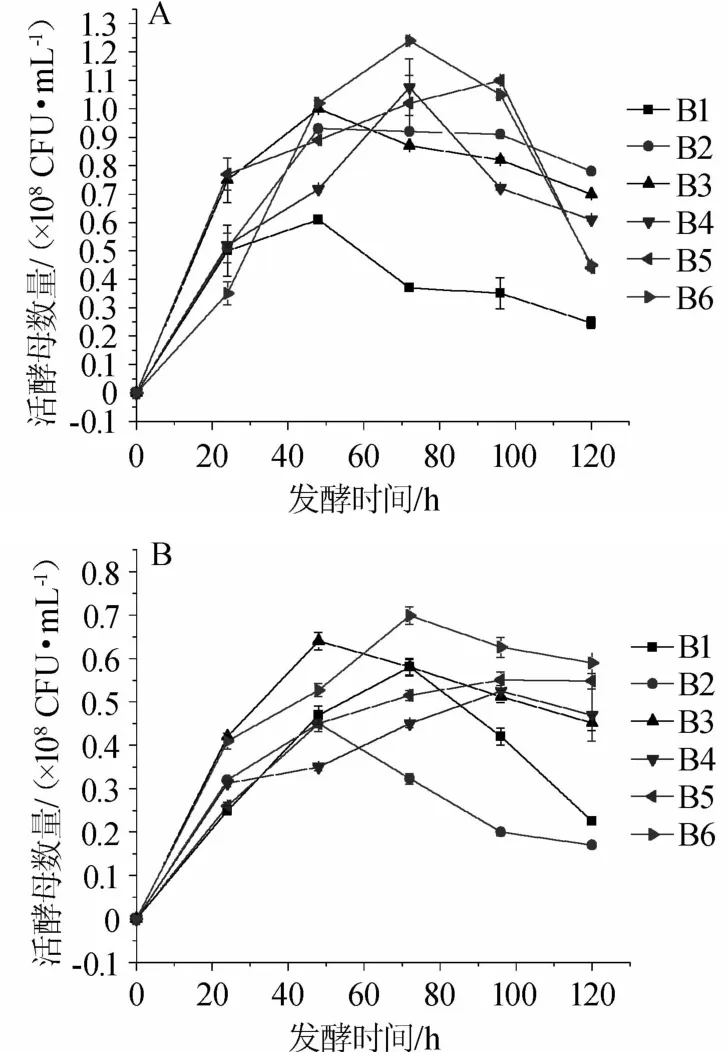
图3 不同高粱品种发酵过程中酵母菌株YM1(A)和YM2(B)生物量的变化Fig.3 Changes of biomass of strain YM1(A)and YM2(B)during fermentation process of different sorghum varieties
由于不同高粱原料的物质组成特性不同[27],原料中的不同物质成分在发酵过程被微生物的利用和影响微生物的生长自然存在一定差异,因此发酵菌株在不同高粱原料发酵过程的生物量变化存在差异。由图3可知,就YM1菌株发酵来看,在高粱样品B1、B2、B3发酵的前48 h内其生物量达到最大值,且高粱样品B2在前48 h内其生物量达到最大后便进入稳态,最终生物量为0.80×108CFU/mL,高于其他高粱原料中的终点生物量。同时,高粱样品B4、B6中的YM1菌株生物量则在发酵的72 h达到最高峰,比高粱样品B1、B2、B3发酵中的生物量滞后24h,之后便开始快速下降;高粱样品B5中的YM1菌株生物量则在发酵的96 h时才到达最大值,其可能与发酵底物的营养供给有关[23]。结果表明,高粱样品B2发酵样的生物量明显高于其他样品,分析其原因可能与高粱样品B2的糯高粱及其特性有关。据报道,高粱中适量的单宁对微生物生长有积极作用[28]。高粱样品B2为糯高粱,含支链淀粉较高,其淀粉和其他组分结构可能更有利于YM1菌株利用并促进其生长,发酵过程的生物量增加、富集要较粳高粱样品B4、B5、B6更快,进入发酵期快,其中的具体机理有待于进一步研究分析。
在YM2菌株发酵过程,高粱样品B2和B3在发酵的前48 h内其生物量达到最大后便进入下降态势,最终生物量分别为0.17×108CFU/mL、0.45×108CFU/mL,这与YM1菌株的不同高粱原料发酵具有类似效果;而B1、B6中的生物量则在发酵的72 h时达到最高值;B4、B5原料发酵中的生物量则在发酵的96 h时才达到最高值。
发酵过程中酿酒酵母(S.cerevisiae)对乙醇的生成和风味物质的形成具有重要影响。在本研究中,除高粱样品B1外的其他原料发酵过程中的YM1菌株的最大生物量普遍高于YM2菌株的最大生物量,该结果说明在高粱样品B2、B3、B4、B5、B6原料发酵中除淀粉外,可能含有更有利于菌株YM1生长的营养物质组成,导致YM1菌株更好的生长和富集。再看YM1菌株发酵,高粱样品B2原料发酵过程在前48 h内其生物量达到最大后便进入稳态,最终生物量高于其他高粱原料发酵中的终点生物量,因此高粱样品B2更有利于YM1菌株稳定生长、富集和发酵代谢。
2.2.2 不同高粱品种发酵对还原糖消耗量的影响
以不同高粱品种为原料,考察在酿酒酵母YM1菌株、YM2菌株发酵过程,其还原糖的变化情况,结果如图4所示。
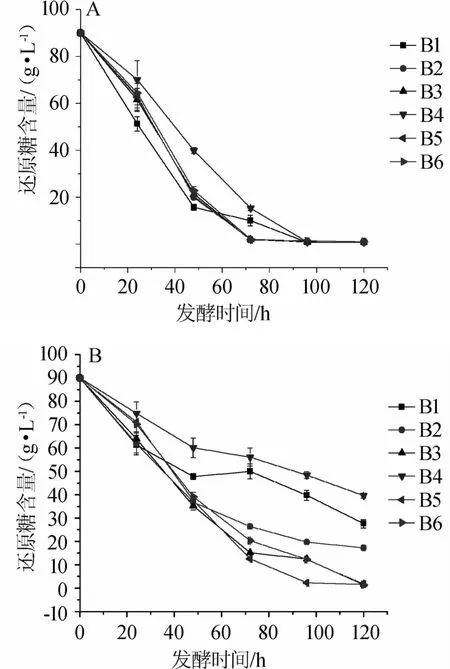
图4 酵母菌株YM1(A)和YM2(B)在不同高粱品种发酵过程中还原糖含量的变化Fig.4 Changes of reducing sugar contents during strain YM1(A)and YM2(B)fermentation process of different sorghum varieties
酿酒酵母(S.cerevisiae)存在于酱香型白酒发酵酒醅和大曲中,是酿造过程中的优势酵母[29-30]。其具有发酵起酵快、发酵力强、对糖的利用力强等发酵特点,并且还具有较强的酒精耐受性[17],发酵代谢高产乙醇特性[27]。由图4可知,各样品高粱发酵结果均表明YM1菌株对发酵过程的还原糖利用速率高于YM2菌株。在菌株YM2的各样品高粱发酵中,菌株YM2在对糯高粱发酵中还原糖的利用不如其他高粱原料。发酵过程还原糖被利用的效率与前述酵母的生长、乙醇的产量变化结果一致。
2.2.3 不同高粱品种发酵产乙醇的影响
乙醇产量是衡量高粱原料酿酒发酵特性的重要指标之一。不同高粱原料样品在模拟酿酒发酵过程对发酵产乙醇的影响,结果如图5所示。
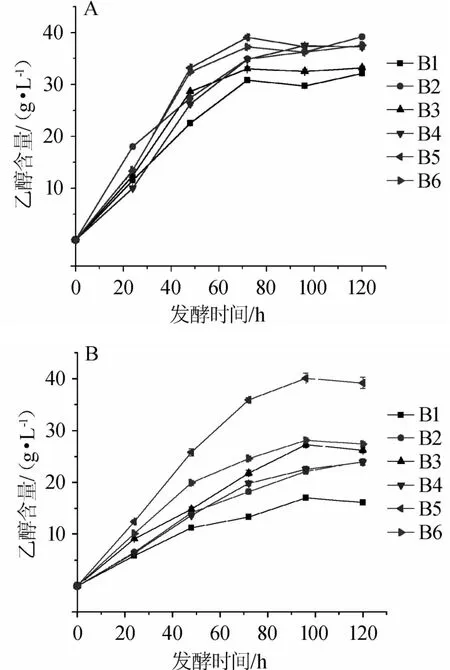
图5 酵母菌株YM1(A)和YM2(B)在不同高粱品种发酵过程中乙醇含量的变化Fig.5 Changes of ethanol contents during strain YM1(A)and YM2(B)fermentation process of different sorghum varieties
在菌株YM1发酵过程,各发酵样的乙醇含量波动范围较小(32.12~39.2 g/L),且发酵终点产乙醇含量差异不明显,表明发酵过程各发酵样之间的乙醇生成速率较为稳定,其中样品B2发酵终点乙醇含量最高(39.2 g/L)。菌株YM2发酵过程,各样品发酵过程的乙醇含量差异较明显(16.17~39.26 g/L),且菌株YM2在高粱样品B1和B2中代谢产生最少的乙醇,分别仅为16.17 g/L和27.42 g/L,表明YM2菌株不适用于糯高粱的发酵。
在相同还原糖含量条件下,除高粱样品B5外的其他发酵样中菌株YM1发酵代谢乙醇生成速率和终点浓度均高于菌株YM2,其中高粱样品B2发酵样中的菌株YM1发酵代谢乙醇质量浓度分别比菌株YM2发酵对应的乙醇质量浓度高15.2 g/L,这与菌株YM1在发酵过程的生物量普遍高于菌株YM2一致。该结果表明,虽然发酵初始还原糖浓度相同,但可能由于各发酵样中除淀粉以外的营养组分,例如单宁、蛋白质、粗脂肪、粗纤维、灰分、维生素等不同,从而决定了酵母菌株YM1、YM2之间的生长和代谢差异,进而影响乙醇的代谢发酵。以上结果说明,本研究所选用高粱更适合于菌株YM1发酵产乙醇,尤其是高粱样品B2更满足酱香型白酒酿造发酵工艺特性。
3 结论
以不同产地、品种类别高粱为原料,进行米曲霉(Aspergillusoryzae)XJDJQM03模拟发酵,研究酱香型白酒酿造过程不同高粱原料的发酵特性。结果表明,菌株XJDJQM03在酿造过程对糯高粱的利用不如粳高粱;高粱样品B2发酵更有利于发酵过程葡萄糖产量的富集。
酿酒酵母YM1、YM2以不同高粱为原料的发酵结果表明,糯高粱样品B2相对其他高粱品种来讲,更有利于菌株YM1的生长、代谢产乙醇,糯高粱的主要优势在于其支链淀粉含量高[31],更有利于保障白酒酿造品质,红缨子高粱为酱香型白酒酿造的主要原料。
从米曲霉XJDJQM03和酿酒酵母YM1、YM2菌株发酵过程的生物量、产糖、产乙醇富集结果来看,高粱样品B2在发酵过程更有利于双边发酵的协同性,更能满足酱香型白酒酿造的“一次投粮、九次蒸煮、八次发酵、七次取酒”的工艺特点和要求。
[1]DOLAN T C S.Malt whiskies:raw materials and processing[M].RUSSELL I,STEWART G,BAMFORTH C.Whisky technology,production and marketing,2003:27-73.
[2]LUND S T,BOHLMANN J.The molecular basis for wine grape quality-a volatile subject[J].Science,2006,311(5762):804-805.
[3]邵 燕,张宿义,祝 成,等.浓香型白酒风味物质与感官评定相关性研究[J].中国酿造,2012,31(8):96-99.
[4]闫松显,吕云怀,王 莉,等.西南区酿酒高粱的种质形成和发展[J].中国酿造,2017,36(5):17-21.
[5]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:135-143.
[6]WU Q,XU Y.Transcriptome profiling of heat-resistant strainBacillus licheniformisCGMCC3962 producing Maotai flavour[J].J Agr Food Chem,2012,60(8):2033-2038.
[7]GAO W,FAN W,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography olfactometry,quantitative measurements,aroma recombination,and omission studies[J].J Agr Food Chem,2014,62(25):5796-5804.
[8]田殿梅.不同品质高粱对浓香型大曲酒品质的影响研究[D].重庆:重庆大学,2013.
[9]袁 蕊,敖宗华,刘小刚,等.南北方几种高梁酿酒品质分析[J].酿酒科技,2012(12):33-36.
[10]李 奇.不同品种高粱酿造汾酒研究[J].酿酒2014,41(1):23-26.
[11]孙金旭.酱香型白酒发酵过程中异戊醇的控制研究[J].现代食品科技,2012,28(11):1541-1544.
[12]AI Y,MEDIC J,JIANG H,et al.Starch characterization and ethanol productionofsorghum[J].J Agr Food Chem,2011,59(13):7385-7392.
[13]孙家芳.关于酿酒原料使用标准的探讨[J].山东食品发酵,2005,32(2):43-45.
[14]余伟民,曾 志,吴生文,等.红曲霉对特香型白酒风味风格物质影响[J].中国酿造,2012,31(3):87-91.
[15]LESSARD M H,BELANGER G,STGELAIS D,et al.The composition of camembert cheese-ripening cultures modulates both mycelial growth and appearance[J].Appl Environ Microbiol,2012,78(6):1813-1819.
[16]LE D G,MOUNIER J,VASSEUR V,et al.Quantification ofPenicillium camembertiandP.roquefortimycelium by real-time PCR to assess their growth dynamics during ripening cheese[J].Int J Food Microbiol,2010,138(1-2):100-107.
[17]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-A traditional Chinese liquor fermentation starter[J].J Inst Brewing,2011,117(1):82-90.
[18]杨国华,邱树毅,黄永光.酱香白酒生产中产香微生物研究[J].中国酿造,2011,30(4):24-27.
[19]黄永光.酱香型白酒酿造中Aspergillus hennebergii及其分泌酸性蛋白酶的研究[D].无锡:江南大学,2014.
[20]曹 帅.酿酒高粱的品质特征及其对白酒酿造的影响[D].无锡:江南大学,2015.
[21]黄永光,徐 岩.真菌Aspergillus hennebergii酸性蛋白酶小麦固态发酵性能研究[J].食品工业科技,2014,35(21):135-139,145.
[22]WANG Y,YUAN B,JI Y,et al.Hydrolysis of hemicellulose to produce fermentablemonosaccharidesbyplasmaacid[J].Carbohyd Polym,2013,97(2):518-522.
[23]冯兴垚,杨文斌,罗惠波,等.三种酿酒高粱的理化特性与基酒风味分析[J].中国酿造,2017,36(8):76-79.
[24]田晓红,谭 斌,谭洪卓,等.20种高粱淀粉特性[J].食品科学,2010,15(1):13-20.
[25]蒋 兰.酿酒高粱淀粉含量测定及性质研究[D].重庆:重庆大学,2013.
[26]刘茂柯,唐玉明,任道群,等.酿酒高粱籽粒酿造性能的比较[J].中国酿造,2012,31(11):111-114.
[27]陈良强,吴 群,徐 岩.酱香型白酒低产杂醇油粟酒裂殖酵母特性的研究[J].工业微生物,2013,43(3):1-6.
[28]CHASSERIAUD L,KRIEGER-WEBER S,DÉLÉIS-BOU M,et al.Hypotheses on the effects of enological tannins and total red wine phenolic compoundsonOenococcusoeni[J].Food Microbiol,2015,52:131-137.
[29]高亦豹.聚合酶链式反应-变性梯度电泳技术(PCR-DGGE)研究中国白酒大曲中微生物群落结构[D].无锡:江南大学,2010.
[30]陈美竹,邱树毅,胡宝东,等.酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造,2015,34(6):5-10.
[31]王劲松,董二伟,武爱莲,等.不同香型白酒酿造高粱养分需求规律[J].山西农业科学,2016,44(7):977-980,983.

