酸法提取苹果渣中的果胶及其性质分析
任秋慧,卢韵朵,廖鲜艳,史吉平,刘 莉*
(1.中国科学院 上海高等研究院,上海 201210;2.上海大学 生命科学学院,上海 200444;3.上海理工大学 医疗器械与食品学院,上海 200093)
苹果是我国北方广泛种植的经济作物,也是常见的果汁原料。我国已成为全球最大的苹果果汁生产国[1]。苹果渣是果汁生产过程中的废弃物,约占加工量的20%~25%[2],目前大量的苹果渣未得到合理的利用,容易变酸变臭,对周边环境造成严重污染[3],同时造成了巨大的资源浪费。
研究表明,干苹果渣中含有15%~18%的果胶[4]。果胶主要由部分甲氧基化的半乳糖醛酸残基组成,广泛分布在水果和蔬菜中,作为新鲜细胞的结构单元及细胞之间的连接物质,其结构是基于1,4-键合的D-半乳糖醛酸[5]。它是一种具有良好水凝胶能力的天然高分子化合物,是联合国粮食及农业组织和世界卫生组织推荐使用的无添加量限制的天然营养保健添加剂。果胶作为一种有效的增稠剂和胶凝剂[6-7],广泛地应用于食品(如果酱、果冻、水果制品、水果饮料浓缩物、果汁、甜点和发酵乳制品)[8]。同时,还广泛应用于化妆品、造纸、印染、纺织、冶金、烟草、医药等领域[9]。另外,果胶还具有抗腹泻和抗癌的功效,对于高血压、高血脂、便秘等疾病具有一定的疗效[10-11]。此外还能够疏散人体中近一半的放射性元素[12]。
目前,果胶的提取方法主要有酸法、酶法、微波法、超声法、离子交换法、草酸铵提取法等[2,13-19]。酸法提取果胶是用稀酸将植物细胞中非水溶性果胶转化为水溶性果胶[20],提取方法较为成熟,操作方便,成本低,提取效率相对较高,被广泛应用于工业生产[12]。
本试验主要研究酸法提取果胶,首先以单因素试验(包括酸的种类、pH值、温度、时间、固液比)为基础,再通过响应面法对提取条件进行优化,以获得最佳的酸法提取果胶工艺条件。同时,对该法提取获得的果胶的酯化度(degree of esterification,DE)和半乳糖醛酸含量等性质进行分析,以期对果胶的提取提供简便易操作的可行性方案,同时可以根据所提取果胶的性质,为果胶的应用提供参考。
1 材料与方法
1.1 材料与试剂
苹果渣:苹果榨汁后将果渣煮沸、洗涤、干燥、粉碎、过40目筛网,备用;盐酸、硫酸、硝酸、磷酸、无水乙醇、半乳糖醛酸、氢氧化钠(分析纯):国药集团化学试剂有限公司;咔唑(分析纯):生工生物工程股份有限公司;葡聚糖标品:Sigma-Aldrich公司。
1.2 仪器与设备
ZHWY-110X50恒温水浴摇床:上海智城仪器制造公司;IKA C-MAG HS 7磁力加热搅拌器:上海硕光电子科技有限公司;MS3BS25旋涡混合器:艾卡(广州)仪器设备有限公司;ZRD-5210全自动新型鼓风干燥箱:上海智城分析仪器制造有限公司;R22GⅢ高速冷冻离心机:日立仪器有限公司;H1全功能微孔板检测仪:美国伯腾仪器有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;HPLC-20A高效液相色谱仪:日本岛津有限公司。
1.3 方法
1.3.1 酸法提取果胶的单因素试验
称取4 g苹果渣,按适当的固液比加水,混合均匀。用不同的酸调节体系pH值至设定的pH值。置于恒温水浴摇床中,调至设定的温度,转速180 r/min提取一定的时间。待反应结束后,将溶液定容至100 mL,从中取30 mL溶液在15 000 r/min条件下离心15 min。取20 mL上清液,加入60 mL无水乙醇,室温静置1 h后过滤,得到冻状透明沉淀,烘干后称取固体干质量,计算粗果胶得率。分别以酸的种类(盐酸、硫酸、硝酸、磷酸),加不同酸后调节体系pH值(1.0、1.5、2.0、2.5、3.0、3.5),水浴反应温度(80℃、85℃、90℃、95℃、100 ℃),时间(1.0 h、1.5 h、2.0 h、2.5 h、3.0 h、3.5 h、4.0 h),固液比(1∶8、1∶10、1∶12、1∶14、1∶16(g∶mL)为评价因素,研究果胶提取的最佳条件。
1.3.2 酸法提取果胶的响应面优化
基于单因素试验结果,采用4因素3水平的(Box-Behnken Design,BBD)试验设计,以pH值(X1)、温度(X2)、时间(X3)、固液比(X4)为自变量,以粗果胶得率为响应值,优化酸法提取果胶的最佳条件。试验因素与水平见表1。

表1 酸法提取条件优化响应面试验因素与水平Table 1 Factors and levels of response surface methodology for acid extraction conditions optimization
1.3.3 果胶分子质量的测定
将提取的果胶复溶于水,形成均匀的溶液,采用高效液相色谱法对果胶分子质量进行测定。使用凝胶色谱柱TSK gel Super Multipore PW-H。色谱条件:进样量20 μL,流动相为H2O,流速为0.4 mL/min,柱温35℃,采用示差折光检测器(refractive index detector,RID)进行检测。以分子质量分别为12.60 kDa、110.00 kDa和289.00 kDa葡聚糖为标准品,制作标准品分子质量与出峰保留时间曲线,根据标准曲线计算样品分子质量。
1.3.4 果胶中半乳糖醛酸含量的测定
将提取的果胶复溶于水,形成均匀的溶液,由于果胶的主要成分为半乳糖醛酸,故一般可以用半乳糖醛酸的含量来表示果胶的纯度,其含量越大,果胶的纯度越高[21]。采用咔唑比色法测定果胶中的半乳糖醛酸含量,半乳糖醛酸在硫酸中与咔唑试剂会发生缩合反应,该反应会生成紫红色络合物,该络合物在波长525 nm处有最大吸收。配制0、0.04 g/L、0.08 g/L、0.12 g/L、0.16 g/L、0.20 g/L半乳糖醛酸标准溶液,分别移取1 mL于6支离心管内,加入0.25 mL 0.15%咔唑乙醇溶液,混合均匀后迅速加入5 mL浓硫酸溶液,混合均匀。于85℃水浴10 min,冷水浴30 min。在波长525 nm条件下,测定吸光度值,以半乳糖醛酸质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线。
按照上述测定方法,以提取溶剂作为空白参比,测吸光度值。试验样品中的半乳糖醛酸含量按照公式(1)计算:

式中:x1为果胶样品中半乳糖醛酸含量,%;c为半乳糖醛酸的质量浓度,g/L;V为果胶提取液的总体积,L;n为提取液的稀释倍数;W为烘干后粗果胶沉淀的质量,g。
1.3.5 果胶酯化度的测定
将提取的果胶复溶于水,形成均匀的溶液,取5 mL均匀溶液加100 mL水,滴加酚酞,用0.02 mol/L的NaOH滴定至溶液呈浅粉色为滴定终点,记录消耗的体积V1。加入0.5 mol/L的NaOH 20 mL,搅拌15 min后,加入等体积等浓度的盐酸溶液,再搅拌15 min,红色消失。滴加酚酞,然后用0.02 mol/L NaOH标准溶液滴定至出现粉红色为终点。记录消耗的体积V2(皂化滴定值)。按照公式(2)计算酯化度DE值:

式中:V1为初滴定NaOH消耗体积,mL;V2为皂化滴定NaOH消耗体积,mL;c1为氢氧化钠浓度,0.02 mol/L;c3为盐酸的浓度,0.5mol/L;V3为0.5mol/L的盐酸的体积,20.0mL;c4为氢氧化钠的浓度,0.49 mol/L;V4为0.49 mol/L的氢氧化钠的体积,20.0 mL。
1.3.6 粗果胶得率、果胶提取率的测定
(1)粗果胶得率
冷却后称量质量,计算粗果胶得率。试验样品中的粗果胶得率按照公式(3)计算:

式中:x2为试验样品中的粗果胶得率,%;m为烘干后果胶沉淀的质量,g;V为果胶提取液的总体积,mL;v为用于醇沉的果胶清液体积,mL;w为试验样品中苹果渣干粉的质量,g。
(2)果胶提取率
苹果果胶的主要成分为半乳糖醛酸,故采用半乳糖醛酸在试验样品中所占比例表示果胶提取率。测定方法同1.3.4。试验样品中的半乳糖醛酸含量按照公式(4)计算:

式中:x3为试验样品中半乳糖醛酸含量,%;c为半乳糖醛酸的
质量浓度,g/L;V为果胶提取液的总体积,L;n为提取液的稀释倍数;m为试验样品中苹果渣干粉的质量,g。
2 结果与分析
2.1 酸法提取果胶的单因素试验
2.1.1 酸种类对果胶提取效果的影响
在酸种类对果胶提取效果影响的单因素试验中,选取的是工业上常用的4种酸:盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、磷酸(H3PO4),调节体系pH至2.0。分别测定粗果胶得率及果胶提取率,提取结果如图1所示。结果表明,在相同的提取条件下,不论是粗果胶得率还是果胶提取率,使用盐酸提取的数值均为最高,分别达到23.75%和13.34%。其次是硝酸,分别为21.00%和13.20%。接下来是硫酸,分别为19.25%和11.75%。最低的为磷酸,分别为17.00%和10.95%。盐酸的提取效果最佳,且原料易得,故选用盐酸提取。

图1 酸种类对粗果胶得率和果胶提取率的影响Fig.1 Effect of acids varieties on crude pectin yield and pectin extraction rate
2.1.2 pH值对果胶提取效果的影响
在pH值对果胶提取效果影响的单因素试验中,分别测定体系pH值为1.0、1.5、2.0、2.5、3.0、3.5时粗果胶得率和果胶提取率,结果如图2所示。由图2可知,在相同的提取条件下,无论是粗果胶得率还是果胶提取率,体系pH值为1.5时数值均为最高,分别达到27.88%和18.09%。当体系pH值为3.5时数值最低,仅有17.00%和9.82%。pH值过低会导致水溶性果胶进一步脱酯裂解,从而使果胶提取率降低[22]。另外试验发现,在相同的提取温度和提取时间条件下,溶液体系pH值越低,溶液颜色越接近红色,会影响最终果胶产品的颜色,因此选择pH1.5为酸法提取果胶的最佳pH值。
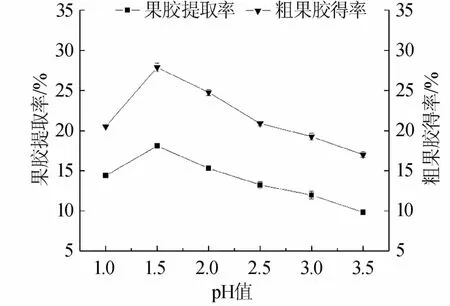
图2 pH值对粗果胶得率和果胶提取率的影响Fig.2 Effect of pH on crude pectin yield and pectin extraction rate
2.1.3 反应温度对果胶提取效果的影响
在反应温度对果胶提取效果影响的单因素试验中,分别测定了反应温度为80℃、85℃、90℃、95℃、100℃时粗果胶得率和果胶提取率,提取结果如图3所示。由图3可知,在相同的提取条件下,粗果胶得率在反应温度为95℃时,达到最高为31.44%。果胶提取率在反应温度为100℃时,达到最高为26.55%。95℃上升至100℃的过程中,果胶提取率增长缓慢,基于实际工业生产操作成本考虑,选择95℃为最佳反应温度。

图3 反应温度对粗果胶得率和果胶提取率的影响Fig.3 Effect of reaction temperature on crude pectin yield and pectin extraction rate
2.1.4 反应时间对果胶提取效果的影响
在反应时间对果胶提取效果影响的单因素试验中,分别测定了反应时间为1.0 h、1.5 h、2.0 h、2.5 h、3.0 h时粗果胶得率和果胶提取率,提取结果如图4所示。由图4可知,在相同的提取条件下,当反应时间为1.0 h时,粗果胶得率和果胶提取率均最低,分别为26.53%和15.50%;粗果胶得率在反应时间为3.0 h时,达到最高为32.16%;果胶提取率在反应时间为1.5 h时,达到最高为16.90%。反应时间从1.5 h延长到3.0 h过程中,粗果胶得率增长并不显著,趋于平缓,且基于实际工业生产操作过程中时间成本的考虑,选择1.5 h为最佳反应时间。
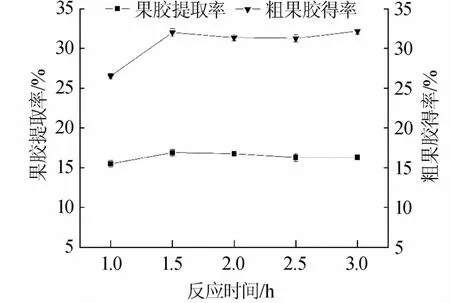
图4 反应时间对粗果胶得率和果胶提取率的影响Fig.4 Effect of reaction time on crude pectin yield and pectin extraction rate
2.1.5 固液比对果胶提取效果的影响
在固液比对果胶提取效果影响的单因素试验中,分别测定了固液比为1∶8、1∶10、1∶12、1∶14、1∶16(g∶mL)时粗果胶得率和果胶提取率,结果如图5所示。由图5可知,在相同的提取条件下,粗果胶得率在固液比为1∶16(g∶mL)时,达到最高为28.40%。果胶提取率在固液比为1∶12(g∶mL)时,达到最高为19.65%。固液比从1∶12(g∶mL)增加至1∶16(g∶mL)过程中粗果胶得率增长趋于平缓,且基于实际工业生产操作过程中成本的考虑,尽量节约用水,选择1∶12(g∶mL)为最佳固液比。而且当固液比过小时,溶液过于浓稠不便于操作。
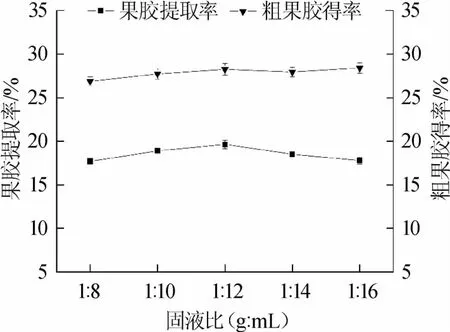
图5 固液比对粗果胶得率和果胶提取率的影响Fig.5 Effect of solid-liquid ratio on crude pectin yield and pectin extraction rate
2.2 酸法提取果胶的响应面优化试验
在单因素试验结果的基础上,采用4因素3水平的响应面试验设计,以pH值(X1)、温度(X2)、时间(X3)、固液比(X4)为自变量,以粗果胶得率(Y)为响应值,试验设计及结果见表2,回归模型方差分析见表3。

表2 酸法提取条件优化响应面试验设计及结果Table 2 Designs and results of response surface methodology for acid extraction conditions optimization
利用Design-Expert.V8.0.6软件对表2中的试验数据进行多项式回归拟合,得到关于粗果胶得率(Y)对pH值(X1)、温度(X2)、时间(X3)、固液比(X4)4个因素的二次多项回归方程如下:
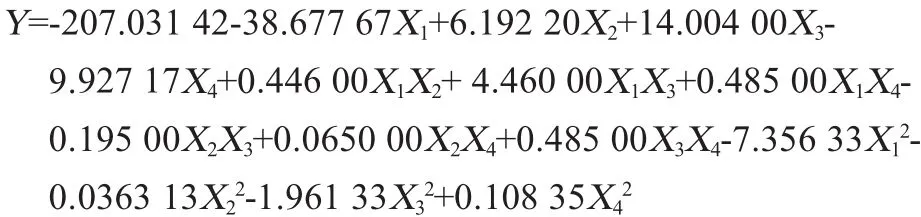

表3 回归模型方差分析Table 3 Variance analysis of the regression model
由表3可知,回归模型达到极显著水平(P<0.001);失拟项不显著(P=0.377 2>0.05),表明该二次多项回归方程对试验拟合情况良好,试验误差较小;并且该模型的R2=0.968 5,模型的校正决定系数R2=0.937 0,表示实测值与预测值高度相关,回归模型与实测值能够较好的拟合。变异系数(coefficient of variation,CV)=2.57%,CV数值较低,表明试验稳定性好,试验结果可靠。综上所述,可以说明该模型与实际试验拟合较好,自变量与响应值之间线性关系显著,可以用于最佳试验条件的预测。
由表3方差分析结果表明,一次项X3、X4,交互项X1X2、X1X3,二次项影响显著(P<0.05);X1、X2、X12影响极显著(P<0.001);X1X4、X2X3、X2X4、X3X4、X32、X42影响不显著(P>0.05)。从方差分析表可知,各因素对粗果胶得率的影响顺序为X1>X2>X3>X4,即pH值>温度>时间>固液比。利用Design-Expert V8.06软件对试验数据进行分析,得到表3方差分析结果中交互作用显著的pH值和温度以及pH值和时间的响应面3D图如图6所示,由图6(a)可知,在温度90~100℃,pH值在0.8~1.5的范围内,两者有显著的增效作用;温度在100~110℃,pH值在1.5~2.1的范围内,随着两者升高,粗果胶得率反而降低。由图6(b)可知,时间在1.0~1.5 h,pH值在0.8~1.2的范围内,两者有显著的增效作用;时间在1.5~2.5h,pH值在1.2~1.8的范围内,随着两者升高,粗果胶得率反而降低。

图6 pH值、温度、时间交互作用对粗果胶得率影响的响应面和等高线Fig.6 Response surface plots and contour line of effects of interaction between pH,temperature and time on crude pectin yield
通过模型预测最佳的工艺参数为:溶液的体系pH值1.47,温度100 ℃,时间2.0 h,固液比为1∶14(g∶mL),在此最佳工艺条件下,预测粗果胶得率为32.96%。为了验证模型的可靠性,并根据实际的可操作性,对最优的条件进行了试验验证,得出最佳条件为:溶液的体系pH值1.5,温度100℃,时间2.0 h,固液比1∶14(g∶mL),实际苹果果渣粗果胶得率为33.12%,与理论预测值相比误差为0.49%。因此,酸法提取苹果渣中果胶最佳工艺参数为:pH值1.5,温度100℃,时间2.0 h,固液比1∶14(g∶mL),苹果渣粗果胶得率为33.12%,此时,果胶提取率为19.65%。采用响应面优化得到的酸法提取苹果渣果胶的条件参数具有实用参考价值。
2.3 酸法提取果胶的性质分析
通过高效液相色谱法得知,酸法提取的果胶样品的分子质量主要分布在165.92 kDa、5.83 kDa与0.45 kDa范围内。试验中,酸法提取的果胶的酯化度为60.90%,属于高酯果胶,主要应用于糖果工业,用来制造软糖及胶冻夹心,此外,还可应用于生产乳制品,可有效地稳定酸奶制品并改善风味[22]。
将该酸法与其他方法提取得到的果胶性质进行比较,结果见表4。由表4可知,该方法提取的果胶酯化度略低于其他方法,但半乳糖醛酸的含量很高,为70.48%。同时,相较于酶法提取而言,该酸法提取果胶的半乳糖醛酸含量也较高,可能原因是酶法提取果胶过程中添加了酶,酶中含有溶于水不溶于乙醇的杂质,醇沉时随果胶沉淀下来,致使果胶中半乳糖醛酸含量较低,即纯度较低。本研究中提取的果胶中半乳糖醛酸含量较高,说明纯度更高,更具有明显的优势。
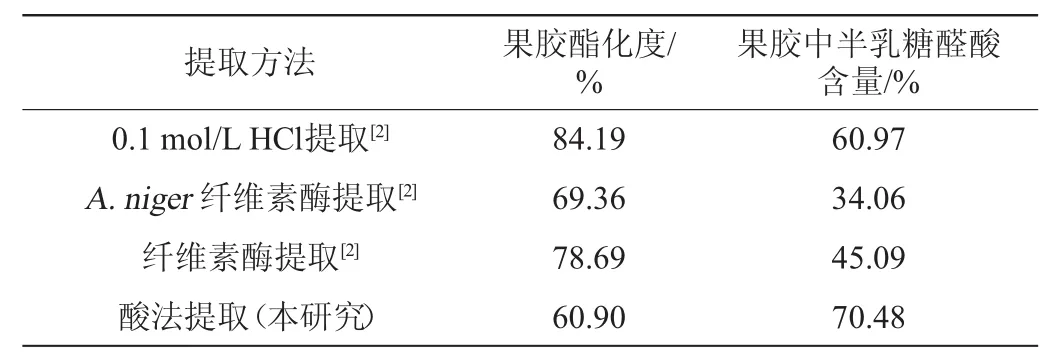
表4 不同方法提取的果胶性质比较Table 4 Comparison of the properties of pectin extracted by different methods
3 结论
通过单因素试验及响应面优化试验得出酸法提取苹果渣中果胶的最佳工艺为:盐酸调节反应pH值1.5,温度100 ℃,时间2 h,固液比1∶14(g∶mL)。在此最佳条件下,果胶得率为33.12%,果胶提取率为19.65%。所得到的粗果胶产品,其半乳糖醛酸含量为70.48%,纯度较高,酯化度为60.90%,属于高酯果胶,该方法简便,试剂易得,成本较低,适宜用在工业生产,为苹果渣的合理利用提供有利的途径。
[1]WANG X,CHEN Q R,LÜ X.Pectin extracted from apple pomace and citrus peel by subcritical water[J].Food Hydrocolloid,2014,38(3):129-137.
[2]邸 铮,付才力,李 娜,等.酶法提取苹果皮渣果胶的特性研究[J].食品科学,2007,28(4):133-137.
[3]张玉臻,林学政,刘 宏.苹果渣皮固态发酵的研究[J].食品与发酵工业,1996(3):29-32.
[4]刘少阳,丁秀玲,曾伟丽.从苹果渣中提取果胶工艺条件研究[J].北方园艺,2013(20):126-128.
[5]GUO X F,HAN D M,XI H P,et al.,Extraction of pectin from navel orange peel assisted by ultra-high pressure,microwave or traditional heating:A comparison[J].Carbohyd Polym,2012,88(2):441-448.
[6]WANG S J,CHEN F,WU J H,et al.,Optimization of pectin extraction assisted by microwave from apple pomace using response surface methodology[J].J Food Eng,2007,78(2):693-700.
[7]BAGHERIAN H,ASHTIANI F Z,FOULADITAJAR A,et al.Comparisons between conventional,microwave-and ultrasound-assisted methods for extraction of pectin from grapefruit[J].Chem Eng Process,2011,50(11):1237-1243.
[8]GUZEL-SEYDIM Z B,SEZGIN E,SEYDIM A C.Influences of exopolysaccharide producing cultures on the quality of plain set type yogurt[J].Food Control,2005,16(3):205-209.
[9]郭祖锋.甘薯渣中果胶提取纯化及物化特性研究[D].新乡:河南科技学院,2012.
[10]李春明,管春梅,郑 晶,等.果胶对大鼠血脂及抗氧化功能的影响[J].中国公共卫生,2004,20(6):721-723.
[11]JENKINS D J A,LEEDSE ANTHONY R,GASSULL M A,et al.Decrease in postprandial insulin and glucose concentrations by guar and pectin[J].Ann Int Med,1977,86(1):20-23.
[12]JACKSON C L,DREADENE T M,THEOBALD L K,et al.Pectin induces apoptosis in human prostate cancer cells:correlation of apoptotic function with pectin structure[J].Glycobiology,2007,17(8):805-819.
[13]贾艳萍,何爱民.微波法萃取橘皮中果胶的研究[J].中国酿造,2006,25(3):48-51.
[14]曹 东,黎星辰,唐 静,等.柠檬果渣果胶提取工艺研究[J].中国酿造,2015,34(4):128-131.
[15]程 洋,张 英,段双艳,等.富含岩藻糖苹果皮果胶的提取与理化性质[J].食品科学,2014,35(10):6-10.
[16]游新侠,孔欣欣.微波辅助提取苹果渣中高酯果胶的研究[J].食品与发酵科技,2009,45(1):40-43.
[17]窦 姣,郭玉蓉,薛战锋,等.超声辅助提取工艺中pH对苹果果胶品质的影响[J].食品工业科技,2014,35(10):172-176.
[18]孙润仓,王妹清,刘建朝,等.离子交换树脂法从甜菜渣中提取果胶[J].食品工业科技,1989(2):40-41.
[19]黄永春,杨 锋,何 仁,等.草酸铵逆流萃取法提取西番莲果皮中果胶的研究[J].食品科学,2008,29(9):226-229.
[20]王宪青,何淑清.从苹果渣中提取果胶的研究[J].农产品加工·学刊,2005(4):32-34.
[21]余继宏,朱 炯,波聂琴.天仙果果胶提取条件及含量测定[J].中国林副特产,2007(3):6-8.
[22]戴余军,石会军.酸解醇沉法提取柑橘皮果胶工艺的优化[J].北方园艺,2012(1):54-57.

