全面无反应量表在重症动脉瘤性蛛网膜下腔出血预后评估中的应用
赵经纬 罗旭颖 徐 明 石广志 周建新
(首都医科大学附属北京天坛医院重症医学科,北京 100050)
重症动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)一般是指世界神经外科医师联盟(World Federation of Neurosurgical Societies,WFNS)分级≥ Ⅳ级的aSAH[1-2];既往的观念曾认为,此类患者病情危重,预后极差,手术干预的效果也十分有限,故不适于进行外科治疗[3-4]。然而,近十几年来,伴随着显微神经外科及神经介入学科的发展,愈来愈多的研究[5-6]显示手术或(和)介入干预能够改善部分重症aSAH患者(24%~50%)的预后转归。由此可见,传统的WFNS分级是无法准确评估重症aSAH的预后的,尤其是对于那些接受了手术或(和)介入治疗的病患[5-6]。究其原因,则主要还是由于WFNS分级是基于格拉斯哥昏迷评分(Glasgow Coma Scale,GCS)的评判系统[7];而GCS在意识障碍以及病情评估方面均存在明显缺陷,包括无法准确评估插管患者的语言项目以及缺乏反映脑干功能、呼吸模式的指标等[8]。相较而言,Wijdicks等[9]在2005年提出的全面无反应量表(Full Outline of Unresponsiveness Scale, FOUR)则在设计方面很好地弥补了上述缺陷;而且,近期的相关研究[10-11]亦显示:在重症颅脑损伤以及重症监护病房(intensive care unit,ICU)的患者中,FOUR量表预测预后的准确性极高。那么,相似地,FOUR量表是否也可用于重症aSAH的预后评估呢?
目前关于FOUR量表应用于aSAH的文献[10-12]数量十分有限,而且主要关注的还是轻中症患者。有鉴于此,本实验拟通过对外科干预(手术和/或介入)后转入首都医科大学附属北京天坛医院ICU的重症aSAH患者进行同步的FOUR和GCS评分,以比较两种量表在预测预后方面的优劣,从而探究FOUR量表在重症aSAH预后评估中的应用价值。
1 对象与方法
1.1 研究对象
从2016年11月至2017年6月连续收入首都医科大学附属北京天坛医院ICU的重症SAH患者(即WFNS分级≥Ⅳ级)中筛选研究对象。所有入选患者的治疗均参考现行临床指南[1,13],本研究方案符合医学伦理标准,并经首都医科大学附属北京天坛医院医学伦理委员会论证、批准(批准文号:KYSB2016-103);而且,所有参研患者的直系亲属均已签署知情同意书。
1)入选标准:①年龄18~80岁;②经CT动脉造影(CT arteriography,CTA)或数字减影血管造影(digital subtraction angiography,DSA)检查确诊为aSAH;③转入ICU前12 h内已完成相应手术、介入或“杂交”(手术+介入)治疗;④患者直系亲属同意参与研究并签署相关知情同意书。
2)排除标准:①非动脉瘤性(如:创伤性、自发性、动脉夹层性、动脉畸形性等)SAH患者;②感染性、创伤性等因素所致动脉瘤引发的SAH患者;③存在眼部损伤、义眼以及角膜、结膜异常等情况,可能影响FOUR量表“眼部反应”项目评分的患者;④既往SAH病史或其他卒中及相关神经系统疾病病史遗留功能残疾致改良的Rankin量表(Modified Rankin Scale,mRS)>2分的患者;⑤并存其他系统(心脏、呼吸系统、肾脏、血液系统、免疫系统)严重疾患可能影响其生存预后的患者;⑥生命体征不稳的濒死患者。
1.2 FOUR与GCS量表评估
评估时机为转入ICU后的6~12 h;若患者仍处于麻醉恢复阶段,或存在短期内使用过或正在使用镇静镇痛药物的情况,则可将评估时机延后3~6 h;另外,两种量表评估的时间间距要求<0.5 h。对于气管插管的患者,GCS语言项目的评分可根据患者与检查者交流时的反应能力,按改良的“三等级”评估方法进行评分[9-11]。两种量表的评估均由两名已受过培训的高年资ICU医师分别、独立进行;二者的评估结果需计算相符率,同时应用一致性Kappa检验以判定其可靠性,不一致的评分结果则需要通过评估者之间的协商求得一致后方可纳入进一步的数据分析。
1.3 神经影像评估
应用Claassen等[14]提出的改良版Fisher 分级方法对患者入院时的头颅CT平扫结果进行评估;评估过程仍由上述两名高年资ICU医师采取“背靠背”方式进行;同样地,二者的评估结果需计算相符率,评估者之间的一致性也应用Kappa检验进行判定;不一致的结果通过二者协商解决。
1.4 预后评估
采用mRS进行预后评估:即完全没有症状(0分);轻微症状,但无明显残疾,可独立完成发病前各种活动(1分);轻度残疾,能独立打理日常生活,但不能完全从事发病前所有的活动(2分);中度残疾,可独立行走,但其他一些更复杂的任务需他人协助(3分);重度残疾,不能独立行走,且完全依赖他人协助下完成日常各项活动(4分);严重残障,持续卧床,二便失禁,需持续床旁护理(5分);死亡(6分)。本研究以mRS 0~3分为预后良好,4~6分为预后不良[15];入选患者可根据上述标准分为预后良好组和预后不良组。
预后评估时机为发病后3个月;随访由一名受过专门培训的ICU医师负责;通过电话预约至患者所在病房、下级医院或家中,或通过门诊、视频会诊等方式进行面对面评估。该名随访员知晓患者的原发病诊断,但未参与此患者的诊疗,且不了解其FOUR与GCS评分以及神经影像分级的结果。
1.5 统计学方法

2 结果
2.1 一般资料
研究期间,共有36例患者被纳入本实验;但这其中,有2例患者因中途失访(随访率94.4%)而不得不被剔除,故最终只有34例患者(年龄33~78岁,男性22例,女性12例)的数据被用于统计分析。这34例患者从发病至入组的平均时间为(18.3±3.5)h(13.0~23.5 h),发病至FOUR/GCS评估的平均时间则为(25.8±4.1)h(19.5~32.0 h)。此外,这34例患者在进行FOUR/GCS评估时,有28例仍保留气管插管(79.4%),并同时进行了有创机械通气支持。
之后的随访结果则显示发病后3个月预后不良(mRS 4~6分)的患者有21例,预后良好(mRS 0~3分)的13例;这两组患者在人口统计学指标(年龄、性别、体质量指数)、气管插管率、发病至手术和(或)介入时长以及干预方式的选择等方面的单因素比较结果差异均无统计学意义(P>0.05,表1)。
2.2 头颅CT评估
两名高年资ICU医师对上述34例患者入院时的头颅CT检查结果分别进行了改良Fisher评级,结果显示,两者的相符率为82.4%;一致性检验所得Kappa值为0.72(P=0.000),证明所评估结果可靠。基于上述评估结果的单因素分析显示:入院时的改良Fisher评级结果在预后不良组与预后良好组间均存差异有统计学意义(P<0.05)(表1);而当入院时的头颅CT评估结果为改良Fisher Ⅳ级时,其预测不良预后的SEN、SPE、PPV、NPV分别为0.71、0.77、0.83与0.63(表2)。
2.3 FOUR与GCS量表评估
上述两名高年资ICU医师对34例患者入ICU后分别进行的FOUR与GCS评分结果显示:二者相符率分别为85.3%、72.1%,相应的Kappa值则分别为0.71(P=0.000)与0.56(P=0.031),二者评估结果尚可靠。入ICU后的FOUR评分与GCS评分在预后不良组与预后良好组之间差异有统计学意义(P<0.05)(表3)。进一步绘制的ROC曲线又显示FOUR与GCS评分预测不良预后的辨别力(AUC)分别为0.87和0.79且均P<0.05(图1)。以ROC约登指数的最大值,即FOUR<7.5、GCS<9.0为界值,来计算其预测不良预后的SEN、SPE、PPV、NPV分别为0.91、0.85、0.88、0.84与0.71、0.79、0.79、0.69(表2)。
2.4 多元Logistic回归分析
将上述单因素分析中P<0.1的预测参数,即入院时改良的Fisher分级、入ICU后FOUR与GCS评分,以“后进式”代入多元Logistic回归模型,结果显示仅FOUR评分是与aSAH不良预后显著相关的独立危险因素(OR=0.22,95%CI: 0.01~0.75,P=0.015),而其他两项参数均差异无统计学意义(P>0.05)(表3)。
表1
单因素分析
Tab
.
1
Univariate
analysis

ItemPooroutcome(mRS4-6,n=21)Favorableoutcome(mRS0-3,n=13)PDemographicdate Age/a55.3±10.051.9±10.90.364 Gender/%1.000 Male14(66.7)8(61.5) Female7(33.3)5(38.5) BMI/(kg·m-2)27.5±3.826.1±2.00.906ModifiedFishergradeonadmission/%0.02400(0.0)0(0.0)Ⅰ0(0.0)0(0.0)Ⅱ2(9.5)3(23.1)Ⅲ4(19.1)7(53.8)Ⅳ15(71.4)3(23.1)FOUR/GCSscoresafterICUadmission/% FOURscores5.5±1.89.5±1.80.000 GCSscores6.3±2.88.8±1.60.002 Timefromictustoassessment/h24.2±2.126.0±1.80.863Management Intubatedonassessment/%19(90.5)9(69.2)0.155Aggressivetreatment/%0.733 Surgicaltherapy7(33.3)5(61.5) Interventionaltherapy12(57.2)8(38.5) Surgical+interventionaltherapy2(9.5)0(0.0)Timefromictustoaggressivetreatment/h16(7.5,20.0)14(8.0,19.5)0.928 mRS:ModifiedRankinScale;BMI:bodymassindex;FOUR:FullOutlineofUnresponsivenessScale;GCS:GlasgowComaScale;ICU:intensivecareunit.
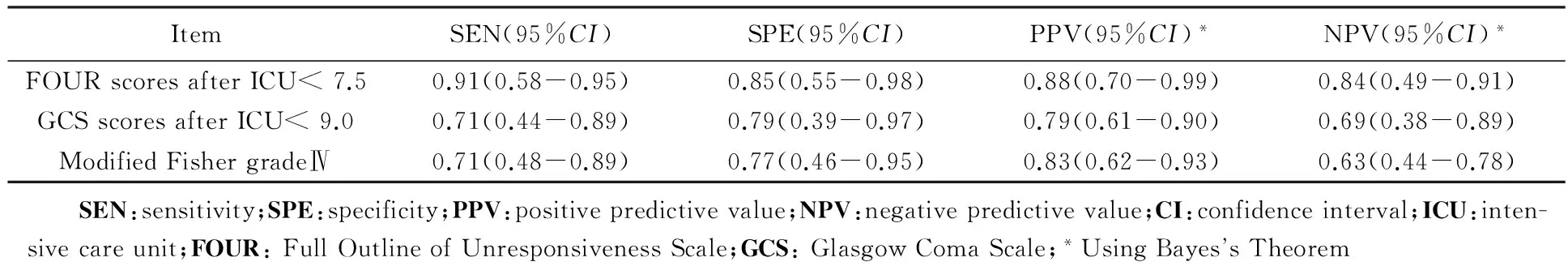
表2 预测指标预测不良预后的评价Tab.2 Evaluation results of predictors for poor outcome
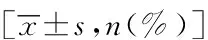
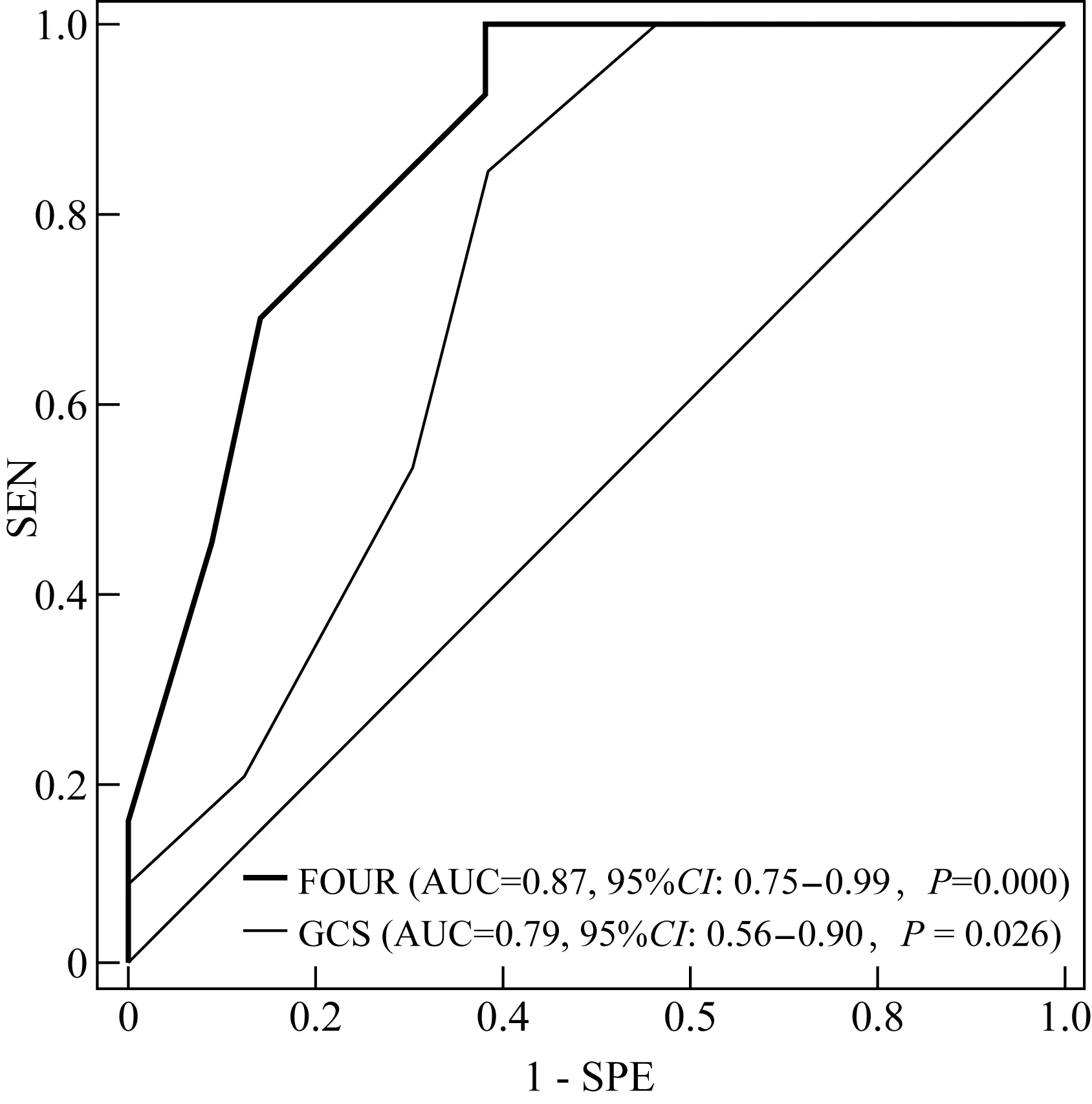
图1 FOUR/GCS评分预测重症aSAH不良预后的ROC曲线Fig.1 ROC curves of FOUR/GCS scores for theprediction of poor outcome in severe aSAH
ROC:receiver operating characteristic;SEN: sensitivity;SPE: specificity;FOUR: Full Outline of Unresponsiveness Scale;GCS: Glasgow Coma Scale;AUC: area under curve;CI: confidence interval;aSAH: aneurysmal subarachnoid hemorrhage.
3 讨论
本研究结果显示,在手术或(和)介入干预后的早期,FOUR评分可以比较准确地评估重症aSAH患者的远期预后(AUC、SEN、SPE、PPV、NPV均>0.80),其预测的准确性亦好于同时期评估的GCS评分;而且,FOUR评分还是与重症aSAH患者术后3个月不良转归(mRS 4~6分)显著相关的独立危险因素;由此可见,FOUR评分在重症aSAH术后评估中具有相当高的应用价值,可作为预后评估以及手术或/和介入干预效果评判的理想指标。
上述的研究结果与在重症颅脑损伤患者、综合ICU患者以及轻中症aSAH患者中的研究[10-12]发现十分相似;这也体现了FOUR评分相对于传统的GCS评分在意识、病情与预后评估方面的绝对优势,以及该评分在神经科、重症医学等众多领域适用的广泛性。之所以具有这样的现象,归根结底还在于FOUR评分在项目设置与量表设计方面的合理性,特别是针对神经科与ICU病患。比如说,FOUR量表与GCS量表在设计方面最大不同是语言评分项目的剔除,这一改进最大的好处在于避免了很多保有气管插管或气管切开的重症患者,由于语言检查不能配合所致的评分过低现象,以及不同检查者之间所出现的评分分歧[9];以本研究为例,本研究所纳入的研究对象中有近80%的患者在评估时仍保留有气管插管,而对于这些患者进行的GCS评分,即使是较高年资的有经验医师依然存在相对较大的评分不一致现象(Kappa<0.60),其语言项目的评估也多趋向于较低评分,与之相较,在进行FOUR评分时,检查者之间的一致性便明显提高(Kappa>0.70),剔除语言项目后,仅以患者在运动和眼动方面的配合程度来进行评分,其评估准确性也必然提高,故也就不难解释为什么在预测预后的辨别力以及准确性方面,FOUR均要明显好于GCS评分了,而且FOUR评分能够成为与不良预后显著、独立相关的危险因素了。除了气管插管的因素外,很多神经重症的患者,包括本研究所关注的aSAH以及颅脑损伤的患者还会因为特定的损伤部位(如:左大脑半球、小脑、桥脑等)出现失语或构音障碍的现象,若此时应用GCS评分,也会影响其分值的可靠性与真实性[9,12],这可能也是导致本研究中GCS评分在预测预后方面不如FOUR评分,而且未成为与重症aSAH预后独立相关的危险因素的另一重要原因。因而,对于重症aSAH患者,考虑其可能存在的气管插管、失语、构音等情况,排除了语言项目的FOUR可能更适于此类患者的意识与病情评估。
FOUR量表与GCS量表相较,另一个明显的不同点在于增加了瞳孔、角膜、咳嗽反射与呼吸模式等项目,这一改变不仅使评估内容更加丰满、全面,更重要的在于引入了决定患者预后的关键指标之一——脑干功能的相关评分。既往已有很多神经重症领域的研究证实:脑干反射的消失,包括瞳孔、角膜反射等均是与患者预后独立相关的重要因素,而与延髓功能相关的咳嗽反射与呼吸模式更是决定患者病死率的关键要素[16];而且,在某些类似研究[10-11]中,对FOUR量表的脑干反射或呼吸模式评分进行了单独分析,其结果显示它们预测预后的AUC、SEN、SPE等均要好于量表中其他项目的分析结果,足见脑干功能对于重症患者预后与病情评估的重要性。遗憾的是,由于样本量较小,本研究未进一步对FOUR评分各个项目与预后的关系进行单独分析;但笔者相信,本研究倾向于FOUR量表的结果也应该与该量表引入脑干功能评估内容的设计有关。
另外,本研究结果还显示,虽然头颅CT改良的Fisher分级也是与重症aSAH远期预后相关的预测指标,但并非与其显著相关的独立危险因素,且其预测不良预后的SEN、SPE、NPV等也不甚理想(均小于80%)。造成这一结果的主要原因,可能是由于Fisher分级(改良版)在设计之时,只是作为患者入院时初步评估的工具,并未考量手术或介入治疗对于患者预后的潜在影响[14];而且,目前在临床上,改良的Fisher分级更多地还是用于与aSAH相关的迟发型脑缺血(delayed cerebral ischemia,DCI)的预测[14]。虽然DCI也是导致重症aSAH致死、致残(不良预后)的主要病因,但研究[17]显示:手术或介入治疗可以显著改善重症aSAH患者DCI的发生率。本研究中,改良的Fisher分级评估基于的就是入院时,手术或介入干预前的CT检查结果,而预后的评估时机是术后3个月,故也无法排除手术或介入治疗对于预后的影响,这可能最终导致了Fisher分级(改良版)在预后评估方面表现不佳。因而,对于此类患者,临床检查所应用的FOUR量表若应用于合理的评估时机(外科干预术后),可能更适于预后的评估。
需要指出的是本研究尚存几项缺陷:首先,本研究为单中心实验且样本量偏少,故研究结果的可重复性以及研究结论的可靠性仍存疑虑,需要进一步的多中心、更大样本量研究的验证;第二,由于缺乏相关类似研究,使得本实验在设计时无法估算样本量,仅设定了时间期限来收集研究对象,因而无法知晓目前的样本量对于本研究结果的论证是否充足,此缺陷也需在日后的多中心、更大样本量研究中加以弥补,也希望本研究的结果可为日后类似实验的样本量估算提供依据;此外,由于是单中心、小样本研究,本研究的多元Logistic回归模型是建立在有限预测参数的基础之上,故相关结果仍有变异可能,这也需进一步扩大样本量及相关参数数量对本研究的结果再验证;最后,如上文所述,本研究未对FOUR量表各个评分项目进行单独的分析,故无法了解各个项目在预测预后中所占权重,此缺陷也需日后的相关研究加以改善。
尽管存在上文所述之缺陷,本研究也在一定程度上证实了FOUR量表对于重症aSAH患者术后评估的重要应用价值,以及在远期预后预测方面的准确性;当然,对于FOUR量表在重症aSAH患者中真正的推广应用,尚需更大样本量以及更严密设计之研究的进一步验证。
[1] 徐跃峤,王宁,胡锦,等. 重症动脉瘤性蛛网膜下腔出血管理专家共识(2015)[J]. 中国脑血管病杂志,2015,12(4):215-225.
[2] Fung C, Inglin F, Murek M, et al. Reconsidering the logic of world federation of neurosurgical societies grading in patients with severe subarachnoid hemorrhage[J]. J Neurosurg, 2016, 124 (2):299-304.
[3] Bailes J E, Spetzler R F, Hadley M N, et al. Management morbidity and mortality of poor-grade aneurysm patients[J]. J Neurosurg, 1990, 72 (4):559-566.
[4] Le Roux P D, Elliott J P, Newell D W, et al. Predicting outcome in poor-grade patients with subarachnoid hemorrhage: a retrospective review of 159 aggressively managed cases[J]. J Neurosurg, 1996, 85 (1):39-49.
[5] Mocco J, Ransom E R, Komotar R J, et al. Preoperative prediction of long-term outcome in poor-grade aneurysmal subarachnoid hemorrhage[J]. Neurosurgery, 2006, 59 (3):529-538.
[6] Haug T, Sorteberg A, Finset A, et al. Cognitive functioning and health-related quality of life 1 year after aneurysmal subarachnoid hemorrhage in preoperative comatose patients (Hunt and Hess Grade V patients)[J]. Neurosurgery, 2010, 66 (3):475-485.
[7] Drake C G, Hunt W E, Sano K, et al. Report of world federation of neurological surgeons committee on a universal subarachnoid hemorrhage grading scale[J]. J Neurosurg, 1988, 68 (6):985-986.
[8] Balestreri M, Czosnyka M, Chatfield D A, et al. Predictive value of glasgow coma scale after brain trauma: change in trend over the past ten years[J]. J Neurol Neurosurg Psychiatry, 2004, 75 (1):161-162.
[9] Wijdicks E F, Bamlet W R, Maramattom B V, et al. Validation of a new coma scale: The FOUR score[J]. Ann Neurol, 2005, 58(4):585-593.
[10] Wijdicks E F, Kramer A A, Rohs T Jr, et al. Comparison of the full outline of UnResponsiveness score and the glasgow coma scale in predicting mortality in critically ill patients[J]. Crit Care Med, 2015, 43(2):439-444.
[11] Okasha A S, Fayed A M, Saleh A S. The FOUR score predicts mortality, endotracheal intubation and ICU length of stay after traumatic brain injury[J]. Neurocrit Care, 2014, 21(3):496-504.
[12] Zeiler F A, Lo B W, Akoth E, et al. Predicting outcome in subarachnoid hemorrhage (SAH) utilizing the full outline of UnResponsiveness (FOUR) score[J].Neurocrit Care, 2017,27(3): 381-391.
[13] Diringer M N, Bleck T P, Claude Hemphill J 3rd, et al. Critical care management of patients following aneurysmal subarachnoid hemorrhage: recommendations from the neurocritical care society’s multidisciplinary consensus conference[J].Neurocrit Care, 2011, 15(2):211-240.
[14] Claassen J,Bernardini G L,Kreiter K,et al. Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited[J].Stroke, 2001, 32(9):2012-2020.
[15] Patel N, Rao V A, Heilman-Espinoza E R, et al. Simple and reliable determination of the modified rankin scale score in neurosurgical and neurological patients: the mRS-9Q[J].Neurosurgery, 2012, 71(5):971-975.
[16] Lee Y C, Phan T G, Jolley D J, et al. Accuracy of clinical signs, SEP, and EEG in predicting outcome of hypoxic coma: a meta-analysis[J].Neurology, 2010, 74(7):572-580.
[17] Etminan N, Beseoglu K, Eicker S O, et al. Prospective, randomized, open-label phase Ⅱ trial on concomitant intraventricular fibrinolysis and low-frequency rotation after severe subarachnoid hemorrhage[J]. Stroke, 2013, 44(8):2162-2168.

