改良抗血小板药物方案在血小板高反应性未破裂颅内动脉瘤患者介入栓塞中的疗效及安全性
夏鹏飞 王 伟 邹 亮 马英明
(1.内蒙古民族大学第二临床医学院神经外科,内蒙古牙克石022150;2.内蒙古民族大学,内蒙古通辽028000)
弹簧圈介入栓塞作为有效的预防颅内未破裂动脉瘤(unruptured intracranial aneurysms,UIA)破裂出血的治疗方案,极大地改善了患者的预后,虽然线圈装置的研制与应用技术的不断开展减少了手术合并症,但血栓栓塞事件仍然是血管内治疗引起神经功能缺损不可避免的合并症[1]。双联抗血小板疗法阿司匹林+氯吡格雷已广泛地应用于预防UIA介入术后血栓的形成,但在长期的临床工作中仍有部分患者被发现存在不同程度的血栓形成及脑梗死等合并症[2-3],称之为血小板高反应性(high on-treatment platelet reactivity,HTPR),目前有关介入后血栓形成与抗血小板药物的研究多集中在心血管疾病,关于脑血管病中改良抗血小板药物方案的研究及报道很少,有关高剂量抗血小板药物在血小板高反应性未破裂颅内动脉瘤介入栓塞中的疗效及安全性尚缺乏对照研究。本文旨在对比分析标准剂量抗血小板药物(阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d)与修改剂量(阿司匹林300 mg 1次/d+氯吡格雷75 mg 1次/d或阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d+西洛他唑100 mg 2次/d),为进一步明确抗血小板药物对存在HTPR的UIA介入术后患者的二级预防提供理论依据。
1 资料与方法
1.1 一般资料
入选2011年5月至2016年3月就诊于内蒙古民族大学第二临床医学院的行血管内介入治疗有HTPR的UIA患者166例。纳入标准:术前经电子计算机断层扫描(computed tomography, CT)血管造影、磁共振血管造影或数字减影血管造影技术检查确诊为UIA,经血小板功能分析存在HTPR且行血管内介入治疗患者。排除标准:存在抗血小板聚集药物禁忌证;近期使用了阿司匹林、氯吡格雷等抗血小板聚集药物者;近期使用了肝素、华法林等抗凝药物者;3个月内发生脑出血、消化道或其他器官出血者;凝血功能障碍,有出血倾向者。本研究患者签署知情同意书。将符合入组条件的166例患者按照就诊先后顺序编号,取随机数排序,按完全随机化法分为标准剂量组(n=83)和修改剂量组(n=83)。
1.2 治疗方法
入组患者在确诊为存在HTPR的UIA后择期行颅内未破裂动脉瘤介入栓塞术,并开始抗血小板药物治疗,分为标准剂量抗血小板药物组(按照缺血性脑血管病介入治疗抗血小板策略中国专家共识[4]给予阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d)与修改剂量组(阿司匹林血小板抵抗患者:阿司匹林300 mg 1次/d+氯吡格雷75 mg 1次/d或氯吡格雷血小板抵抗患者:阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d+西洛他唑100 mg 2次/d),术前药物治疗3 d,术后1个月。随访3个月。本研究采用阿司匹林肠溶片(拜阿司匹林,拜尔公司,德国);硫酸氢氯吡格雷片(波立维,赛诺菲安万特公司,法国);西洛他唑片(商品名培达,浙江大冢制药有限公司)。
1.3 血小板功能评价方法
采用VerifyNow检测仪检测患者血小板对阿司匹林抗血小板通路(aspirin reaction units,ARU)大于550或P2Y12受体反应单位(P2Y12reaction units,PRU)大于208为HTPR,采用光比浊法检测并分析血小板抑制率(inhibition of platelet aggregation,IPA),采用FACSCalibur流式细胞仪定量分析检测血小板反应指数(platelet reactivity index,PRI)。分别记录两组患者在入院第1天和术后第3天进行药物治疗前(0 h)和药物治疗后(1、3、7、12 h)的IPA、PRI和PRU。采用欧美专家共识的抗血小板治疗窗临界值评定出血和缺血事件相关的血小板反应性切点值[5]:出血事件临界值为PRI<16%、PRU<85或IPA≥64.5%,缺血事件临界值为PRU>208或PRI>50%。
1.4 疗效与安全性评价方法
疗效评价为不良缺血事件,由脑梗死和血管内血栓形成组成。脑梗死的诊断按照全国第4届脑血管病会议修订的诊断标准[6],且经磁共振平扫证实。血管内血栓形成均经术后CT血管造影或术后血管造影诊断为血管内血栓。
安全性评价为出血性事件,出血事件评估采用国际溶栓出血评估标准[7]评估主要不良心脑血管事件(major adverse cardiac and cerebrovascular events, MACCE)。并记录围术期及用药前后的不良事件。随访3个月。
1.5 统计学方法

2 结果
2.1 一般临床资料比较
两组患者年龄、性别、体质量指数(body mass index, BMI)、高血压病、糖尿病、血脂异常、脑血管病史、冠状动脉粥样硬化性心脏病(以下简称冠心病)史、抗血小板抵抗药物、血小板受体功能、动脉瘤最大直径、脑动脉斑块粥样硬化、动脉瘤位置、栓塞方式、栓塞情况和手术时间等指标差异均无统计学意义,详见表1。

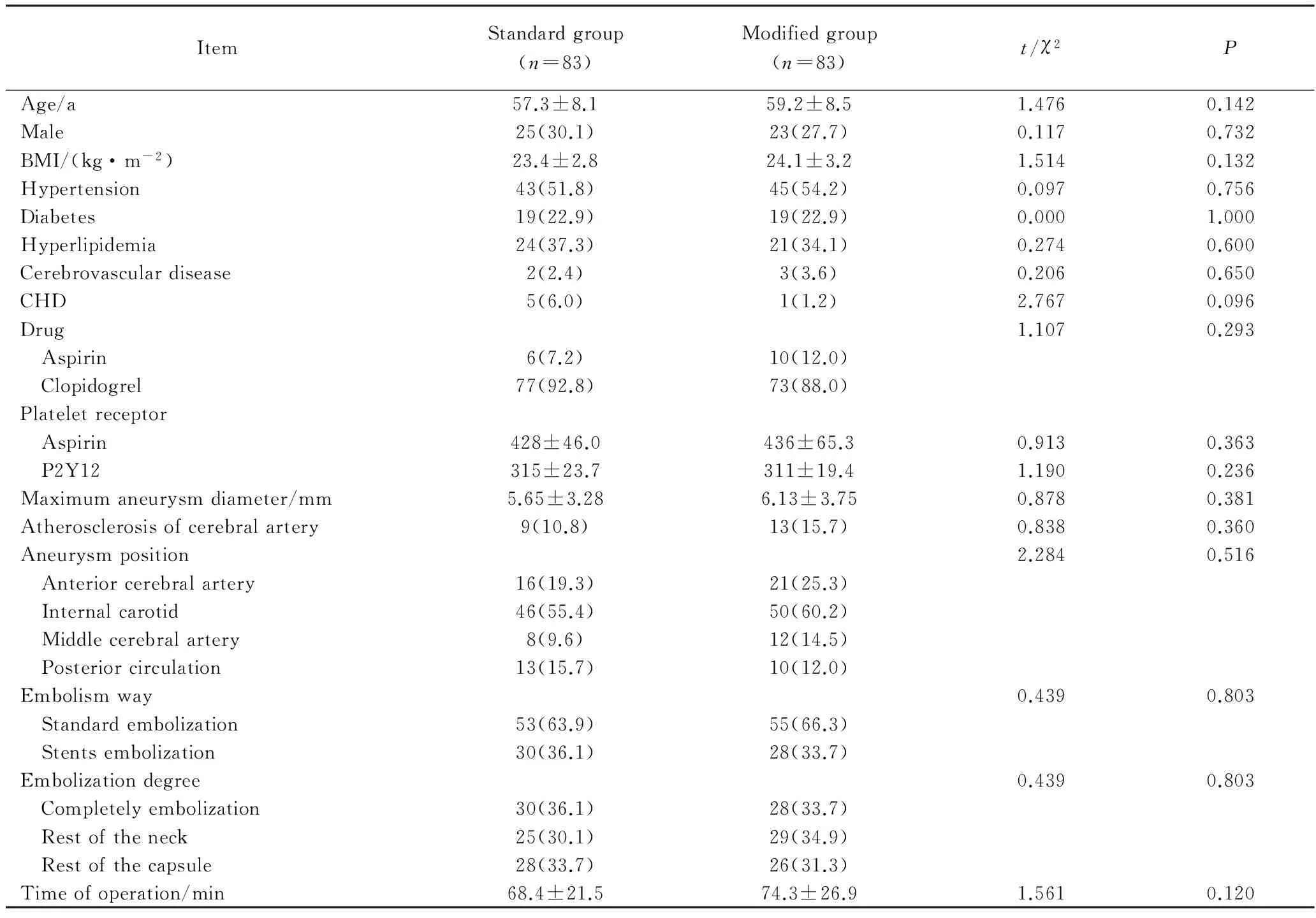
ItemStandardgroup(n=83)Modifiedgroup(n=83)t/χ2PAge/a57.3±8.159.2±8.51.4760.142Male25(30.1)23(27.7)0.1170.732BMI/(kg·m-2)23.4±2.824.1±3.21.5140.132Hypertension43(51.8)45(54.2)0.0970.756Diabetes19(22.9)19(22.9)0.0001.000Hyperlipidemia24(37.3)21(34.1)0.2740.600Cerebrovasculardisease2(2.4)3(3.6)0.2060.650CHD5(6.0)1(1.2)2.7670.096Drug1.1070.293 Aspirin6(7.2)10(12.0) Clopidogrel77(92.8)73(88.0)Plateletreceptor Aspirin428±46.0436±65.30.9130.363 P2Y12315±23.7311±19.41.1900.236Maximumaneurysmdiameter/mm5.65±3.286.13±3.750.8780.381Atherosclerosisofcerebralartery9(10.8)13(15.7)0.8380.360Aneurysmposition2.2840.516 Anteriorcerebralartery16(19.3)21(25.3) Internalcarotid46(55.4)50(60.2) Middlecerebralartery8(9.6)12(14.5) Posteriorcirculation13(15.7)10(12.0)Embolismway0.4390.803 Standardembolization53(63.9)55(66.3) Stentsembolization30(36.1)28(33.7)Embolizationdegree0.4390.803 Completelyembolization30(36.1)28(33.7) Restoftheneck25(30.1)29(34.9) Restofthecapsule28(33.7)26(31.3)Timeofoperation/min68.4±21.574.3±26.91.5610.120
BMI:body mass index;CHD:coronary heart disease.
2.2 两组患者服用药物治疗前后血小板功能比较
在服用研究药物后的各个时间点,术前和术后修改剂量组患者IPA高于标准剂量组,差异有统计学意义(均P<0.05)。修改剂量组患者PRU和PRI值均低于标准剂量组,且差异均有统计学意义(均P<0.05)。以高剂量抗血小板药治疗有HTPR的介入术后UIA患者对血小板的抑制作用优于标准剂量,且对血小板的抑制作用位于缺血和出血事件相关的血小板治疗窗内,见图1~3。
2.3 两组患者血栓和出血情况比较
修改剂量组较标准剂量组对有HTPR的介入术后UIA患者总不良缺血事件发生率和风险比(hazard rate, HR)显著降低(P=0.016),且脑梗死的发生率显著降低(P=0.030),其HR显著降低,虽然血管内血栓的发生率有所下降,但差异没有统计学意义(P=0.311)。两组患者的非操作性出血事件的发生率差异无统计学意义(P=0.514),详见表2。10例出血的患者中,其中消化道出血7例,脑出血3例。
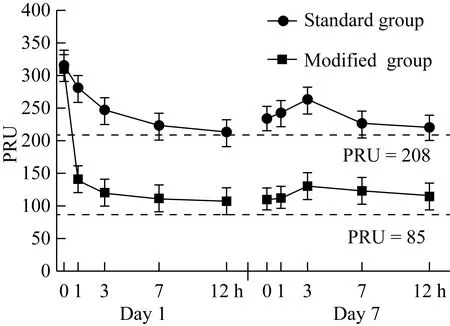
图1 两组患者PRU比较Fig.1 Comparison of PRU between the two groups
PRU:P2Y12reaction units.
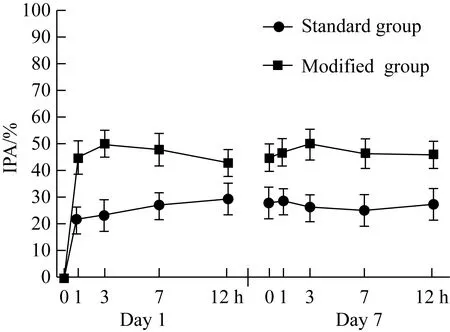
图2 两组患者IPA比较Fig.2 Comparison of IPA between the two groups
IPA:inhibition of platelet aggregation.
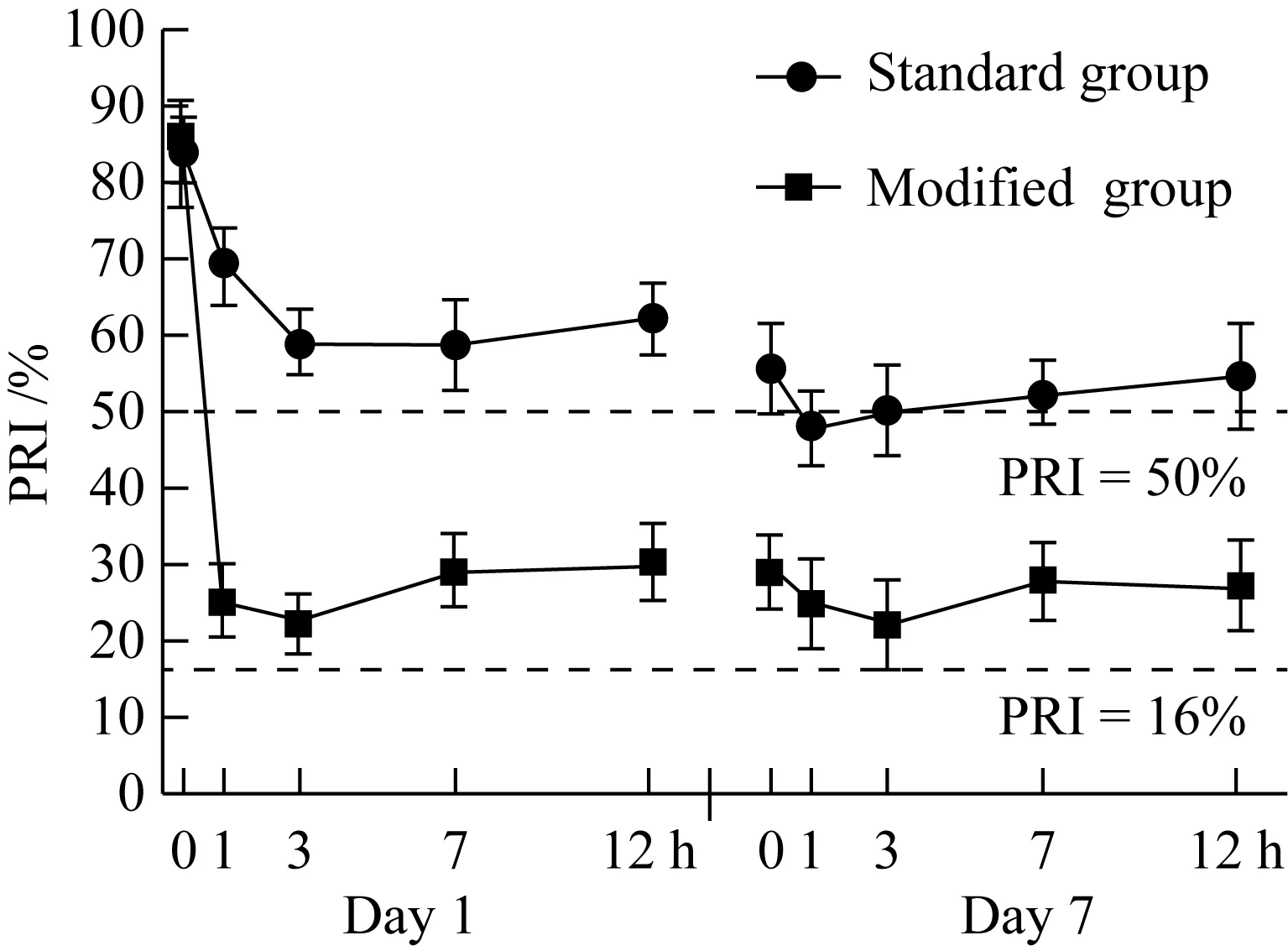
图3 两组患者PRI比较Fig.3 Comparison of PRI between the two groups
PRI:platelet reactivity index.

表2 两组患者血栓和出血情况比较Tab.2 Comparison of thrombotic events and bleeding events between the two groups n(%)
3 讨论
随着近年来血管内介入治疗技术的发展,血管内介入动脉瘤栓塞术为治疗颅内未破裂动脉瘤提供了可行的方案,关于无HTPR的UIA介入术后患者缺血性脑血管病介入治疗抗血小板策略中国专家共识[4]建议联合应用阿司匹林100 mg 1次/d+氯吡格雷75 mg 1次/d预防缺血事件的发生。关于有HTPR的UIA介入术后患者尚无明确的用药指南,仍需高剂量的抗血小板治疗,高于标准剂量以平衡缺血与出血事件发生的风险,更好的发挥二级预防的作用。
抗血小板药物治疗在预防血管内介入栓塞动脉瘤后脑梗死的发生中起积极的作用[8]。Seadon等[9]通过针对中国人群的抗血小板药物试验中发现对有脑梗死风险的患者采取加大阿司匹林剂量到300 mg/d可以降低32%的卒中发生率,且出血合并症差异无统计学意义。中国专家共识[4]建议如存在氯吡格雷抵抗,可以加用西洛他唑100 mg,2次/d。均与本研究的修改抗血小板药物剂量相同。Lin等[10]通过8个随机对照试验,包含3 865例患者进行的Meta分析结果表明:在有HTPR的患者中采用高剂量的抗血小板药物在改善主要终点事件方面的获益具有高度一致,主要心脑血管事件发生的风险,如脑血管卒中、支架内血栓形成及靶血管重建的风险均显著降低,主要出血风险的交互检验差异均无统计学意义。与本研究通过对有HTPR的UIA介入术后的缺血减少及出血事件差异无统计学意义的结果相同。
欧美专家共识[5,11]通过列举出血小板相关功能的临界值来预测缺血及出血风险,旨在通过评价血小板水平来反映抗血小板治疗用药的疗效,并使血小板抑制水平在治疗窗内,从而达到抗血小板治疗与减少出血事件的平衡。本研究结果表明高剂量的抗血小板治疗药物在有HTPR的UIA患者介入术后药物浓度达到稳定后,PRU及PRI值均低于缺血事件发生的切点值,且高于出血事件发生的切点值,提示抗血小板治疗有效且不易发生出血事件。而常规剂量组在药物浓度稳定后PRU及PRI均高于或接近血栓事件发生的切点值,提示有缺血事件发生的可能。修改剂量组的IPA均高于常规剂量组,且不易并发出血风险,IPA均小于出血临界点。
阿司匹林与氯吡格雷抗血小板聚集作用机制不同,其中阿司匹林主要通过抑制环氧化酶减少血栓素A2生成途径,从而产生抗血小板聚集作用,而氯吡格雷主要通过抑制二磷酸腺苷受体途径产生抗血小板聚集作用[12-14]。虽然这两种临床常用药物的作用机制不同,但临床中阿司匹林与氯吡格雷抵抗的事件却常有发生,且易引起缺血事件[15]。本研究采用3种血小板功能的检测方法(PRU、IPA及PRI)均表明在有HTPR的UIA介入术后患者在服用高剂量的抗血小板聚集药物后各个时点的血小板抑制水平明显高于标准剂量组,血小板高反应性发生率显著降低 (P<0.05)。随访3个月期间,修改剂量组与标准剂量组相比,总不良缺血事件的风险降低,且以脑梗死为主,差异有统计学意义,虽然血管内血栓发生率也有所降低,但差异无统计学意义,考虑可能是样本量不足的原因。虽然修改剂量组出血事件的发生率高于标准剂量组,但差异无统计学意义,其中消化道出血7例,脑出血3例,两处均为抗血小板药物引起出血的常见部位[16]。因此高剂量的抗血小板治疗在有HTPR的UIA介入术后患者中的安全性是值得肯定的,能更好地发挥二级预防作用。
本研究观察了高剂量抗血小板聚集药物在有HTPR的UIA介入术后患者抗血小板治疗中的有效性和安全性,结果表明修改剂量可以作为此类患者的理想选择,与标准剂量相比,在没增加出血事件及其他不良事件的基础上降低了缺血事件的发生率,但本研究入组样本量小且随访时间短影响了结论的可靠性,因此仍需要大样本、多中心的临床试验提供更多佐证。
[1] Pierot L, Wakhloo A K. Endovascular treatment of intracranial aneurysms: current status[J]. Stroke, 2013, 44(7): 2046-2054.
[2] Hong Y, Wang Y J, Deng Z, et al. Stent-assisted coiling versus coiling in treatment of intracranial aneurysm: a systematic review and meta-analysis[J]. PLoS One, 2014, 9(1): e82311.
[3] Chalouhi N, Jabbour P, Singhal S, et al. Stent-assisted coiling of intracranial aneurysms: predictors of complications, recanalization, and outcome in 508 cases[J]. Stroke, 2013, 44(5): 1348-1353.
[4] 中华预防医学会卒中预防与控制专业委员会介入学组. 缺血性脑血管病介入治疗抗血小板策略中国专家共识[J]. 中华医学杂志, 2015, 95(11): 803-809.
[5] Tantry U S, Bonello L, Aradi D, et, al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding[J]. J Am Coll Cardiol, 2013, 62(24): 2261-2273.
[6] 吴长鸿,刘斌.第四届全国脑血管病学术会议[J].中华医学信息导报,1996;29(6):376-381.
[7] Liu J, Xu Z Q, Cui M, et al.Assessing risk factors for major adverse cardiovascular and cerebrovascular events during the perioperative period of carotid angioplasty with stenting patients[J].Exp Ther Med, 2016, 12(2):1039-1047.
[8] Zammar S G, Hamade Y J, El Ahmadieh T Y, et, al. Pitfalls and complications management in the endovascular treatment of aneurysms[J]. Neurosurg Clin N Am, 2014, 25(3): 405-413.
[9] Seadon S, Lang E. Clopidogrel with aspirin versus aspirin alone in prevention of stroke following transient ischemic attack or acute minor stroke[J]. CJEM, 2015, 17(3): 315-317.
[10] Lin L, Wang H, Chen Y F, et, al. High maintenance dose of clopidogrel in patients with high on-treatment platelet reactivity after a percutaneous coronary intervention: a meta-analysis[J]. Oron Artery Dis, 2015, 26(5): 386-395.
[11] Aradi D, Storey R F, Komocsi A, et, al. Expert position paper on the role of platelet function testing in patients undergoing percutaneous coronary intervention[J]. Eur Heart J, 2014, 35(4): 209-215.
[12] Floyd C N, Ferro A. Mechanisms of aspirin resistance[J]. Pharmacol Ther, 2014, 141(1): 69-78.
[13] Le Quellec S, Bordet J C, Negrier C, et, al. Comparison of current platelet functional tests for the assessment of aspirin and clopidogrel response. A review of the literature[J]. Thromb Haemost, 2016, 116(4): 638-650.
[14] 唐蕊,赵明哲,庄向阳,等.阿司匹林联合小剂量氯吡格雷治疗75岁以上急性脑梗死临床效果观察[J].临床误诊误治,2015,28(8):85-88.
[15] Du G, Lin Q, Wang J. A brief review on the mechanisms of aspirin resistance[J]. Int J Cardiol, 2016,220: 21-26.
[16] Wehbeh A, Rochey D C, Barada K, et, al. Risks of bleeding recurrence and cardiovascular Events with continued aspirin use after lower gastrointestinal hemorrhage[J]. Gastroenterology, 2017, 152(3): 669-670.

