清毒汤对实验性重症肝损伤大鼠Bax蛋白及Bcl-2蛋白表达的影响
金 双 高连印 赵梦培 车念聪 张秋云 杜宇琼
(首都医科大学中医药学院中医临床基础学系 中医络病研究北京市重点实验室, 北京 100069)
慢性重型肝炎(chronic severe hepatitis,CSH)是以肝细胞的广泛变性、坏死,出现肝衰竭为主要特征的严重肝脏疾病[1]。研究[2]表明,CSH常伴随肠道通透性增高,导致内毒素大量入血,内毒素在加重肝损伤同时激活肝细胞线粒体凋亡途径诱导肝细胞凋亡。因此,在治疗上,除了挽救和修复严重损害的肝细胞,促进患者的肝细胞再生之外,抑制肝细胞的凋亡也是治疗CSH的重要环节[3]。清毒汤是王融冰教授治疗重症肝炎的经验方,具有清热解毒、滋阴通下的功能,能够改善CSH患者的症状和体征。前期研究[4-6]表明清毒汤临床治疗慢性重型肝炎安全有效,对模型大鼠有保肝、降低肠道通透性、抑制NF-κB活性的作用。本课题使用硫代乙酰胺(thioacetamide,TAA)灌胃建立重症肝损伤大鼠模型,运用Western blotting等技术分析肝细胞线粒体凋亡途径中关键分子Bcl-2、Bax蛋白的表达,用TUNEL法检测肝细胞凋亡指数(apoptotic index,AI)探讨清毒汤降低内毒素产生、抑制肝细胞线粒体凋亡通路减轻慢性重型肝炎的分子作用机制。
1 材料与方法
1.1 实验动物
Wistar大鼠72只,雌雄各36只,体质量190~210 g,实验动物许可证号: SCXK(京) 2012-0001。北京维通利华实验技术有限公司提供,饲养于首都医科大学基础科研楼动物实验中心SPF级动物房,分笼饲养,温度(22.0±1.0)℃,相对湿度(50.2±1.0)%,自由进食饮水。每隔12 h开灯照明。所有实验操作均经首都医科大学伦理委员会审核批准(批准文号:AEEI-2016-137)。
1.2 实验试剂
清毒汤药物组成: 大黄10 g、枳实10 g、厚朴10 g、玄参10 g、茜草9 g、生地黄12 g,上述药物均购自北京中医医院,由首都医科大学煎药室煎制,煎煮浓缩成生药质量浓度为1.6 g /mL 的水煎剂,分装,4℃冰箱保存备用,灌胃前水浴加热,摇匀。
TUNEL试剂盒(货号:11684817910,瑞士Roche公司);DAB显色剂(货号:K5007,丹麦DAKO公司);硫代乙酰胺(货号:S0646,北京科奥科技有限公司);乳果糖(货号:ka0009454,北京科奥科技有限公司);Bax抗体(货号:2772S,美国Cell Signaling Technology公司) ; Bcl-2 抗体(货号:SC-509,美国Santa Cruz公司) ;β-actin(货号:4967,美国Cell Signaling Technology公司)。
1.3 造模及给药
72只大鼠适应性喂养7 d后,采用Excel随机数字表随机分为正常组12只,造模组60只。本实验采用TAA诱导大鼠重度肝损伤模型[4]。前8周造模组予以TAA 12 mg· kg-1·d-1进行灌胃,正常组予以等量的0.9%(质量分数)氯化钠注射液灌胃。并在第8周末采用数字表法将所有造模组随机分为模型组乳果糖治疗组、清毒汤治疗组(小剂量、中剂量、大剂量组),每组12只。第9~12周,所有造模组大鼠将TAA的量增加至36 mg· kg-1·d-1,同时,乳果糖组则给予3.5 mL· kg-1·d-1的乳果糖;清毒汤小、中、大剂量组给予清毒汤生药制剂量分别为5.08、10.17、20.33 g· kg-1·d-1。正常组仍给予等量的0.9%(质量分数)氯化钠注射液。造模及治疗期间,所有动物在实验条件下自然饮食,在造模第12周末夜间禁食。
1.4 标本制备
造模过程中大鼠死亡15只,剩余大鼠57只。上述所有剩余大鼠在第12周末禁食10~12 h后,采用10%(质量分数)的水合氯醛进行腹腔注射麻醉,给药量为0.35 mL/100 g。开腹,腹主动脉无菌取血,缓慢注射于无菌真空采血管内,3 000 r/min,4℃,离心15 min,取其上清液分装,置于-80℃冰箱保存备用。取剩余肝组织在冰板上快速剪碎后分装于冻存管内,用液氮进行速冻,随后将组织移至-80℃冰箱存放。
1.5 指标检测
1.5.1 原位细胞凋亡检测(TUNEL法)
肝组织用10%(体积分数)甲醛溶液固定后进行石蜡包埋、切片,常规脱蜡、水化,按照TUNEL检测试剂盒说明书步骤进行操作。DAB显色,苏木素复染。6组各随机选5个高倍镜视野进行观察,每个视野计数100个肝细胞核。细胞凋亡指数(apoptotic index,AI)=凋亡细胞数/总细胞数×100%,最后计算凋亡细胞百分比的均数。
1.5.2 Western blotting法检测肝组织中Bax、Bcl-2 蛋白相对表达量
取适量肝组织冰上融化,细胞裂解液处理,离心后取上清,通过电泳将蛋白分开并转至硝酸纤维膜上,用含5%(质量分数)脱脂奶粉的TBST封闭1 h,Bax一抗(1∶1 000)、Bcl-2一抗(1∶200)37℃温育过夜,用TBST洗涤3次,每次10 min,二抗(1∶10 000),37℃温育1 h,TBST洗涤3次,每次10 min,滴加荧光底物发光显色。用Image Pro Plus进行灰度统计。
1.6 统计学方法

2 结果
2.1 肝组织TUNEL检测
本实验中凋亡细胞为棕黄色的圆形或卵圆形致密板块(图1箭头所示)。正常组基本未见细胞凋亡(图1A);模型组可见大量深褐色凋亡细胞(图1B);与模型组比较,乳果糖组和清毒汤各组凋亡细胞各有不同程度减少(图1C~F),其中中剂量和大剂量凋亡细胞减少更明显,详见表1。
TUNEL法检测细胞凋亡率要求样本量≥3只即可,此处根据大鼠各组剩余情况选择样本量为5只。

图1 肝组织TUNEL检测结果Fig.1 TUNEL detection of apoptotic rate in rat liver cell(400×)
A:normal control group;B:model group;C: lactulose group;D: small dosage group of Qingdu decoction;E: medium dosage group of Qingdu decoction;F: large dosage group of Qingdu decoction;Arrowshowed an apoptotic live cell;TUNEL:terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling.
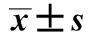
表1 各组大鼠肝细胞凋亡指数比较Tab.1 Comparison of apoptotic index ofrat liver cells in each group ()
*P<0.05,* *P<0.01vsnormal control group;△△P<0.01vsmodel group;▲▲P<0.01vslactulose group;QDTS: small dosage group of Qingdu decoction;QDTM: medium dosage group of Qingdu decoction;QDTL: large dosage group of Qingdu decoction;AI: apoptotic index,n=5 for each group.
2.2 清毒汤对肝细胞中Bax、Bcl-2 蛋白表达的影响
与正常组比较,模型组大鼠Bax蛋白相对表达水平升高(P<0.01),Bcl-2蛋白、Bcl-2/Bax比值降低(P<0.01);与模型组比较,所有治疗组(乳果糖组和清毒汤各组)Bcl-2蛋白表达量、Bcl-2/Bax比值升高(P<0.05或P<0.01),Bax蛋白相对表达水平下降(P<0.01),其中清毒汤中剂量组和大剂量组表现最明显,但是中、大剂量之间差异无统计学意义;与乳果糖组比较,清毒汤中剂量和大剂量Bcl-2蛋白相对表达量、Bcl-2/Bax比值增高(P<0.01),Bax蛋白相对表达量减低(P<0.01),但清毒汤中、大剂量组之间差异无统计学意义(图2、表2)。
Western blotting法在外文文献中要求样本量≥3只,而在中文文献中要求满足每组≥5只即可,所以此处每组选择 5 只。
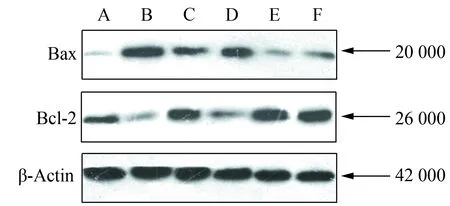
图2 各组大鼠肝组织Bax、Bcl-2蛋白表达Fig.2 Protein expressions of Bax,Bcl-2 inrats in each group
A:normal control group;B:model group;C: lactulose group;D: small dosage group of Qingdu decoction;E: medium dosage group of Qingdu decoction;F: large dosage group of Qingdu decoction.
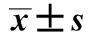
表2 各组大鼠肝组织Bcl-2、Bax蛋白的表达水平比较Tab.2 Comparision of protein expressions of Bax,Bcl-2 in rats in each group()
3 讨论
中医古籍中 “瘟黄”、 “急黄”、“肝瘟”等疾病的描述符合现代CSH的临床表现[7]。目前中医对该病的认识:本虚标实,因虚致实,“毒、瘀、虚”是关键具有普遍性[8];首都国医名师王融冰教授亦提出CSH病位在肝络,病机乃因虚致实,虚者肝体俱虚,多脏虚损,实者乃毒瘀胶着,邪气雍滞[5],受李梃“肝与大肠相通”理论启示,提出了“通肠治肝”治疗CSH的新思路,并创制了治疗本病新的中药方剂清毒汤。前期研究[4-6]证实清毒汤治疗TAA致重症肝损伤大鼠疗效显著。本次实验显示,清毒汤能够明显降低CSH大鼠病死率,提高大鼠的生存质量,与之前的结果一致。从TUNEL染色显示的结果看,清毒汤能够明显改善CSH大鼠肝细胞凋亡情况,从而达到保护肝功能的作用。
目前在已知的细胞凋亡的途径中,线粒体途径被公认为是细胞凋亡的中心环节[9-12]。而由 NF-κB 介导的 Bcl-2 家族蛋白被认为是线粒体凋亡途径中的主要调控蛋白[13]。Bcl-2蛋白和Bax蛋白都是Bcl-2 家族蛋白的重要组成部分,Bcl-2蛋白主要附着在线粒体膜上,当其与线粒体膜上的离子通道结合时可以调节Cyt-c的释放。另外,研究[14-15]显示Bcl-2能够降低线粒体复合物的活性,使线粒体内Cyt-c的含量减少,同时能够与凋亡肽酶激活因子结合,阻止线粒体内Cyt-c释放到胞质中,并且阻止Caspase被胞质中Cyt-c激活,阻断凋亡的发生。Bax 则能够促进线粒体内Cyt-c释放,具有拮抗 Bcl-2 蛋白抑制细胞凋亡的作用,最终促进细胞的凋亡。Bcl-2 的抗凋亡效应及 Bax 的促凋亡效应已得到普遍认可,而Bcl-2、Bax 的比值对细胞凋亡机制也有重要影响,提高 Bcl-2/Bax 的比值,可抑制细胞凋亡,而降低 Bcl-2/Bax 的比值,则会促进细胞凋亡。
本实验结果显示,模型组肝组织Bax蛋白表达量较正常组显著升高,Bcl-2蛋白表达量较正常组显著降低,而各治疗组(乳果糖组、清毒汤大、中、小剂量组)Bax蛋白及Bcl-2蛋白水平较模型组分别有不同程度降低和升高,其中清毒汤中剂量组表现最明显。
同时,各治疗组大鼠肝组织TUNEL的病理检测结果提示清毒汤中、大剂量组较模型组肝细胞凋亡数量显著减少,但清毒汤中、大剂量组间差异无统计学意义。故推测清毒汤方可能通过调控Bcl-2、Bax蛋白的表达来减轻肝细胞的凋亡,从而改善肝脏病理结构,达到保护肝脏的作用,这些结果为本方临床治疗CSH疾病提供了依据。
[1] Quarato G, Scrima R, Aqriesti F, et al. Targeting mitochondria in the infection strategy of the hepatitis C virus[J]. Int J Biochem Cell Biol,2013, 45(1): 156-166.
[2] 王文递,林雅玲,宋彬妤,等.内毒素在肝胰岛素抵抗中对肝细胞线粒体功能的影响[J].中国医药导报,2017,14(12):33-38.
[3] 刘海成,闰秀川,刘平,等.基于肝细胞凋亡与网状支架破坏探讨抗肝纤维化中药的作用机制与治法特点[J]. 世界科学技术-中医药现代化, 2007,9(6):40-45.
[4] 罗佳佳,高连印,金双,等.清毒汤对重症肝损伤大鼠肠道黏膜通透性的影响[J]. 环球中医药, 2017,10(3):261-264.
[5] 曹吴冰,高连印,车念聪,等. 清毒汤对实验性重症肝损伤大鼠内毒素及D-乳酸表达的影响[J]. 环球中医药, 2015,8(11):1333-1336.
[6] 曹吴冰,高连印,车念聪,等. 清毒汤对实验性重症肝损伤大鼠肿瘤坏死因子α及核转录因子κB表达的影响[J]. 环球中医药, 2015,8(10):1186-1189.
[7] 官志杰,韦艾凌,毛德文,等.慢性重型肝炎的“毒、浊”致病机制[J].时珍国医国药,2014,25(1):148-149.
[8] 胡建华,李晓东,姚乃礼,等.中医药诊治慢性重型肝炎研究进展述评[J].中西医结合肝病杂志,2013,23(2):125-128.
[9] 张如意,张丽,李林.线粒体功能障碍、α-突触核蛋白与帕金森病[J].首都医科大学学报,2015,36(6):861-864.
[10] 岳志伟,刘强,陈乃耀.创伤性脑损伤和线粒体功能障碍[J].中国煤炭工业医学杂志,2016,19(4):645-650.
[11] 熊瑞媛, 田炜,杨方.细胞凋亡途径在心肌缺血/再灌注损伤中的研究进展[J].中国煤炭工业医学杂志,2015,18(3):512-515.
[12] 蒙萍,王宁,漆欣柱,等.模拟海拔8000m高原缺氧环境对大鼠脑组织线粒体自噬的影响[J].解放军医药杂志,2016,28(6):9-13.
[13] Bonneau B, Prudent J, Popqeorgiev N, et al. Non-apoptotic roles of Bcl-2 family: the calcium connection[J]. Biochim Biophys Acta, 2013,1833(7): 1755-1765.
[14] 王林,潘晓涛,耿智敏,等.RNA干扰Bcl-2基因表达对人胆囊癌细胞株GBC-SD裸鼠移植瘤生长的影响[J]. 西安交通大学学报:医学版,2009,30(11):93-96.
[15] Zhang H, Li Q, Li Z, et al. The protection of Bcl-2 over expression on rat cortical neuronal injury caused by analogous ischemia/reperfusion in vitro[J]. Neurosci Res, 2008, 62(2): 140-146.

