细胞因子和免疫球蛋白抗体在过敏性鼻炎小鼠早期无症状阶段和晚期有症状阶段表达的差异
杨 军 王 敏 张 罗,2*
(1. 首都医科大学附属北京同仁医院耳鼻咽喉头颈外科 北京市耳鼻咽喉科研究所 教育部耳鼻咽喉头颈科学重点实验室 鼻病研究北京市重点实验室,北京 100730;2. 首都医科大学附属北京同仁医院鼻过敏科,北京 100730)
过敏性鼻炎(allergic rhinitis, AR)是一种由接触过敏原所导致的以打喷嚏、鼻痒、鼻堵和流鼻涕为主要症状的疾病。AR是最常见的过敏性疾病之一,世界范围内的发病率最高可达40%,且有逐年上升的趋势[1-2]。
Th2反应和过敏原特异性IgE的生成是AR的主要特征[3-4]。除此之外,很多因子参与了AR的发生。以往研究[5-10]报道过敏原特异性IgG1和IgG2a抗体的生成[5]、Th17细胞因子白细胞介素(interleukin-17,IL-17)[6-8]和前炎性反应因子IL-6[9-10]参与了AR的发病。AR的发病是个动态过程,在早期临床过敏症状出现之前已发生了多种免疫反应,上述免疫因子在此阶段变化如何,以及与过敏症状的关系如何,目前尚不清楚。
本研究通过建立卵清蛋白(ovalbumin, OVA)诱导的AR小鼠模型观察激发早期和激发晚期上述细胞因子和免疫球蛋白抗体表达的差异,以探讨AR早期无症状阶段和晚期有症状阶段上述免疫反应的异同,这将有助于对AR发病机制的理解。
1 材料与方法
1.1 实验动物
SPF级BALB/c雄性小鼠,7~8周龄,体质量20~25 g,由北京大学医学部提供,实验动物合格证号:SCXK(京)2016-0010。
1.2 OVA-诱导的AR小鼠模型的建立及实验方案
用BALB/c小鼠进行AR 动物模型的建立,具体建模方案同参考文献[11]。简单过程为在第1天和第7天用含50 μg OVA和5 mg Al(OH)3的400 μL 0.9%(质量分数)氯化钠注射液溶液进行致敏性腹腔内注射; 14 d后连续3周每周3 d鼻局部给予含50 μg OVA的 0.9%(质量分数)氯化钠注射液溶液20 μL进行激发。采用数字表法将实验动物随机分为3组,对照组、激发早期组和激发晚期组。对照组为用 0.9%(质量分数)氯化钠注射液代替OVA致敏和激发,在第30天 0.9%(质量分数)氯化钠注射液激发结束后2 h处理6只小鼠;激发早期组为在第16 天OVA激发结束后2 h处理6只小鼠;激发晚期组为在第30 天OVA激发结束后2 h处理6只小鼠。收集血清和鼻黏膜,鼻黏膜用于提取RNA,血清用于细胞因子和免疫球蛋白抗体检测,详见图1。
1.3 鼻部过敏症状的检测
最后一次激发后,立即计数20 min内挠鼻和喷嚏的次数,然后取平均值。
1.4 血清 OVA特异性IgE和IgG抗体检测
血清OVA特异性IgE、IgG1和IgG2a抗体用ELISA法检测,具体方法参考文献[12]。96孔板用100 μL 10 g/L OVA包被,4 ℃过夜,然后用含4%(质量分数)BSA 的 PBS室温封闭1 h。加入100 μL血清样品室温孵育2 h,用含0.05%(体积分数)Tween 20的PBS 洗涤后,然后加入辣根过氧化物酶标记的抗小鼠IgE (1∶4 000)、IgG1 (1∶5 000)或IgG2a (1∶5 000) (Southern Biotechnology Associates, Inc., Birmingham, AL, 美国) 室温孵育2 h。洗涤后用100 μL四甲基联苯胺(Sigma-Aldrich)显色。
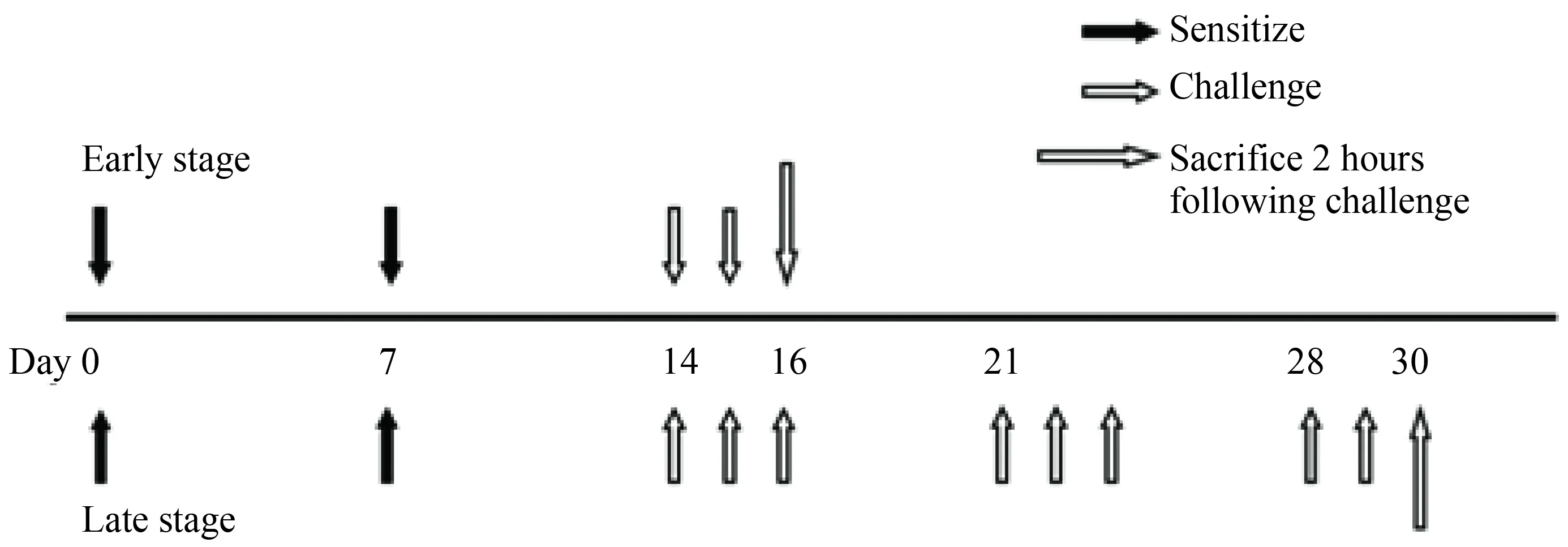
图1 AR小鼠模型的建立和实验方案Fig.1 AR mouse model and experimental protocolAR: allergic rhinitis.
1.5 Real-time PCR检测
用Trizol(Invitrogen公司., 美国)提取鼻黏膜组织总RNA,Oligo(dt)反转录成cDNA。然后用Real-time PCR法检测鼻黏膜干扰素-γ(interferon-γ,IFN-γ),IL-4,IL-17和IL-6基因表达。所用染料为Platinum SYBR Green q PCR SuperMixUDG,购自美国Invitrogen公司,仪器为Rotor-GeneTM6200 HRM (Corbett Life Science, 澳大利亚)。引物序列见表1。结果用Delta Delta Ct法分析。
1.6 血清细胞因子检测
血清细胞因子用小鼠Th1/Th2/Th17 cytometric bead array kit (BD PharMingen, La Jolla, CA, 美国) 检测。
1.7 统计学方法

2 结果
2.1 3组小鼠鼻部症状比较
挠鼻和打喷嚏是过敏性鼻炎的主要症状。挠鼻和打喷嚏次数在晚期激发组显著高于早期激发组和
对照组,差异有统计学意义(P<0.05)。但在早期激发组和对照组比较,差异无统计学意义(P>0.05,图2)。
2.2 血清OVA-特异性IgE、IgG1和IgG2a浓度
血清OVA-特异性IgE, IgG1和IgG2a浓度在早期激发组和晚期激发组均显著增高,且过敏原特异性IgG1和IgG2a在晚期激发组显著高于早期激发组,差异有统计学意义(P<0.05,图3)。
2.3 鼻黏膜IFN-γ、L-4、IL-17和IL-6基因的表达
鼻黏膜IFN-γ基因(Th1因子)在3组间表达,差异无统计学意义(P<0.05)。IL-4基因(Th2因子)在晚期激发组表达显著高于对照组;IL-17(Th17细胞因子)和前炎性因子IL-6基因在早期激发组和晚期激发组表达均显著增高,且在晚期激发组的表达显著高于早期激发组,差异有统计学意义(P<0.05,图4)。
2.4 血清IFN-γ、L-4、IL-17和IL-6蛋白的表达
血清Th1因子IFN-γ在3组间表达差异无统计学意义(P>0.05);Th2因子IL-4在晚期激发组表达显著高于对照组和早期激发组;Th17细胞因子IL-17和前炎性因子IL-6在早期激发组和晚期激发组小鼠均显著增高,且在晚期激发组的表达显著高于早期激发组差异有统计学意义(P<0.05,图5)。
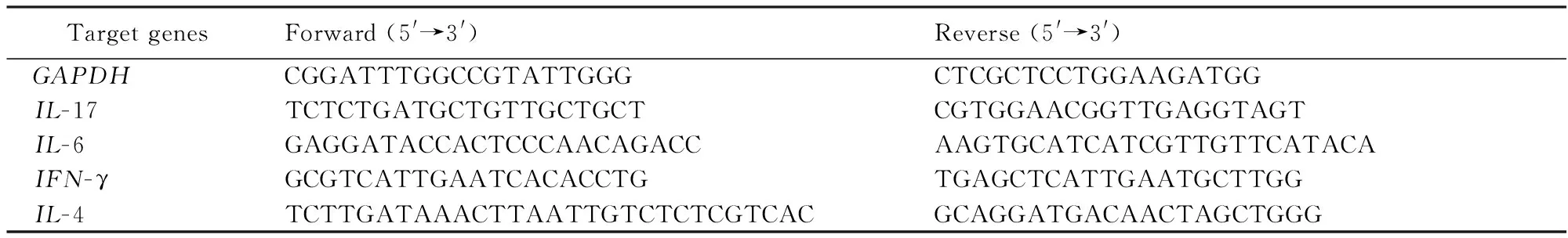
表1 实时定量PCR引物序列Tab. 1 Primers used for quantitative real-time PCR
IL:interleukin;IFN:interferon.
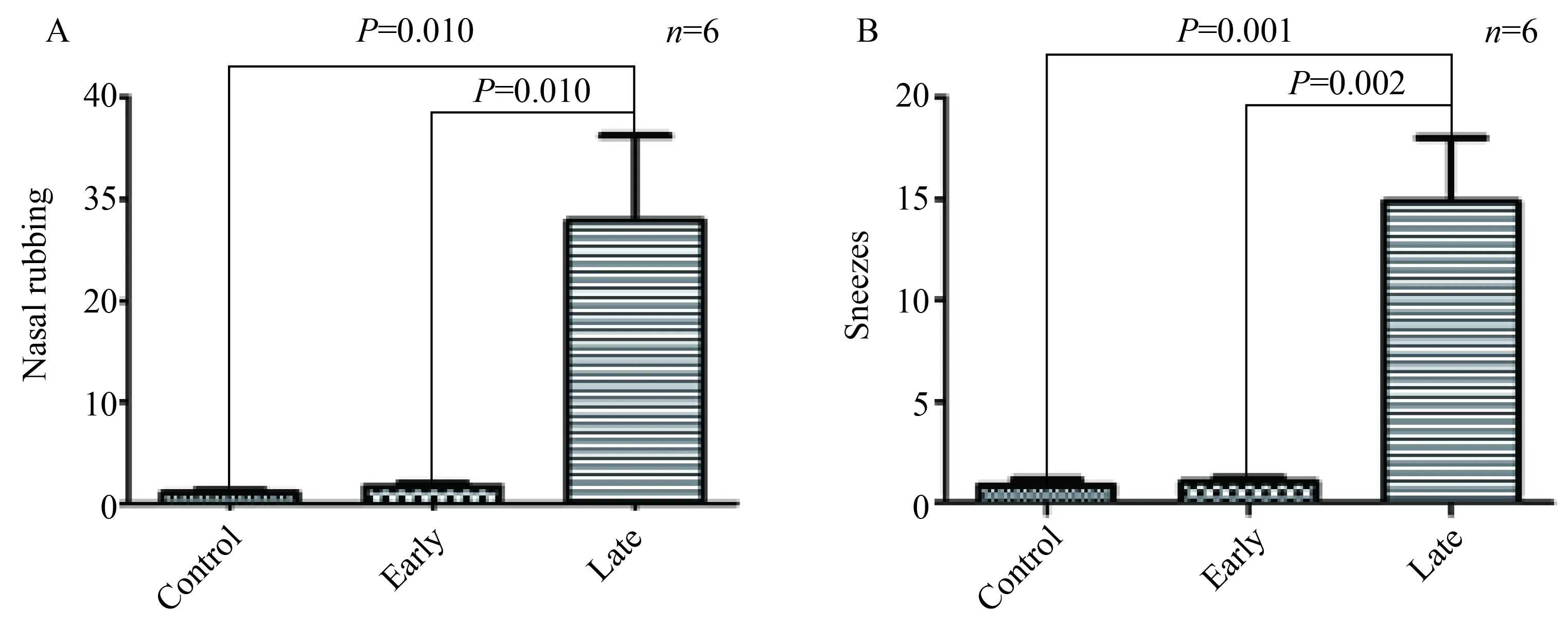
图2 3组小鼠鼻部症状比较Fig.2 Comparison of the nasal symptoms among three groupsA:nasal rubbing; B:sneeze.
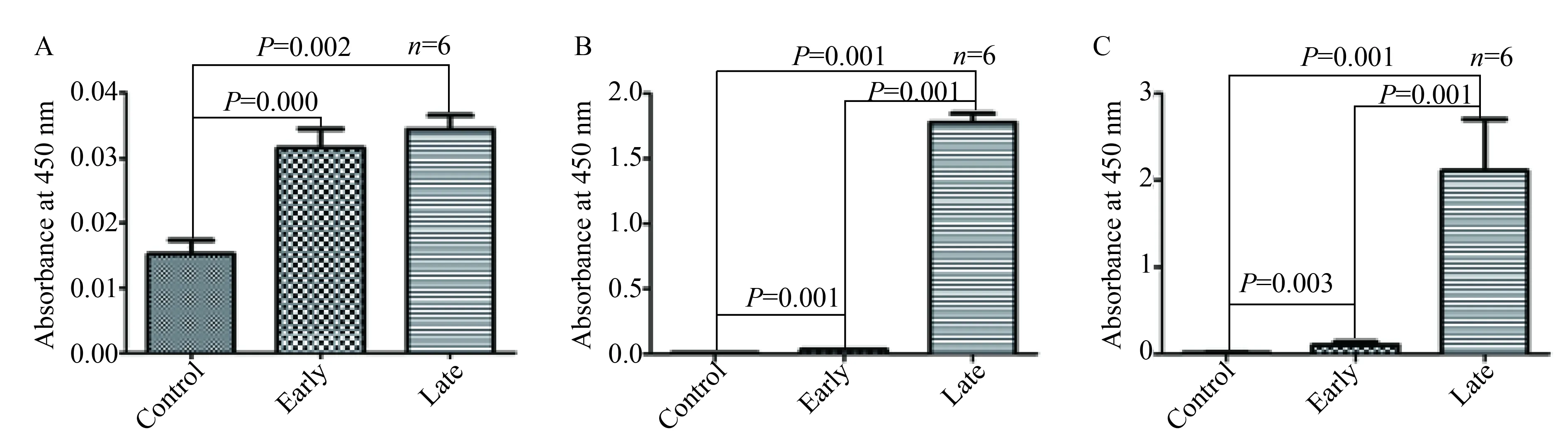
图3 血清OVA-特异性IgE, IgG1和IgG2a浓度Fig.3 Serum OVA-specific IgE, IgG1 and IgG2aA:OVA-specifie IgE;B:OVA-specifie IgG1;C:OVA-specifie IgG2a;OVA:ovalbumin.
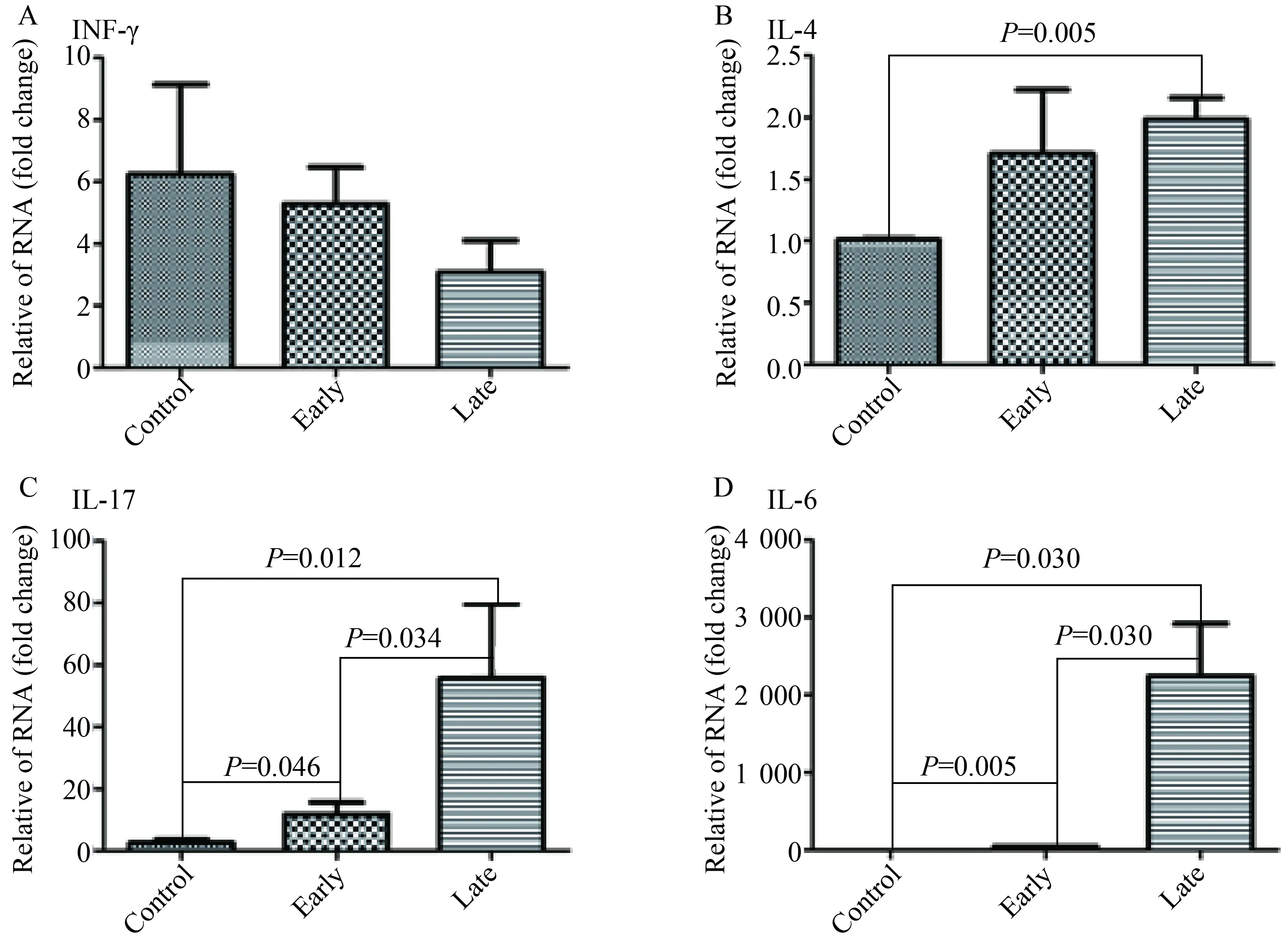
图4 鼻黏膜IFN-γ, IL-4, IL-17和IL-6基因的表达Fig.4 Gene expression of cytokines in nasal mucosaA:IFN-γ; B:IL-4;C:IL-17;D:IL-6; IFN:interferon; IL:interleukin.
3 讨论
Th2、Th17反应和过敏原特异性IgE、IgG1和IgG2a的生成与AR有关,但是这些免疫因子是否参与了AR早期无症状阶段免疫反应,及与临床过敏症状的关系如何,目前尚不清楚。为了探讨此问题,本研究观察了OVA诱导的AR小鼠激发早期和晚期阶段鼻部过敏症状和这些免疫因子表达的变化。
本研究中OVA诱导AR小鼠模型激发早期阶段没有出现鼻部过敏症状,激发晚期阶段出现明显的鼻部过敏症状,所以用此激发早期和晚期阶段分别代表AR早期无症状和AR晚期有症状阶段。AR主要是Th2反应[12],本研究证实激发晚期有症状阶段鼻黏膜IL-4基因表达和血清IL-4水平均显著增高。尽管血清IL-4水平在激发晚期显著高于激发早期和对照,但鼻黏膜IL-4基因表达无此趋势,因此IL-4与过敏症状出现的是否有关还有待进一步证实。鼻黏膜IFN-γ基因表达和血清IFN-γ蛋白水平在激发早期和晚期阶段均未出现显著变化,提示Th1反应与AR早期无症状和晚期有症状阶段均无关。
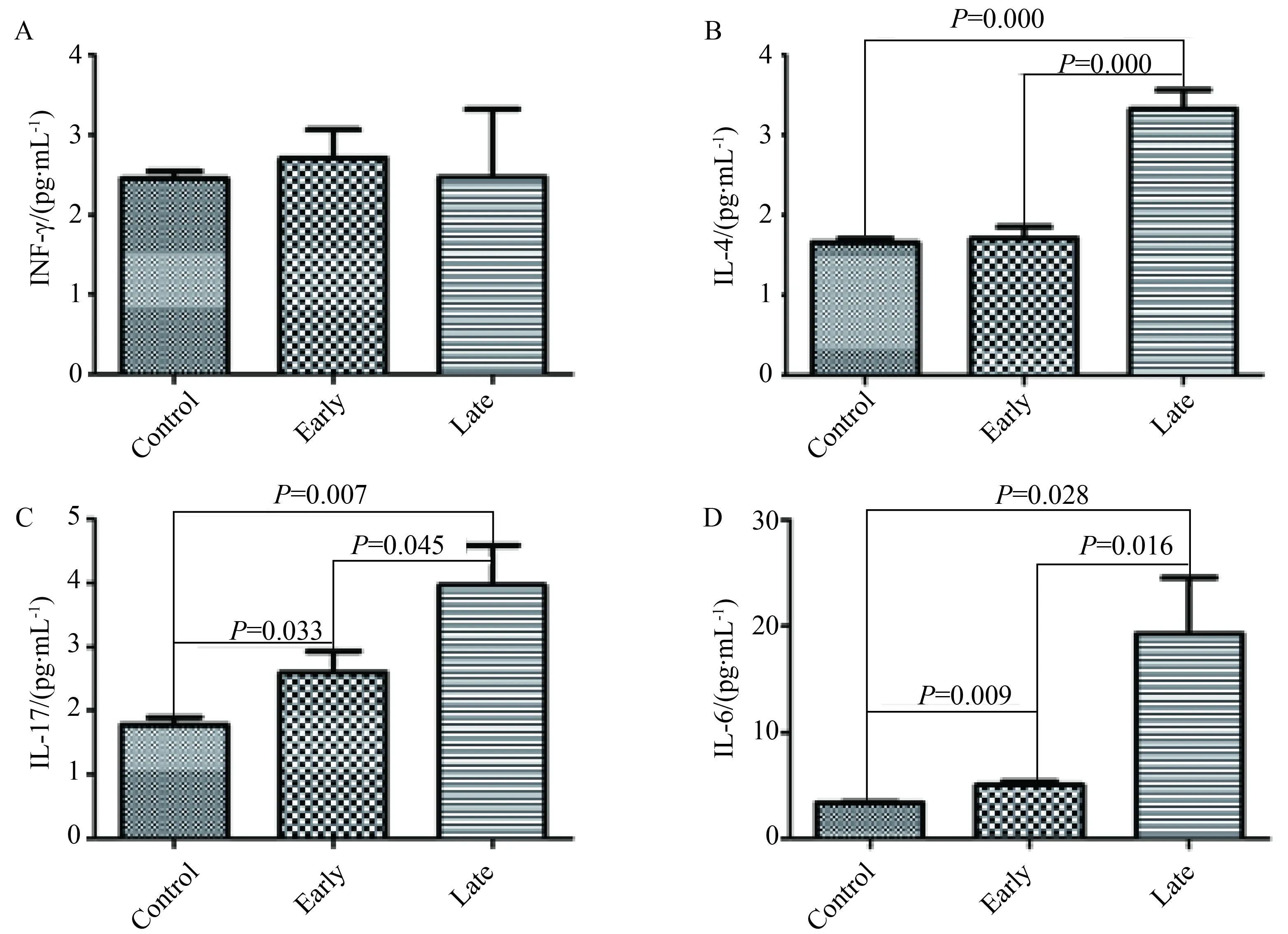
图5 血清IFN-γ, IL-4, IL-17和IL-6蛋白的表达Fig.5 Protein expression of cytokine in SerumA:IFN-γ; B:IL-4;C:IL-17;D:IL-6; IFN:interferon; IL:interleukin.
过敏原特异性IgE的生成是AR的主要特征之一,有研究[13]显示IgE的致敏程度和过敏症状出现的风险呈正比。本研究发现OVA-特异性IgE在AR早期没有出现症状前也显著升高,但在早期无症状阶段和晚期有症状阶段差异无统计学意义(P>0.05),因此不能证明过敏症状与过敏原特异性IgE有关。与以往研究[5]一致,本研究结果显示OVA-特异性IgG1和IgG2a在AR晚期有症状阶段显著增高;而且这两种免疫球蛋白抗体在早期无症状阶段即有显著增高,尽管显著低于晚期有症状阶段。这些结果表明OVA-特异性IgG1和IgG2a可能参与了AR早期无症状阶段的反应,且可能与鼻部过敏症状的出现有关。
以往研究[9-10]显示前炎性因子IL-6参与了AR的发生。本研究中,IL-6在AR早期无症状阶段和晚期有症状阶段均显著增高,且晚期有症状阶段显著高于早期无症状阶段,提示IL-6可能参与了AR早期无症状阶段的反应,且其表达水平可能与过敏症状的出现有关。然而,IL-6是一种多功能的细胞因子,由多种细胞(如抗原提呈细胞、内皮细胞、成纤维细胞、单核细胞和巨噬细胞)在多种刺激下生成。因此,IL-6如何影响过敏症状的发生还有待进一步研究。
IL-17(也称为IL-17A)是IL-17家族的一员,主要由Th17细胞亚群生成[14]。有研究[15]显示IL-17缺陷小鼠的过敏症状、血清IgE、嗜酸浸润、组胺和白三烯的释放均显著降低,说明IL-17参与了AR的发生。本研究中,激发早期阶段鼻黏膜IL-17基因表达和血浆IL-17浓度显著升高,提示IL-17可能也参与了AR早期无症状阶段的反应。有研究[8]报道血清IL-17浓度与临床症状有关,与此一致,本研究发现鼻黏膜IL-17基因表达和血浆IL-17浓度在激发晚期阶段显著高于激发早期阶段,这些证据支持IL-17表达可能与过敏症状有关。IL-17与IL-6表达趋势相似,而IL-6的功能之一是促进Th17细胞的分化和IL-17的生成[16-17],因此IL-6与过敏症状的关系可能是通过促进IL-17生成发挥作用。
总之,本研究结果提示IL-17、IL-6和过敏原特异性IgG1和IgG2a抗体可能参与了AR早期无症状阶段的反应,且其表达水平可能与过敏症状的出现有关。
[1] Bousquet J, Khaltaev N, Cruz A A,et al. Allergic rhinitis and its impact on asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen)[J].Allergy, 2008,63(Suppl 86):8-160.
[2] Wang X D, Zheng M, Lou H F,et al. An increased prevalence of self-reported allergic rhinitis in major chinese cities from 2005 to 2011[J]. Allergy, 2016,71(8):1170-1180.
[3] Hansen I, Klimek L, Mösges R, et al. Mediators of inflammation in the early and the late phase of allergic rhinitis[J]. Curr Opin Allergy Clin Immunol, 2004,4(3):159-163.
[4] Dullaers M, De Bruyne R, Ramadani F, et al. The who, where, and when of IgE in allergic airway disease[J]. J Allergy Clin Immunol,2012,129(3):635-645.
[5] Cho K S, Park H K, Park H Y, et al. IFATS collection:Immunomodulatory effects of adipose tissue-derived stem cells in an allergic rhinitis mouse model[J]. Stem Cells, 2009,27(1):259-265.
[6] Semik-Orzech A, Barczyk A, Wiaderkiewicz R, et al. Interleukin 17 and RANTES levels in induced sputum of patients with allergic rhinitis after a single nasal allergen challenge[J]. Ann Allergy Asthma Immunol, 2009,103(5):418-424.
[7] Ciprandi G, Fenoglio D, De Amici M, et al. Serum IL-17 levels in patients with allergic rhinitis[J]. J Allergy Clin Immunol, 2008,122(3):650-651.e2.
[8] Ciprandi G, De Amici M, Murdaca G, et al. Serum interleukin-17 levels are related to clinical severity in allergic rhinitis[J]. Allergy, 2009,64(9):1375-1378.
[9] Petti F B,Liguori A, Ippoliti F. Study on cytokines IL-2, IL-6, IL-10 in patients of chronic allergic rhinitis treated with acupuncture[J]. J Tradit Chin Med, 2002,22(2):104-111.
[10] Hsueh K C, Lin C Y, Lin Y J. Serum levels of resistin in allergic rhinitis and its relationship with disease severity[J]. Am J Rhinol Allergy, 2009,23(4):365-369.
[11] Wang M, Zhang W, Shang J, et al.Immunomodulatory effects of IL-23 and IL-17 in a mouse model of allergic rhinitis[J]. Clin Exp Allergy, 2013,43(8):956-966.
[12] Galli S J, Tsai M, Piliponsky A M. The development of allergic inflammation[J]. Nature, 2008,454(7203):445-454.
[13] Bousquet J, Anto J M, Bachert C, et al. Factors responsible for differences between asymptomatic subjects and patients presenting an IgE sensitization to allergens. A GA2LEN project[J].Allergy,2006,61(6):671-680.
[14] Iwakura Y, Ishigame H, Saijo S, et al. Functional specialization of interleukin-17 family members[J]. Immunity, 2011,34(2):149-162.
[15] Braunstahl G J, Fokkens W J, Overbeek S E, et al. Mucosal and systemic inflammatory changes in allergic rhinitis and asthma: a comparison between upper and lower airways[J]. Clin Exp Allergy, 2003,33(5):579-587.
[16] Burgler S, Ouaked N, Bassin C, et al. Differentiation and functional analysis of human T(H)17 cells[J]. J Allergy Clin Immunol, 2009,123(3):588-595, 595.e1-7.
[17] 马思琪, 闫宇,佟凤娇,等.白细胞介素-17A诱导脂肪细胞中炎症因子表达[J].中国煤炭工业医学杂志,2017,20(2):186-189.

