3D-SnO2/改性海泡石的制备及其光催化降解染料
谭正德, 湛日梦, 詹晨晨, 曾钰坤, 区泽棠
(湖南工程学院 化学化工学院,湖南 湘潭 411104)
0 引 言
染料废水已经成为当前最主要的水体污染源之一,能否解决印染行业的污染问题已经成为实现印染行业可持续发展的前提重要条件[1]。光催化降解染料废水技术主要是以半导体为光催化剂,利用光催化氧化有毒污染物使之终极产物以CO2、H2O及其他一些无毒无害物质进入生态环境,是一种绿色、环保并且应用前景广阔的节能技术。
SnO2禁带宽度为3.6 eV[2],具有良好的紫外光催化降解性能,已成为染料废水光催化降解研究领域的热点。单独使用SnO2作为光催化剂降解染料废水,SnO2在溶液中易流失,难回收,效率低;负载型SnO2催化剂解决了以上缺点,成为半导体光催化领域新热点。目前,二氧化锡常用的载体有碳纳米管[3]、金属类[4-5](如Au、Ag、泡沫镍等)、活性炭[6-7]、玻璃类[8-9](如空心玻璃、玻璃纤维)、沸石[10]等。而3D结构的SnO2具有独特的空间结构、比表面积,在催化剂的表面上提供了更多的电子-空穴对,催化效率得以提升。Malik等[11-14]通过表面活性剂辅助水热法制备了三维分级结构的多孔SnO2纳米、微波水热法制备了均匀的SnO2多层核壳微球、水热法合成了核桃状SnO2纳米球、紫外光辅助合成了珊瑚状SnO2微球等系列催化剂,同时对玫瑰红、罗丹明B、亚甲橙、甲基橙等模拟废水进行可见光光催化性能研究及回收率的探讨。
载体海泡石是一种富镁内部含有大量纤维成分的黏土矿,其化学式为Mg8(H2O)4[Si6O15](OH)4·8H2O[15],它具有两层硅氧四面体,在两层四面体的中间是一层镁氧八面体[16]。海泡石廉价易得,湖南湘潭地区的海泡石储量占全国的4/5,自身存在很多碱性中心(MgO6)和酸性中心(SiO4),反应物被吸附后易极化、活化,可促进光降解[17]。但天然海泡石中杂质较多,部分微孔孔道出现堵塞,改性海泡石目的是除杂、改善微结构,比表面积增大[18],提升吸附性能,为纳米SnO2的键合与负载提供支撑。利用这一效应,可望使催化剂的稳定性、光催化活性、比表面积改良19]。
以五水四氯化锡为锡源,以改性海泡石为载体,超声溶胶凝胶法,制备3D-SnO2/改性海泡石光催化剂,本文重点研究了3D-SnO2/改性海泡石的制备条件对甲基橙溶液的光催化降解性能。
1 材料与方法
1.1 材料与仪器
实验所用材料是分析纯的SnCl4·5H2O、浓盐酸(HCl)、浓硝酸(HNO3)、浓氨水(NH3·H2O)、蒸馏水、OP乳化剂、海泡石等。所有材料不经二次提纯直接使用,溶液采用蒸馏水配制。
1.2 实验方法
1.2.1海泡石的改性
称取45.0 g海泡石,加入450 mL蒸馏水和31.5 mL浓硝酸,搅拌4 h后抽滤,在105 ℃下活化2 h,研磨[14]。
1.2.23D-SnO2/改性海泡石的制备
称取3.0 g SnCl4·5H2O,加入20 mL蒸馏水和0.01 mL浓HCl,搅拌至溶液澄清,然后加入一定量的氨水,调节溶液pH7.0~8.0,超声波分散1 h后得到白色溶胶;在溶胶中加入3.0 g改性海泡石,搅拌2 h后静置陈化18 h,然后洗涤、干燥得到前驱体,将前驱体置于马弗炉中,在480 ℃温度下焙烧2 h,得到改性海泡石负载的3D-SnO2,命名为SnO2/改性海泡石。
1.2.33D-SnO2/改性海泡石的表征
采用日本理学Rigaku-TTRIII X射线衍射仪(Cu Kα靶,λ=0.154 056 nm)对样品进行物相分析(XRD);采用日本日立公司的SU3500型扫描电子显微镜观察样品的表面形貌特征(SEM);采用美国Micromeritics公司生产的ASAP2020型比表面测定仪(BET)测定3D-SnO2/改性海泡石的比表面积、孔径分布等物理特征,测定所用气体为氮气,吸附温度为77.5 K。
1.2.4光催化降解率的测定
配制20 mg/L甲基橙溶液,用722S可见光分光光度计,在最大吸收波长(460 nm)下测得其初始吸光度A0,在80 mL烧杯中加入25 mL的2 mg/L甲基橙红溶液,再加入一定量的光催化剂,黑暗中磁力搅拌1 h达到吸附平衡后,将处理好的样品经太阳光光照,每隔一段时间取一次样,每次取样10 mL,高速离心(11 500 r/min)分离后,取离心清液,在最大吸收波长460 nm下测定其吸光度A,计算甲基橙溶液的降解率,从而定量催化剂的光催化活性。
式中:D表示降解率;A0表示光照前甲基橙溶液的吸光度;A表示光照后甲基橙溶液的吸光度。
2 结果与分析
由图1可以看出,不同pH对3D-SnO2/改性海泡石的晶型没有发生太大的改变。其衍射角度在26.6°、34.1°、52.0°分别对应晶面(110)、(101)、(211)晶相。根据JCCDF no.1-1445与正方晶系金红石结构的特征一致[20],且衍射峰型尖锐,说明SnO2结晶良好。

图1 不同pH值15%3DSnO2/改性海泡石的XRD图
由图2(a)可知,海泡石为片状结构;而从图2(b)可见,催化剂3D-SnO2/改性海泡石为3D块状结构。
图3所示为3D-SnO2/改性海泡石的氮气吸附-脱附等温线和相应的孔径分布图。从图3(a)可以看出,氮气吸附曲线和脱附曲线形成了滞留环,进一步表明催化剂为多孔结构。由图3(b)可知,催化剂3D-SnO2/改性海泡石的孔径主要分布在86.87 nm,平均孔径为80.97 nm,根据国际纯粹化学与应用化学联合会(IUPAC)对孔的分类[21]可知,其孔结构为大孔。对于催化剂而言,大孔结构具有催化剂载容量高,比表面积大的特点,有利于光催化降解反应的进行,提高降解效率。因此,所制备的催化剂3D-SnO2/改性海泡石有望在光催化降解染料废水中表现出良好的光催化性能。经过计算,催化剂的比表面积为86 m2/g。

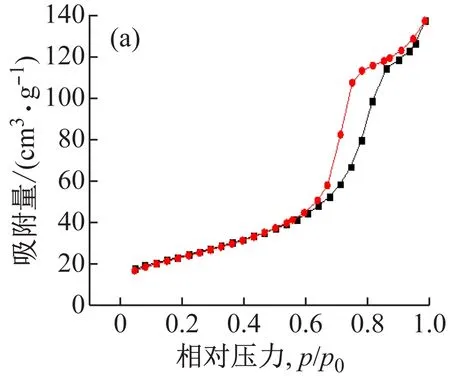

图3 催化剂15%3D-SnO2/改性海泡石N2吸脱附等温曲线(a)和孔径分布图(b)
3 讨 论
3.1 焙烧温度对降解率的影响
由图4可知,随着焙烧温度的不断升高,降解率先升高后降低。当焙烧温度从300 ℃升至480 ℃时,降解率由32.27%上升至98.5%,但当焙烧温度大于480 ℃时,降解率呈下降趋势是因为高温造成粉末烧结团聚,比表面积减小,影响了催化剂的活性。
3.2 负载量对降解率的影响
由图5可见,纯SnO2在太阳光下光催化降解率仅为70%,海泡石负载SnO2达15%,对甲基橙的降解效率达到了98%,在一定的负载量范围内,增加光催化吸光率的反应面积,对反应物的吸附作用增加,随着负载量大于15%后,光催化活性会随着负载量的增加反而降低,这是由于光催化降解反应在SnO2的表面上进行,SnO2的负载量将直接影响到反应体系中反应活性位的多少。当SnO2在改性海泡石表面单分散时,催化剂的活性位分布最广,当负载量超过阈值时,随着负载量的增多,产生堆积现象,还可能造成活性组分的烧结,降低催化剂活性,进而影响到3D-SnO2/改性海泡石的光催化性能,由此可见,本实验体系的最佳负载量为15%。

图4 不同温度的产品对甲基橙溶液的光催化降解曲线

图5 不同负载量样品对甲基橙溶液光催化降解曲线图
3.3 催化剂用量对降解率的影响
由图6可知,不使用催化剂时,甲基橙几乎没有降解;在催化剂用量增加至30 mg时,随着光照时间的增加,降解率增大,原因是光催化反应在催化剂的表面进行,在甲基橙浓度一定的情况下,增加催化剂的用量,相当于增加了反应的活性位,即增加了因光照产生的活性基团,因此将会增大光催化反应的速率;但当催化剂的用量大于30 mg时,降解效率出现下降的趋势,降解率仅为50%。当催化剂的用量较多时,光催化反应趋于饱和,由于催化剂对光的散射和屏蔽作用,降解率将不断的降低。在本实验反应体系中,催化剂的用量30 mg较适宜。
3.4 催化剂可重复利用性能测试
由图7可知,在第1次光催化降解实验中保持有较高的光催化活性,而回收后的催化剂相对于前一次实验光催化性能都有一定的降低。其原因可能是因为SnO2与改性海泡石之间的结合程度不够牢固,在降解的过程中从改性海泡石的表面脱落流失,从而降低了其光催化活性。因此,进一步增强SnO2负载在改性海泡石表面牢固性有待进一步研究。

图6 不同用量催化剂对甲基橙溶液光催化降解曲线图

图7 15%3D-SnO2/改性海泡石光催化降解甲基橙稳定性
4 结 语
以SnCl4·5H2O为原料,采用超声波溶胶-凝胶法,改性海泡石为载体,在溶液pH值7~8,超声分散1 h,加入3.0 g改性海泡石,搅拌2 h,陈化18 h,105 ℃干燥2 h,480 ℃焙烧2 h条件下,制备了3D-SnO2/改性海泡石催化剂,其中SnO2负载量为15%,催化剂比表面积为86 m2/g,平均孔径为80.97 nm。
所制得的3D-SnO2/改性海泡石光催化剂在太阳光下,光照5 h,每25 mL废水催化剂30 mg条件下,光催化降解率达到98.5%。
[1] Dai Shu-dong, Yao Zhong-liang. Synthesis of flower-like SnO2single crystals and its enhanced photocatalytic activity [J]. Applied Surface Science, 2012, 258: 5703-5706.
[2] Ji Xiao-xu, Bai Chong-chong, Zhao Qing-huai,etal. Facile synthesis of porous SnO2quasi-nanospheres for photocatalytic degradation of Rhodamine B [J]. Materials Letters, 2017, 189:58-61.
[3] Kar A, Patra A. Recent advances of doping of SnO2nanocrystals for their potential applications [J]. Transactions of the Indian Ceramic Society,2013,72(2):89-99.
[4] Haridas D, Gupta V. Enhanced response characteristics of SnO2thin film basedsensors loaded with Pd clusters for methane detection [J]. Sensors and Actuators B: Chemical, 2012, 166: 156-164.
[5] Qiao Xiu-qing, Hu Fu-chao, Hou Dong-fang,etal. Preparation and characterization of SnO2/Ag hollow microsphere via a convenient hydrothermal route [J]. Scientific Reports, 2016, 35(6): 73-79.
[6] Park H S, Bae K W. Preparation of C60 nanowhiskers-SnO2nanocomposites and photocatalytic degradation of organic dyes [J]. Journal of Nanoscience and Nanotechnology, 2015, 15(10):8125-8132.
[7] Hung L, Ramirez D A, Peterson G R,etal. Development of a carbon-supported Sn-SnO2photocatalyst by a new hybridized sol-gel/dextran approach [J]. RSC Advances, 2016, 25(6): 21019-21025.
[8] Sergio A, Brandon A, Noel M,etal. Resistive Switching of SnO2Thin Films on Glass Substrates [J]. Integrated Ferroelectrics, 2011(1):117-124.
[9] WU S, ZHAO Qing-nan, MIAO Deng-kui,etal. Synthesis and characterization of Sb-doped SnO2-(CeO2-TiO2) composite thin films deposited on glass substrates for antistatic electricity and UV-shielding [J]. Journal of Rare Earths, 2010(S1):189-193.
[10] Malik R, Tomer V K, Rana P S,etal. Surfactant assisted hydrothermal synthesis of porous 3-D hierarchical SnO2, nanoflowers for photocatalytic degradation of Rose Bengal [J]. Materials Letters, 2015, 154:124-127.
[11] Wang X, Fan H, Ren P,etal. Homogeneous SnO2, core-shell microspheres: Microwave-assisted hydrothermal synthesis, morphology control and photocatalytic properties [J]. Materials Research Bulletin, 2014, 50(2):191-196.
[12] Wang J, Fan H Q, Yu H W. Synthesis of monodisperse walnut-like SnO2spheres and their photocatalytic performances [J]. Journal of Nanomaterials, 2015,55(10):1-8.
[13] Wang X, Fan H, Ren P. UV light-assisted synthesis of coral SnO2: Characterization and its enhanced photocatalytic properties [J]. Colloids & Surfaces A Physicochemical & Engineering Aspects, 2012, 402(1):53-59.
[14] Corma A. Surface acidity and catalytic activty of a modified sepiolite [J].Clay Miner, 1984, 19(6):673-676.
[15] Corma. A. Influnte of chemieal composition and texture characteristics of Palygorskite on the acid teaching of octabedrat catons [J]. Clay Miner, 1987, 22(3):225-232.
[16] 贾明畅,戴友芝,杜 婷,等.磁性海泡石的研制及吸附特性[J]. 环境化学, 2011, 30(9):1546-1552.
[17] 廖润华, 夏光华, 成 岳,等. 改性海泡石的制备及其吸附性能试验研究[J]. 中国陶瓷工业, 2006, 13(4):17-21.
[18] Kim Phil, Myong Yong, Choi,etal. Characterization and photocatalytic performance of SnO2-CNT nanocomposites [J]. Applied Surface Science, 2015, 357(Part A):302-308.
[19] Birkel A, Lee Y-G. Highly efficient and stable dye-sensitized solar cells based on SnO2nanocrystals prepared by microwave-assistedsynthesis [J]. Energ Environ Sci, 2012(5):5392-5400.
[20] 张 健,刘海映,季秋忆,等.纳米SnO2光催化剂的制备及其光催化降解海洋柴油污染的研究 [J]. 大连海洋大学学报, 2016, 31(4):438-443.
[21] Notari B. Synthesis and catalytic properties of titanium containing zeolites [J]. Studies in Surface Science and Catalysis, 1987, 37: 413-425.

