基于高通量定量PCR研究城市化小流域微生物污染特征
庄芳芳,苏建强,陈辉煌,朱永官
1. 中国科学院城市环境研究所城市环境与健康重点实验室,厦门 361021 2. 中国科学院大学,北京 100049
水体环境与人类生产生活息息相关,随着社会经济地快速发展,水体微生物污染日趋加剧,成为全球性环境问题,我国各大水系均受到不同程度的病原微生物污染。此外,国外40%的河流及河口由于病原微生物污染,水质难以达到水环境质量标准[1]。然而在水质安全监测方面,目前我国《地表水环境质量标准(GB3838—2002)》仅把粪大肠菌群浓度规定为唯一的微生物指标[2]。水体微生物污染(包括致病菌、病毒、寄生虫)会引起多种传染病和寄生虫病,对水质安全和人体健康造成重要威胁[3],仅用粪大肠菌群作为唯一指标无法准确评估水体微生物污染。
粪便污染是水体微生物污染的主要来源之一[4],其中的病原微生物可经饮食、呼吸道、皮肤接触等途径感染人类,引起胃肠道疾病和呼吸道系统等疾病。由于肠道微生物差异,不同宿主来源粪便对水质污染有着不同程度的危害,鉴别水体的粪便污染来源及污染程度有助于水体微生物污染来源监管,从而保障水质安全。传统的粪大肠菌群等粪便污染指示微生物由于能够在自然环境中存活并繁殖,在各种动物的肠道中没有特异性等缺陷不能分辨粪便污染来源,无法准确评估水体微生物污染状况[5-6]。微生物源示踪技术的出现解决了这一难题,微生物源示踪技术(Microbial Source Tracking,MST)自20世纪90年代被提出[7-8],是基于不同宿主肠道微生物的差异,利用宿主特异性或与宿主相关的微生物指标建立鉴别粪便污染源的方法[9]。利用TaqMan探针荧光定量PCR(quantitative PCR, qPCR)方法进行溯源准确度高、特异性强,可同时进行定性和定量检测,是近年来较为成熟与广泛应用的方法[10-11]。
微生物源示踪技术仅可用于鉴别粪便污染的来源,不能指示各种病原微生物的含量,且MST指示微生物与病原微生物之间的相关关系尚存在质疑。因此,评估水体环境病原微生物污染仍需对病原微生物种类及含量进行测定。培养法与分子生物学方法是目前主要的病原微生物检测手段[12],但由于水体环境中病原微生物含量往往较低,培养法费时、昂贵且无法对含量进行定量[13-14];随着分子生物学的发展,qPCR方法更为灵敏、方便、快速,在环境领域逐渐得到了应用[15]。
后溪是厦门市第二大河流,干流全长29.25公里,总面积209.3平方公里,发源于戴云山脉和博平岭山脉交界的老寮苍山西麓,自西北向东南流经集美区大部,经后溪水闸后汇入杏林湾[16]。后溪流域是厦门市和集美区重要的水源涵养区和生态敏感区,其上游石兜、坂头两大水库是厦门市城市饮用水重要供给地;中下游两岸是快速发展的城镇区域,城区河流极易受到居民生活污染;下游为入海口,其上游的污染很可能造成入海口和近岸海岸带污染。研究该流域微生物污染状况对保护流域水环境、水质安全管理及人类健康具有重要意义。
本研究利用基于TaqMan探针的高通量qPCR检测技术,对厦门市后溪流域冬季微生物污染状况进行研究,包括常见粪便污染源(人类、反刍动物、家禽、猪、狗)微生物源示踪和病原微生物(胃肠道、肺炎、角膜炎相关疾病病原微生物)检测,旨在探明该流域水体微生物污染特征和污染来源。
1 材料与方法(Materials and methods)
1.1 研究区域概况及样品采集
水样采集于2017年1月,采样点分布于整条流域,采样位置包括上游源头H1断面、水库H2~H5断面、水库下游H6断面、居民生活产业区H7、H8断面及集美新城区H9、H10断面,共计10个断面,分布见图1。所有采样位置均用GPS 定位仪精确定位,位点信息见表1。使用无菌聚乙烯塑料采样瓶采集2.5 L水样,6 h内送回实验室分析。
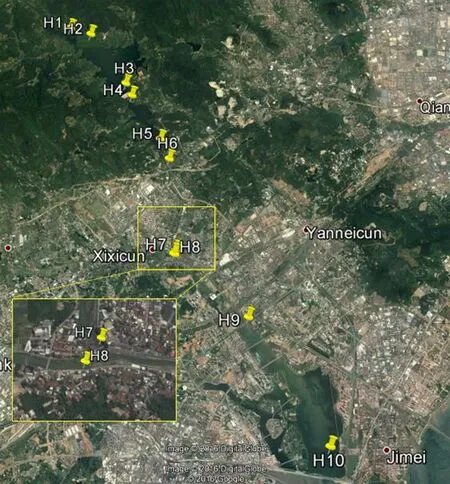
图1 研究区域及采样点位置Fig. 1 Schematic map of the studied area and sampling sites
1.2 理化性质测定
各采样点pH、浊度、溶解氧的测定采用多参数水质分析仪(Hydrolab DS5,美国)分析。总碳、总有机碳、总氮、硝酸盐、亚硝酸盐、氨氮、总磷、磷酸盐根据以前研究中使用的方法进行测定[17]。
1.3 高通量qPCR检测方法
1.3.1 样品预处理与DNA提取
水样采用0.2 μm的硝酸纤维滤膜,按照水质状况选择过滤体积,将过滤后的滤膜剪碎并使用FastDNA®土壤DNA试剂盒(MP Biomedical,美国)提取基因组DNA,使用NanoDrop ND-1000分光光度计(Nanodrop,美国)对提取的DNA质量和浓度进行检测。
1.3.2 分子标记物
所采用的24个qPCR分子标记物包含1个细菌通用16S rRNA基因分子标记物、10个MST分子标记物(表2)及13个病原微生物分子标记物(表3)。引物、探针合成于Thermo Fisher公司(中国)。

表1 采样位点信息Table 1 Characteristics of the sampling sites

表2 粪便污染分子标记物序列信息Table 2 Oligonucleotide sequences of MST markers for fecal pollution
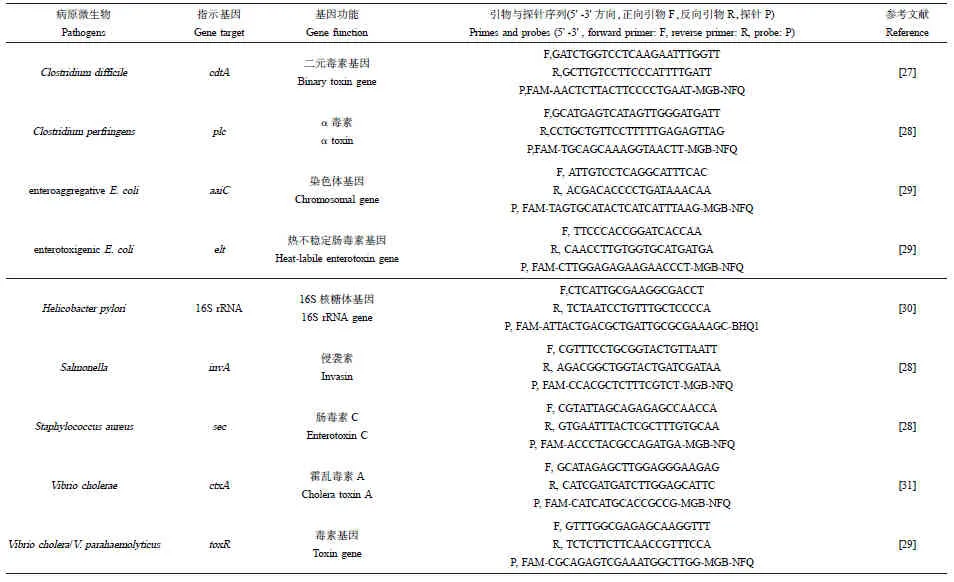
表3 病原微生物分子标记物序列信息Table 3 Oligonucleotide sequences for pathogen markers

续表3

表4 采样点理化性质Table 4 Physical and chemical properties of the sampling sites
分子标记物中TaqMan探针进行优化调整:将5’端荧光报告基团统一为羧基荧光素(6-carboxy-fluorescein,FAM),3’端荧光淬灭基团用黑洞淬灭基团1(Black Hole Quencher 1,BHQ1)取代羧基四甲基罗丹明(Carboxytetramethylrhodamine,TAMRA),3’端淬灭基团统一为BHQ1或小沟结合物-非荧光淬灭基团(Minor groove binder-non fluorescent quencher,MGB-NFQ)。这是由于TAMRA为荧光染料,在淬灭报告基团的同时会发射荧光;而BHQ1为非荧光染料,淬灭报告基团时自身不发射荧光,探针荧光本底低,使检测灵敏度更高。对于MGB-NFQ淬灭基团,MGB可将探针的Tm值提高10 ℃左右,探针长度较短,使得探针淬灭基团与报告基团空间位置更近,且NFQ是非荧光淬灭基团,对报告基团荧光淬灭效果更佳。
本试验24对分子标记物均使用美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI) BLASTn工具进行比对,验证探针和引物的特异性,比对后修改了其中的艰难梭菌(Clostridiumdifficile)cdtA分子标记物(表3)。
1.3.3 标准曲线质粒样品的制备
采用标准质粒外标法对16S rRNA基因丰度进行绝对定量,采用大肠杆菌DNA为模板,将PCR扩增目的片段切胶回收、纯化(Tiangen,北京),与PMD19-T载体(Takara,日本)进行AT连接、转化,挑取单菌落测序,序列经过BLAST比对后确认为16S rRNA基因片段,采用TIANprep MINI plasmid试剂盒(Tiangen,北京)提取得到的含有16S rRNA基因的质粒以10倍梯度稀释至拷贝数范围为109~103copies·μL-1,用于制作标准曲线。
1.3.4 高通量qPCR检测
采用美国Wafergen公司SmartChip多样品纳升分配器分别将样品(包括水样DNA、质粒和无核酸酶灭菌水阴性对照,一个样品3个技术重复)和引物、探针在SmartChip纳升芯片(Wafergen,美国)上进行分配,随后将芯片置于SmartChipCycler仪器(Wafergen,美国)上进行高通量qPCR[33-34]。
高通量qPCR反应体系为100 nL,包含1×TaqMan®Gene Expression Master Mix(Applied Biosystems,美国)、1×ROX 参比染料(Invitrogen,美国)、1 mg·mL-1牛血清白蛋白溶液(Sigma,德国)、0.9 μmol·L-1正向引物与反向引物、0.25 μmol·L-1探针、5 ng·μL-1DNA和无核酸酶灭菌水。扩增程序为:50 ℃ 2 min激活尿嘧啶-N-糖基化酶,95 ℃ 10 min激活AmpliTaq Gold DNA聚合酶,40个循环(95 ℃ 15 s变性,60 ℃ 1 min退火和延伸)。程序完成后,软件将自动分析并导出数据。
1.4 数据统计分析
1.4.1 数据统计
导出的数据按以下标准进行筛选:1)扩增效率需在80%~120%之间;2)循环临界值(Cycle Threshold,CT)必须小于31;3)3个技术重复至少2个得到扩增的认定为有效扩增。筛选后的数据根据文献计算相对丰度,公式为[33-34]:
接着,把样品中目的基因的相对丰度通过16S rRNA基因的绝对定量数据转化为目的基因的拷贝数。
1.4.2 数据分析
使用Microsoft Excel 2016对数据进行运算,用R语言2.14.0进行热图、主成分分析(Principal Component Analysis,PCA)、冗余分析(Redundancy Analysis,RDA),用Origin Pro 9.0作图。
2 结果(Results)
2.1 理化性质
厦门后溪中下游H6~H10位点浊度、营养盐(总碳、总有机碳、总氮、硝酸盐、亚硝酸盐、氨氮、总磷、磷酸盐)含量普遍高于上游与水库位点。H7、H8位点浊度、营养盐含量普遍高于其他位点,溶解氧含量低于其他位点(表4)。根据我国《地表水环境质量标准(GB3838—2002)》中限值[2],上游与水库H1~H5位点中,H1位点为地表水Ⅴ类水质,H4为Ⅲ类水质,H2、H3、H5为Ⅳ类水质,这些位点水质无法达到功能目标要求,主要由于总氮含量高,除总氮指标外,其他指标均达到地表水Ⅱ类水质标准。根据实地调查,流域上游果园面积比较大,上游与水库总氮含量较高可能与果园施肥有关。中下游H6~H10位点均为劣Ⅴ类水质,主要表现为N、P污染,这些位点总氮含量均超标,此外,H7~H9位点氨氮含量超标,H6~H9位点总磷含量超标,尤其是H7~H9位点营养盐超标较严重。
2.2 后溪微生物污染状况
所用于检测的分子标记物除了Chicken/duckND5标记物为自主设计,其余标记物均来自于已发表的文献(表2, 表3),据文献报道具有较高的灵敏度与特异度。我们进一步对各分子标记物的探针和引物进行BLAST比对验证表明探针和引物均具有较高特异性,这些分子标记物可用于后续检测。通过高通量qPCR得到厦门后溪冬季各采样点的微生物污染状况,包括不同宿主来源的粪便污染(图2)与病原微生物污染(图3)。
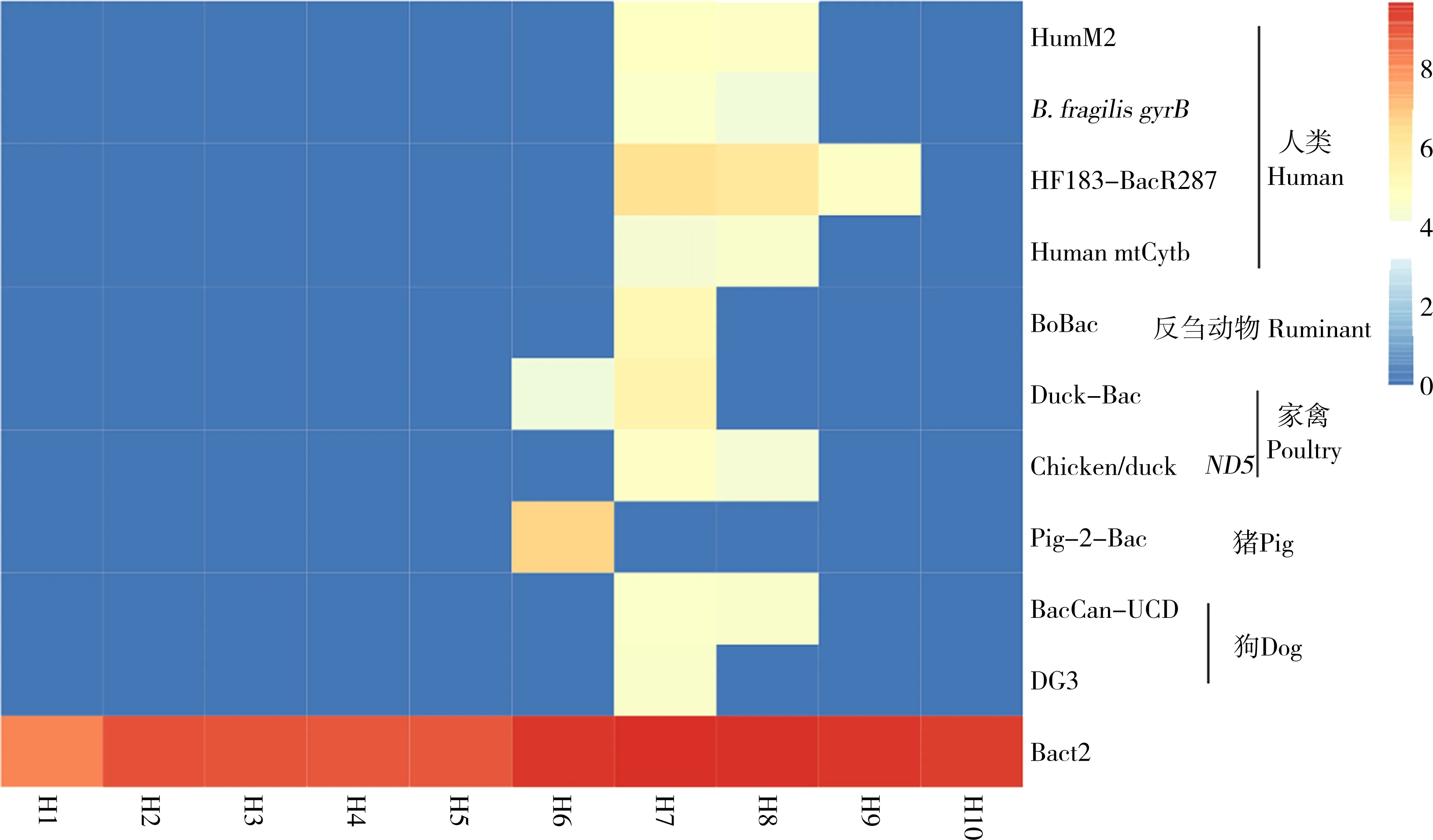
图2 采样点不同宿主粪便指示分子标记物丰度(log10 copies·(100 mL)-1)Fig. 2 Concentration of fecal indicators (log10 copies·(100 mL)-1) from various hosts in sampling sites

图3 采样点病原微生物含量(log10 copies·(100 mL)-1)Fig. 3 Concentration of pathogens (log10 copies·(100 mL)-1) in sampling sites
上游和水库H1~H5位点以及下游汇入杏林湾口H10位点未检测出粪便污染,在中下游H6~H8和集美新城区H9位点检测出粪便污染,且污染主要集中于点H7、H8。H6位点检测出少量家禽源污染(4.0 log10copies·(100 mL)-1)及较高的猪源粪便污染(6.7 log10copies·(100 mL)-1)。H7和H8位点呈现出多种来源粪便污染,其中H7位点检测到人类、反刍动物、家禽、狗的粪便污染,基因拷贝数范围为4.3~6.3 log10copies·(100 mL)-1,人类、家禽来源的粪便污染为主要污染。H8位点检测到人源、家禽源、狗源污染(4.1~6.1 log10copies·(100 mL)-1),其污染程度与H7位点相近。H9位点检测出少量的人类粪便污染,基因拷贝数值为4.7 log10copies·(100 mL)-1(图2)。
用于检测病原微生物的分子标记物包含了10个胃肠道病原微生物标记物、1个棘阿米巴属(Acanthamoebaspp.)18S rRNA标记物、2个与肺炎相关疾病的病原微生物:克雷伯氏肺炎杆菌(Klebsiellapneumoniae)外膜磷酸孔蛋白标记物及军团杆菌属(Legionellaspp.)23S rRNA标记物。由图3可以看出,病原微生物的检出与粪便污染的检出有着较相似规律:H1~H5、H9位点检测出较少病原微生物,在H6~H8、H10位点检测出较多病原微生物,且主要集中于点H8。各位点水体的总细菌含量与粪便污染、病原微生物的检出也有着相似规律,即H1~H5水体总细菌含量较少(8.2~9.1 log10copies·(100 mL)-1),H6~H10水体总细菌含量较多(9.4~9.7 log10copies·(100 mL)-1)。不同的是,H1~H10各位点均检测出军团杆菌,且其在水库H2~H5位点的含量高于其他位点。所有位点检测出的病原微生物含量均较少(3.9~5.3 log10copies·(100 mL)-1)。H2位点检测出棘阿米巴;H6位点检测出幽门螺杆菌(Helicobacterpylori)与克雷伯氏肺炎杆菌;H7位点检测出肠聚集性大肠杆菌(enteroaggregativeE.coli);H8位点检测出较多病原微生物,包含产气荚膜梭菌(Clostridiumperfringens)、肠毒素型大肠杆菌(enterotoxigenicE.coli)、棘阿米巴、克雷伯氏肺炎杆菌;H10位点检测出霍乱弧菌/副溶血弧菌(Vibriocholera/V.parahaemolyticus)。
2.3 PCA与RDA结果
2.3.1 PCA结果
对后溪流域各采样点粪便污染与病原微生物污染进行PCA分析进一步证实各点的微生物污染状况有着差异,特别是上游与水库H1~H5位点集中聚集,微生物污染状况相似; H9、H10与H1~H5位点距离较近,微生物污染状况较为相近;生活产业区H7、H8位点距离较近,污染状况相似,且远离H1~H6、H9、H10位点,H7、H8微生物污染与这些位点差异较大(图4)。对流域各采样点理化性质进行PCA分析发现相似的规律:H1~H5位点较集中聚集,H7、H8与H1~H6、H10位点差异较大(图5)。说明该流域微生物污染与理化性质有一定相关关系。

图4 采样点微生物污染状况PCA图Fig. 4 Principal component analysis of microbial contamination in sampling sites
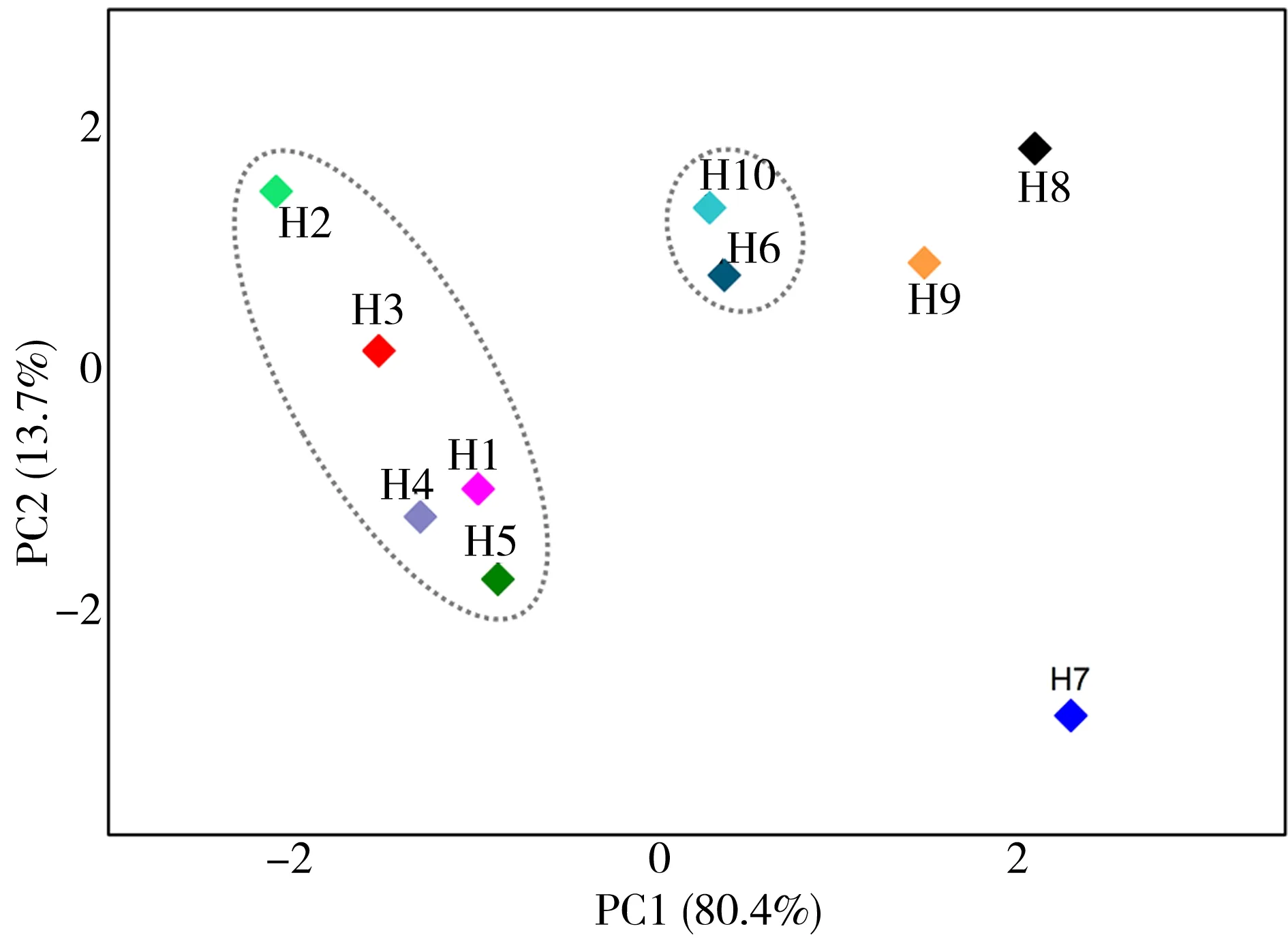
图5 采样点理化性质PCA图Fig. 5 Principal component analysis of physical and chemical properties in sampling sites
2.3.2 RDA结果
进一步对各采样点微生物污染与理化性质进行RDA分析,得到后溪流域微生物污染与pH、浊度、溶解氧、硝酸盐、亚硝酸盐含量显著相关(P<0.05),这5个理化指标对流域微生物污染的解释量为84.4%。H1~H5、H10位点pH、溶解氧含量较高,pH、溶解氧与这些位点微生物污染显著正相关;反之,H7、H8位点pH、溶解氧含量较低,pH、溶解氧与H7、H8位点微生物污染显著负相关。H7、H8位点浊度、营养盐含量(硝酸盐、亚硝酸盐)高,浊度、硝酸盐、亚硝酸盐与H7、H8位点微生物污染显著正相关;H1~H5、H9、H10位点反之亦成立(表4,图6)。由于H7、H8位点微生物污染较严重,H1~H5、H9、H10位点微生物污染较小,由此可见后溪流域微生物污染与浊度、硝酸盐、亚硝酸盐含量显著正相关,与pH、溶解氧含量显著负相关。

图6 采样点微生物污染与理化性质RDA图Fig. 6 Redundancy analysis depict the relationship between microbial contamination and physical and chemical properties in sampling sites
3 讨论(Discussion)
本研究利用高通量qPCR对厦门市后溪流域进行了常见粪便污染源(人类、反刍动物、家禽、猪、狗)和病原微生物检测,用以评估该流域微生物污染状况。所有样点均未检出艰难梭菌、沙门氏菌(Salmonella)、金黄葡萄球菌(Staphylococcusaureus)、霍乱弧菌二元毒素基因(ctxA)污染。所有样点均检测出军团菌属23S rRNA标记物,且其在水库H2~H5位点的含量高于其他位点,这与本研究中其他分子标记物、理化性质检出的规律差异较大。据报导军团菌属中包含多种非致病菌种[35],所使用的分子标记物为该菌的23S rRNA基因,涵盖了该菌属中的非致病菌株,因此该分子标记物可能不适合用于评估军团菌病原微生物污染,后续研究中应针对致病军团菌的特异基因进行。
后溪流域上游为水源地水与水库蓄水(H1~H5位点),水质较好,没有检测到粪便污染,且检出的病原微生物数量与含量极少,微生物污染极小。但石兜水库上游H2位点检测出少量棘阿米巴(4.0 log10copies·(100 mL)-1)污染,近年来有报导棘阿米巴性角膜炎爆发可能与饮用水受到棘阿米巴污染有关[32],该污染出现于水库,应引起重视,并且需要进一步确认是否存在棘阿米巴污染。
H6~H8位点均检测出粪便污染和病原微生物污染,H9位点检测出少量人类粪便污染,H10位点检测到病原微生物污染。H6样点位于水库下游,在该位点检测到猪和家禽粪便污染,表明水体流出水库后受到禽畜养殖污染(猪、家禽)。H7、H8样点位于旧城区居民生活、产业区,这2个位点浊度、营养盐含量普遍高于其他位点,溶解氧含量低于其他位点,N、P污染较为严重,为劣Ⅴ类水质,已无法满足水质生态功能要求;这2个位点也检测出最多的粪便污染与病原微生物污染,说明其受到较为严重的微生物污染。流域微生物污染主要来源于城市暴雨径流、生活污水溢流、禽畜养殖、分散式污水处理系统、污水处理厂排水、流域底泥等[36]。人为因素,包括了人类生产、生活活动可能是H7、H8位点微生物污染的主要来源。H9、H10样点位于集美新城区,居民区较少,规划与配套污水管网、处理设施较为科学环保,且其上游的污染经过流域的稀释、自净降解作用,因此检测出的微生物污染较少,但仍需进一步加强控制。值得注意的是,在H10位点检测出少量霍乱弧菌/副溶血弧菌毒素基因(toxR)与霍乱弧菌外膜蛋白W基因(ompW),说明H10位点有霍乱弧菌、副溶血弧菌污染;本研究中还有一个分子标记物针对霍乱弧菌二元毒素基因,二元毒素基因是强毒性基因[31, 37],该位点未检出霍乱弧菌二元毒素基因,说明H10位点病原微生物污染程度不高,但H10位点位于后溪流域汇入杏林湾的入海口,该位点的污染很可能造成入海口污染,且可能扩散污染,仍需引起重视。
此外,后溪流域微生物污染与流域理化性质密切相关,特别是营养盐、浊度、pH、溶解氧。微生物污染状况能进一步表征流域综合污染状况,对控制流域理化、微生物污染具有重要意义。
综上表明,城镇居民生活、生产活动是后溪流域微生物污染主要来源。后溪流域是厦门市小流域污染整治与水资源保护示范区,具有重要的水源涵养和生态功能,研究后溪流域污染状况,特别是微生物污染状况将有利于水资源保护与人类健康。本研究基于高通量qPCR技术对城市化小流域微生物污染状况进行评估,同时对多种粪便污染源与病原微生物进行检测,实现了更加快速、及时、科学、准确地发现粪便污染来源,评估水体微生物污染分布规律和特征,从而对流域微生物污染监管与控制提供更有效的依据。
[1] 杨勇, 魏源送, 郑祥, 等. 北京温榆河流域微生物污染调查研究[J]. 环境科学学报, 2012, 32(1): 9-18
Yang Y, Wei Y S, Zheng X, et al. Investigation of microbial contamination in Wenyu River of Beijing [J]. Acta Scientiae Circumstantiae, 2012, 32(1): 9-18 (in Chinese)
[2] 国家环境保护总局. GB3838—2002 地表水环境质量标准[S]. 北京: 中国标准出版社, 2002
Ministry of Environmental Protection of the People's Republic of China. GB3838—2002 Environmental quality standards for surface water [S]. Beijing: China Standard Press, 2002 (in Chinese)
[3] 世界卫生组织. 饮用水水质准则(第四版)[M]. 上海: 上海交通大学出版社, 2014: 87-232
World Health Organization. Guidelines for Drinking-water Quality (Fourth Edition) [M]. Shanghai: Shanghai Jiaotong University Press, 2014: 87-232 (in Chinese)
[4] Simpson J M, Santo D J, Reasoner D J. Microbial source tracking: State of the science [J]. Environmental Science and Technology, 2002, 36(24): 5279-5288
[5] 王耀兵, 苏洁, 杨玉敏, 等. 一种粪便污染源识别新技术——微生物源示踪[J]. 海洋环境科学, 2008, 27(S2): 122-128
Wang Y B, Su J, Yang Y M, et al. New technology of identification of fecal pollution—— Microbial source tracking [J]. Marine Environmental Science, 2008, 27(S2): 122-128 (in Chinese)
[6] 段传人, 刘爱喜, 王贵学, 等. 应用肠道微生物示踪地表水粪便污染的研究进展[J]. 微生物学通报, 2013, 40(12): 2319-2329
Duan C R, Liu A X, Wang G X, et al. Research progress of using intestinal microbes to track the sources of fecal pollution in surface water [J]. Microbiology China, 2013, 40(12): 2319-2329 (in Chinese)
[7] Wiggins B A. Discriminant analysis of antibiotic resistance patterns in fecalstreptococci, a method to differentiate human and animal sources of fecal pollution in natural waters [J]. Applied and Environmental Microbiology, 1996, 62(11): 3997-4002
[8] Parveen S, Murphree R L, Edmiston L, et al. Association of multiple-antibiotic-resistance profiles with point and nonpoint sources ofEscherichiacoliin Apalachicola Bay [J]. Applied and Environmental Microbiology, 1997, 63(7): 2607-2612
[9] Scott T M, Rose J B, Jenkins T M, et al. Microbial source tracking: Current methodology and future directions [J]. Applied and Environmental Microbiology, 2002, 68(12): 5796-5803
[10] Harwood V J, Staley C, Badgley B D, et al. Microbial source tracking markers for detection of fecal contamination in environmental waters: Relationships between pathogens and human health outcomes [J]. FEMS Microbiology Reviews, 2014, 38(1): 1-40
[11] 魏源送, 郑嘉熹, 王光宇, 等. 地表水微生物溯源技术的开发和应用进展[J]. 水资源保护, 2016, 32(1): 1-11
Wei Y S, Zheng J X, Wang G Y, et al. Development and application progress of microbial source tracking in surface water [J]. Water Resources Protection, 2016, 32(1): 1-11 (in Chinese)
[12] 陈亚楠, 王亚炜, 魏源送, 等. 不同功能地表水体中病原微生物指示物的标准比较[J]. 环境科学学报, 2015, 35(2): 337-351
Chen Y N, Wang Y W, Wei Y S, et al. Evolution and standard comparison of indicator microorganisms for different surface waters [J]. Acta Scientiae Circumstantiae, 2015, 35(2): 337-351 (in Chinese)
[13] Field K G, Samadpour M. Fecal source tracking, the indicator paradigm, and managing water quality [J]. Water Research, 2007, 41(16): 3517-3538
[14] Ferguson A S, Layton A C, Mailloux B J, et al. Comparison of fecal indicators with pathogenic bacteria and rotavirus in groundwater [J]. Science of the Total Environment, 2012, 431: 314-322
[15] 张崇淼, 王晓昌, 周进宏, 等. 城市地表水中肠道病原微生物与粪便污染指示菌的关系研究[J]. 环境科学学报, 2012, 32(11): 2789-2794
Zhang C M, Wang X C, Zhou J H, et al. Comparative study on enteric pathogens and their relations with fecal indicator bacteria in urban surface waters [J]. Acta Scientiae Circumstantiae, 2012, 32(11): 2789-2794 (in Chinese)
[16] 王宁, 黄友谊, 陈伟伟. 构建城市水系生态安全格局初探——以厦门市后溪为例[C]. 青岛: 城市时代,协同规划——2013中国城市规划年会, 2013: 1-12
Wang N, Huang Y Y, Chen W W. A Preliminary study on establishing an ecological security pattern of urban water system—A case study of Houxi River, Xiamen [C]. Qingdao: City Times, Collaborative Planning-China Urban Planning Annual Meeting 2013, 2013: 1-12 (in Chinese)
[17] Liu L, Yang J, Yu X, et al. Patterns in the composition of microbial communities from a subtropical river: Effects of environmental, spatial and temporal factors [J]. PLOS One, 2013, 8(11): e81232
[18] Mieszkin S, Furet J P, Corthier G, et al. Estimation of pig fecal contamination in a river catchment by real-time PCR using two pig-specificBacteroidales16S rRNA genetic markers [J]. Applied and Environmental Microbiology, 2009, 75(10): 3045-3054
[19] Shanks O C, Kelty C A, Sivaganesan M, et al. Quantitative PCR for genetic markers of human fecal pollution [J]. Applied and Environmental Microbiology, 2009, 75(17): 5507-5513
[20] Lee C S, Lee J. Evaluation of newgyrB-based real-time PCR system for the detection ofB.fragilisas an indicator of human-specific fecal contamination [J]. Journal of Microbiological Methods, 2010, 82(3): 311-318
[21] Green H C, Haugland R A, Varma M, et al. Improved HF183 quantitative real-time PCR assay for characterization of human fecal pollution in ambient surface water samples [J]. Applied and Environmental Microbiology, 2014, 80(10): 3086-3094
[22] Schill W B, Mathes M V. Real-time PCR detection and quantification of nine potential sources of fecal contamination by analysis of mitochondrial cytochromebtargets [J]. Environmental Science & Technology, 2008, 42(14): 5229-5234
[23] Layton A, Mckay L, Williams D, et al. Development ofBacteroides16S rRNA gene TaqMan-based real-time PCR assays for estimation of total, human, and bovine fecal pollution in water [J]. Applied and Environmental Microbiology, 2006, 72(6): 4214-4224
[24] Kobayashi A, Sano D, Hatori J, et al. Chicken- and duck-associatedBacteroides-Prevotellagenetic markers for detecting fecal contamination in environmental water [J]. Applied Microbiology and Biotechnology, 2013, 97(16): 7427-7437
[25] Kildare B J, Leutenegger C M, Mcswain B S, et al. 16S rRNA-based assays for quantitative detection of universal, human-, cow-, and dog- specific fecalBacteroidales: A Bayesian approach [J]. Water Research, 2007, 41(16): 3701-3715
[26] Green H C, White K M, Kelty C A, et al. Development of rapid canine fecal source identification PCR-based assays [J]. Environmental Science and Technology, 2014, 48(19): 11453-11461
[27] Wroblewski D, Hannett G E, Bopp D J, et al. Rapid molecular characterization ofClostridiumdifficileand assessment of populations ofC.difficilein stool specimens [J]. Journal of Clinical Microbiology, 2009, 47(7): 2142-2148
[28] Lee D Y, Shannon K, Beaudette L A. Detection of bacterial pathogens in municipal wastewater using an oligonucleotide microarray and real-time quantitative PCR [J]. Journal of Microbiological Methods, 2006, 65(3): 453-467
[29] Liu J, Gratz J, Amour C, et al. A laboratory-developed TaqMan Array Card for simultaneous detection of 19 enteropathogens [J]. Journal of Clinical Microbiology, 2013, 51(2): 472-480
[30] Kobayashi D, Eishi Y, Ohkusa T, et al. Gastric mucosal density ofHelicobacterpyloriestimated by real-time PCR compared with results of urea breath test and histological grading [J]. Journal of Medical Microbiology, 2002, 51(4): 305-311
[31] Bliem R, Schauer S, Plicka H, et al. A novel triplex quantitative PCR strategy for quantification of toxigenic and nontoxigenicVibriocholeraein aquatic environments [J]. Applied and Environmental Microbiology, 2015, 81(9): 3077-3085
[32] Wang H, Edwards M, Falkinham J R, et al. Molecular survey of the occurrence ofLegionellaspp.,Mycobacteriumspp.,Pseudomonasaeruginosa, and amoeba hosts in two chloraminated drinking water distribution systems [J]. Applied and Environmental Microbiology, 2012, 78(17): 6285-6294
[33] Su J Q, Wei B, Ou-Yang W Y, et al. Antibiotic resistome and its association with bacterial communities during sewage sludge composting [J]. Environmental Science & Technology, 2015, 49(12): 7356-7363
[34] Zhu Y G, Zhao Y, Li B, et al. Continental-scale pollution of estuaries with antibiotic resistance genes [J]. Nature Microbiology, 2017, 2: 16270
[35] 路凤, 金银龙, 程义斌. 军团菌病的流行概况[J]. 国外医学(卫生学分册), 2008(2): 78-83
Lu F, Jin Y L, Cheng Y B. Epidemiology of Legionella disease [J]. Foreign Medicine (Hygiene), 2008(2): 78-83 (in Chinese)
[36] James E S, Joyce M P. Assessment and management of watershed microbial contaminants [J]. Critical Reviews in Environmental Science and Technology, 2004, 34(2): 109-139
[37] Blackstone G M, Nordstrom J L, Bowen M D, et al. Use of a real time PCR assay for detection of thectxAgene ofVibriocholeraein an environmental survey of Mobile Bay [J]. Journal of Microbiological Methods, 2007, 68(2): 254-259

