(2Cu-Ni)/α-ZrP催化剂催化二氧化碳和甲醇直接合成碳酸二甲酯
郭林秀,盖建丽
1.山西工程职业技术学院,山西 太原 030009;2.中国科学院青岛生物能源与过程研究所,山东 青岛 266101
碳酸二甲酯(DMC)是一种重要的有机合成中间体,可用作燃料添加剂、润滑油添加剂和无毒溶剂等[1-3],是环境友好材料,被化学家称为未来的新型基础化学原料。工业上常用的酯交换合成DMC法工艺复杂,副产物多,不利于DMC的规模生产。近年来,CO2和CH3OH直接合成法受到广泛的关注。CO2为工业排放物,是引起温室效应的气体,也是一种潜在的碳源,由CO2和CH3OH直接合成DMC,在合成化学、碳资源利用和环境保护方面都具有重要的意义[4,5]。但该反应受热力学的限制,DMC的收率和甲醇的转化率都很低,且CO2是碳的稳定态,如何活化也是反应顺利进行的关键。因此,寻找合适的催化剂及载体,促进CO2的活化,提高DMC的收率是生产合成DMC的技术关键,也是研究的热点。
目前,CO2和CH3OH直接合成DMC的催化体系分为均相(采用有机锡化合物催化剂[2])和非均相(采用 ZrO2[6,7],Na2CO3-Al2O3[8],H3PO4-ZrO2[9]和 H3PMo12O40[10]等催化剂)催化体系,其中负载型 Cu-Ni双金属催化剂是目前研究最广泛的非均相催化体系。钟顺和等[11-13]制备了 V2O5-SiO2,ZrO2-SiO2和MoO3-SiO2负载Cu和Ni金属的催化剂,研究了Cu和Ni金属对CO2的活化机理,证明Cu和Ni金属能提高负载催化剂的催化效果。Bian等[14]利用了价格低廉的碳系列载体的高比表面积和特定的物理结构,制备了一系列负载型催化剂,通过催化活性的研究,说明比表面积对催化剂的活性影响较大。这些研究表明,Cu-Ni双金属对CO2和CH3OH直接合成DMC的反应有良好的催化效果,但存在制备工艺复杂、成本高、催化剂回收和分离难等问题。
α-磷酸锆(α-ZrP)是一种具有层状结构的无机材料,其合成方法简单且环保[15-17]。α-ZrP结构中每个磷氧四面体中有3个氧原子分别与3个锆原子连接,另一个氧原子则结合一个质子,这个质子能被其他阳离子或基团交换取代,从而可以调控其结构和性能,是理想的催化剂载体[18-20]。本工作以层状α-ZrP为载体,以铜盐和镍盐为活性组分前驱体,制备了(2Cu-Ni)/α-ZrP催化剂,主要研究了载体的煅烧温度和催化剂的活性组分含量对CO2和CH3OH直接合成DMC催化剂催化性能的影响。
1 实验部分
1.1 载体制备
利用回流法制备α-ZrP载体。在圆底烧瓶内加入ZrOCl2·8H2O(10 g)和磷酸(9 mol/L,10 mL),100 ℃下机械搅拌,反应24 h。然后过滤,用去离子水洗涤,直到滤液差不多为中性,90 ℃真空干燥,研磨后,在空气氛围中煅烧6 h后制得α-ZrP载体。
1.2 催化剂制备
采用等体积浸渍法制备催化剂:将定量的硝酸铜和硝酸镍溶解于定量的氨水溶液中,形成金属络合物,加入等体积的α-ZrP载体,混合液在室温下搅拌24 h,再超声分散2 h后,在旋转蒸发仪上于88 ℃减压蒸馏去掉溶剂,所得样品置于真空烘箱中于90 ℃干燥12 h,然后恒温煅烧,得到负载型催化剂的前躯体,然后在氢气气氛中于500 ℃下还原6 h,制得负载型催化剂,记做n(2Cu-Ni)/α-ZrP,n为金属负载量。
1.3 载体和催化剂表征
扫描电镜(SEM)采用JEOL公司的JEM-6380LA型扫描电镜测定。样品制备方法为将样品溶于无水乙醇,进行超声分散,涂于载玻片上,蒸发烘干溶剂,喷金后观察。
红外光谱分析(FTIR)在Perkin Elmer公司Spectrum100型红外光谱仪上进行,测试前样品在真空烘箱中烘干,用KBr压片法制样,测试扫描范围为4 000~400 cm-1。
X射线粉末衍射分析(XRD)在日本理学电机D/max-ⅢA型X射线粉末衍射仪上进行,Cu(Ka)靶辐射,Ni片滤波,λ为1.540 6×10-10m,扫描范围2θ为5~60 °,扫描速率是5 (o)/min,工作电流为25 mA,工作电压为35 kV,温度为室温,颗粒的平均粒径尺寸按谢乐方程计算。
程序升温还原(TPR)分析在美国Quantachrom公司的CHEMBET3000化学吸附仪上进行。称取一定量的样品,装入U型石英管,经惰性气体在300 ℃脱气1 h后,将U型石英管移入升温炉,通入10% H2/He混合气体,平衡一段时间后,用8 K/min速率进行程序升温。程序升温脱附(TPD)也在上述装置中进行,同样方法移入升温炉,在50 ℃下通入NH3(CO2)吸附1 h,通入氦气,平衡一段时间后,进行程序升温脱附,升温速率是8 K/min。
BET表征在美国Quantachrom公司的CHEMBET3000化学吸附仪上进行。称取一定量的样品,装入U形管,N2保护下250 ℃预处理2 h,液氮环境下,He/N2氛围中吸附,水浴中脱附。
1.4 催化剂评价
催化活性评价在连续的固定床微反应器中进行。催化剂为3 g,CO2以30 uL/min流速通过CH3OH储罐,将CH3OH带入固定床微反应器,压力为0.6 MPa,反应温度为130 ℃,催化剂上下两端装有石英棉,反应后六通阀取样并用天美 GC-7890F气相色谱对产物进行在线分析,色谱柱为 GDX-101固定相。
2 结果与讨论
负载型催化剂表面存在金属Cu,Ni和Cu-Ni合金成分,这是CO2和CH3OH活化的主要活性位,而载体较大的比表面积,以及表面的酸性位和碱性位,有助于CO2和CH3OH的同时活化,提高该反应的催化效率。Bian等[14]实验表明,当Cu和Ni金属的物质的量之比为2:1时,双金属对CO2和CH3OH直接合成DMC的催化效果最佳,因此,本工作固定Cu和Ni物质的量之比为2:1。
2.1 α-ZrP载体和催化剂表征
2.1.1 α-ZrP载体的表面形貌
图1是不同煅烧温度下的α-ZrP的SEM图。可以看出α-ZrP的层状结构很明显,也非常规整。经不同温度煅烧处理的α-ZrP样品形貌并没有发生明显变化,依然是层状的薄片,且结构规整。可见,高温煅烧不会改变α-ZrP的层状结构,载体α-ZrP的热稳定性能好。

图1 样品的SEM图像Fig.1 SEM images of samples a-α-ZrP; b-α-ZrP calcined at 400 ℃; c-α-ZrP calcined at 500 ℃
2.1.2 α-ZrP载体的XRD表征
图2为不同温度下煅烧的α-ZrP的XRD图谱。由图可知,制备的α-ZrP衍射峰的峰形尖而窄且规整,表明样品的结晶度很高,在2θ为11.56,19.68和24.86°处有3个强衍射峰,对应的晶面间距分别是0.765,0.451和0.358 nm,其分别是α-ZrP的(002),(110)和(112)面的特征衍射峰。对比不同温度煅烧后的样品,可以看出,煅烧基本不会影响α-ZrP的晶体结构。

图2 不同温度下煅烧的α-ZrP的XRD图谱Fig.2 XRD patterns of α-ZrP calcined at different temperatures
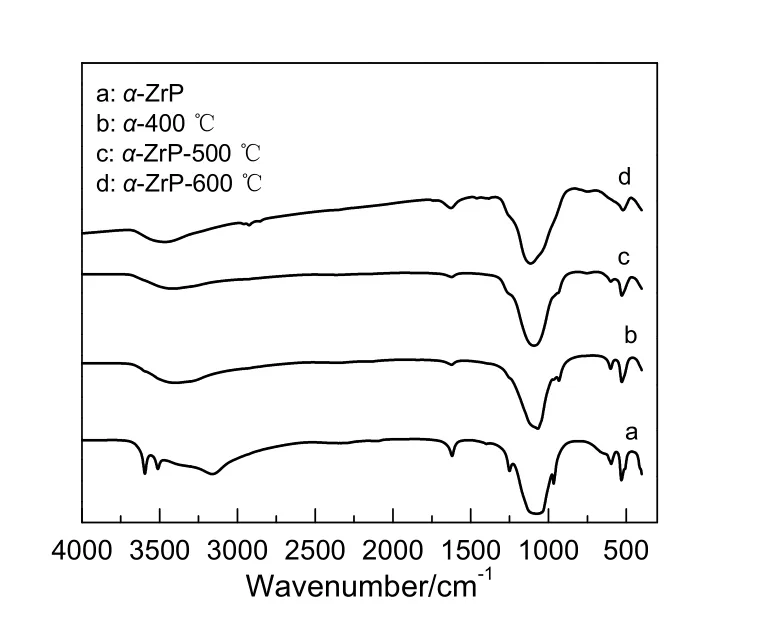
图3 不同温度下煅烧的α-ZrP的红外光谱Fig.3 IR spectras of α-ZrP calcined at different temperatures
2.1.3 α-ZrP载体的FT-IR表征
图3为不同温度下煅烧的α-ZrP的红外光谱。图中,900~1 200 cm-1的吸收带归属于磷酸根基团C3v的振动吸收;3 593和3 510 cm-1的两个尖锐的吸收带是水的特征吸收峰,1 620 cm-1的吸收带属于水的弯曲振动吸收,说明磷酸锆晶体结构中只有一种水分子存在;3 160 cm-1的强吸收带归属于P-O-H基团中羟基的伸缩振动吸收,说明α-ZrP的结构中有-HPO4基团。经过不同温度下煅烧处理的样品在3 590,3 510,3 160和1 620 cm-1的吸收带消失或大大减弱,说明结晶水基本上被脱除,同时P-O-H基团的伸缩振带移向高频3 374 cm-1处。
2.1.4 α-ZrP载体的BET表征
图4为不同煅烧温度对α-ZrP载体比表面积的影响。由图可知,载体比表面积随煅烧温度的升高先增大后减少,当煅烧温度为500 ℃时,载体的比表面积最大。因此制备载体煅烧温度为500 ℃较合适。
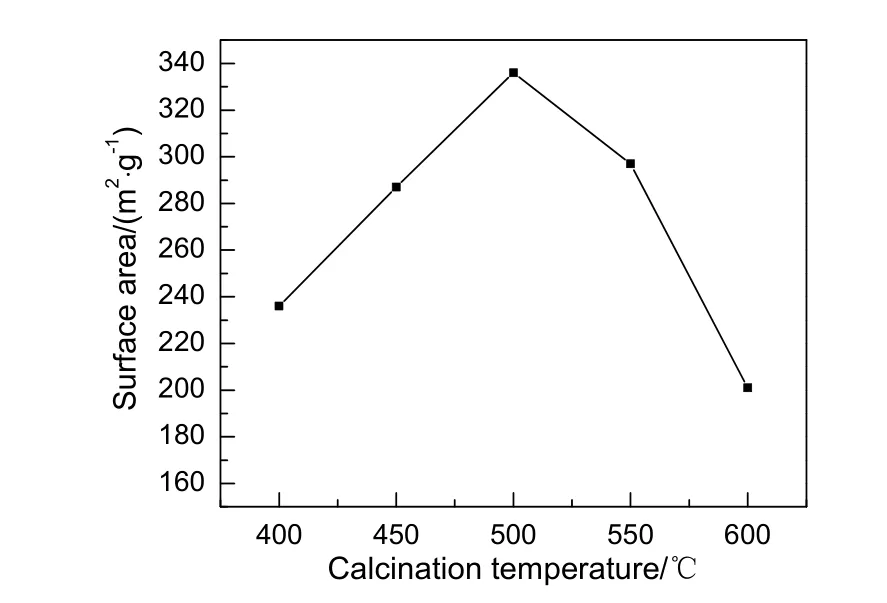
图4 不同温度煅烧的α-ZrP的比表面积Fig.4 Surface area of α-ZrP calcined at different temperatures
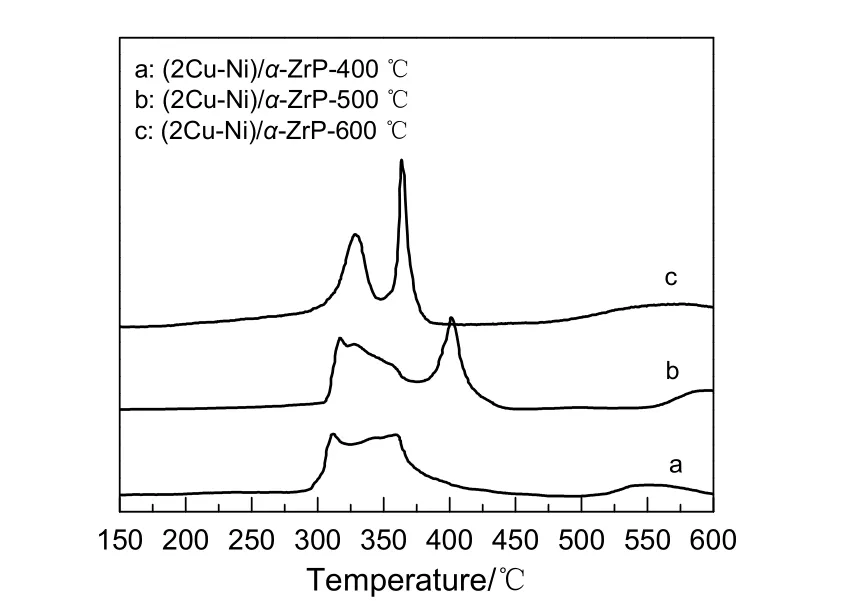
图5 不同温度煅烧的α-ZrP所制催化剂前驱体的TPR曲线Fig.5 TPR profiles of catalysts prepared by α-ZrP calcined at different temperatures
2.1.5 催化剂的TPR表征
图5为由不同煅烧温度的α-ZrP载体制得的催化剂前驱体的TPR曲线。由图可知,载体的煅烧温度不同,金属还原温度变化较小。金属Cu和Ni以及合金的还原温度参照Bian等[14]的研究结果,还原曲线都出现2个峰:280~350 ℃的耗氢峰,归属于氧化铜还原为铜的耗氢峰;350~450 ℃的耗氢峰归于氧化镍还原为镍的耗氢峰。
2.1.6 催化剂的TPD表征
图6为不同载体和7.5%(2Cu-Ni)/α-ZrP催化剂的TPD曲线。由CO2-TPD曲线可知,未经煅烧的载体α-ZrP在整个温度范围内CO2脱附峰很微弱,表明载体α-ZrP表面几乎没有碱性位;而经500 ℃煅烧处理的α-ZrP在200 ℃后出现一个很宽的脱附峰,相比未煅烧前强度有一定增加,这可能是由于煅烧后α-ZrP中的羟基脱水,形成一定的碱性位,但结合强度较大,所以很难脱附;7.5%(2Cu-Ni)/α-ZrP催化剂有一个强的脱附峰,表明负载金属后表面金属位为负载催化剂提供了较多的碱性位。由NH3-TPD曲线可知,未煅烧的载体α-ZrP有3个很强的NH3脱附峰,表明样品表面可能存在3种不同的酸性位;500 ℃煅烧处理的α-ZrP在 300~500 ℃有一个明显的 NH3脱附峰,而负载催化剂在150~250 ℃有一个明显的NH3脱附峰,在250~400 ℃表现出一个宽的脱附峰,表明煅烧后的α-ZrP和负载的催化剂表面都有酸性位的存在,只是强度比未经煅烧的α-ZrP弱,数量也少,催化剂与煅烧处理后的α-ZrP相比,酸性位数量和强度差不多,不过负载的催化剂的NH3脱附温度较低,对催化反应更有利。
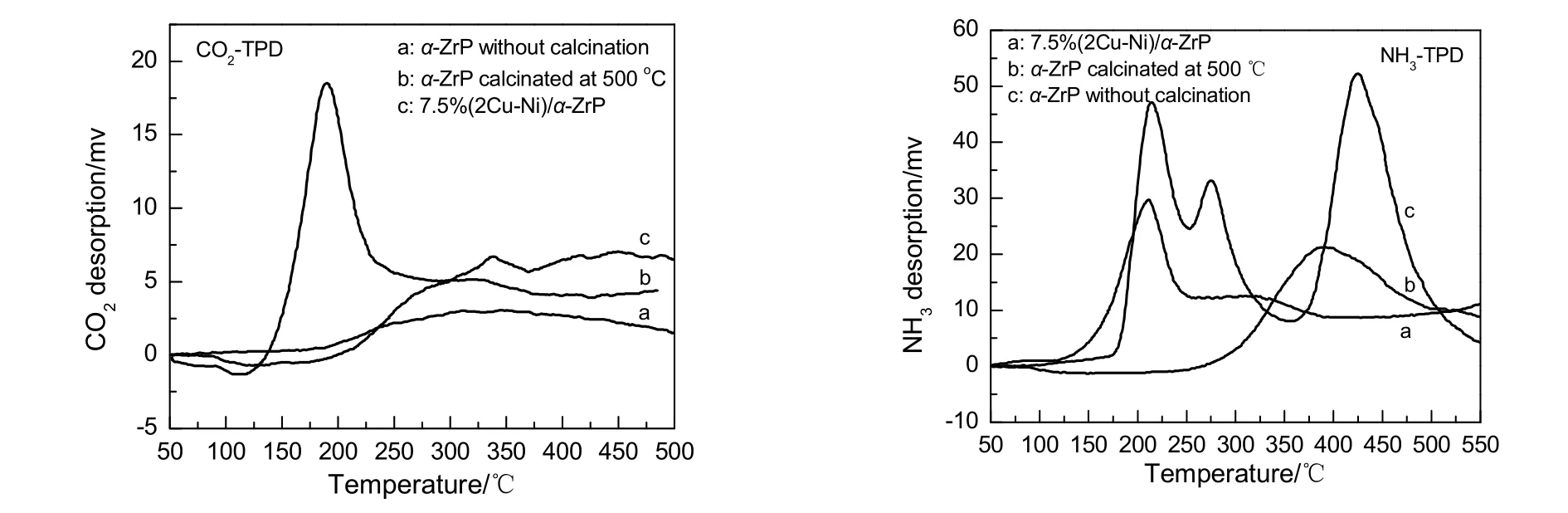
图6 不同样品的TPD曲线Fig.6 TPD profiles of different samples
2.1.7 催化剂的XRD表征
图7为7.5%(2Cu-Ni)/α-ZrP催化剂的XRD图谱。由图可知,催化剂在2θ为19.68°处的强衍射峰,对应晶面间距是 0.451 nm,归属为α-ZrP的(110)面的特征衍射峰。催化剂在2θ为43.60和50.82°处出现了明显的衍射峰,对应的晶面间距分别是0.207和0.179 nm,归属为金属相和Cu-Ni合金相的衍射。说明在还原活化过程中负载催化剂表面生成了Cu,Ni金属相和Cu-Ni合金相。用谢乐方程计算,2θ为43.60°处的Cu-Ni合金相,其晶体的平均晶粒尺寸为19.8 nm。
2.2 催化剂活性
表1为不同金属负载量和载体煅烧温度下的催化剂在催化二氧化碳和甲醇合成DMC的性能。
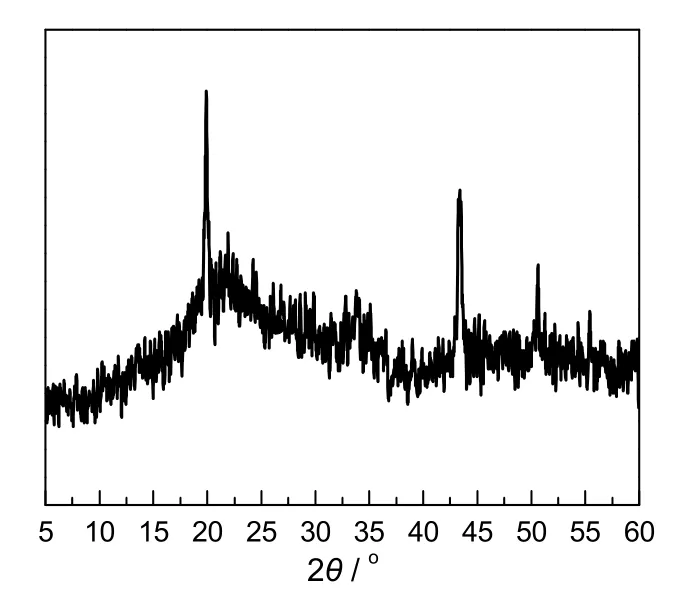
图7 催化剂7.5%(2Cu-Ni)/α-ZrP的XRD图谱Fig.7 XRD patterns of 7.5%(2Cu-Ni)/α-ZrP catalyst

表1 不同金属负载量和不同煅烧温度下CH3OH的转化率和DMC的选择性Table 1 CH3OH conversion and DMC selectivity over (2Cu-Ni)/α-ZrP catalysts with different metal loading and calcined temperature for α-ZrP
由表1可知,随着催化剂金属负载量增大,DMC选择性下降,副产物增多,这是由于金属活性位催化生成了CH2O和二甲醚(DME)等。随着催化剂表面金属负载量的增大,甲醇的转化率先增大后减小,当2Cu-Ni负载量为7.5%时,达到最大值,CH3OH的转化率为5.1%,DMC选择性可达91.7%。这是由于增加2Cu-Ni的负载量,能够增加催化剂表面的活性中心的数量,提高催化剂的催化效率,但当负载量太大时,可能会引起表面活性组分的富集,反而影响了催化剂的催化活性。由表1还可以看出,CH3OH转化率随载体煅烧温度的增大先增大后下降,在煅烧温度为500 ℃时达到最大值。
图 8为 7.5%(2Cu-Ni)/α-ZrP负载催化剂的催化性能随反应时间的变化情况。由图可知,甲醇的转化率和DMC的选择性都比较稳定,当反应达到18 h时,甲醇的转化率在4%左右,而DMC的选择性在85%左右,表明该催化剂催化活性稳定。

图8 CH3OH转化率和DMC选择性随反应时间的变化曲线Fig.8 Conversion of CH3OH and selectivity of DMC versus reaction time over 7.5%(2Cu-Ni)/α-ZrP catalyst
3 结 论
载体α-ZrP具有层状结构,比表面积大,热稳定性高,是理想的负载型催化剂载体。当负载 Cu和Ni双金属后,负载型催化剂不仅出现了金属相和合金相的活性位,而且既存在弱的酸性位又有弱的碱性位,有利于CO2和CH3OH的同时活化,对直接合成DMC的反应有高效的催化性能。以500 ℃煅烧制得的α-ZrP为载体,负载7.5%的2Cu-Ni制得的催化剂,其在催化CO2和CH3OH直接合成DMC反应中具有较好的活性。
[1]Wang Hong, Lu Bin, Wang Xiaoguang, et al. Highly selective synthesis of dimethyl carbonate from urea and methanol catalyzed by ionic liquids[J]. Fule Processing Technology, 2009, 90(3): 1198-1201.
[2]王 奔, 陈红萍, 芮玉兰, 等. 甲醇和二氧化碳合成碳酸二甲酯的研究进展[J]. 化工进展,2010, 29(12): 305-310.Wang Ben, Chen Hongping, Rui Yulan, et al. Study on synthesis of dimethyl carbonate from carbon dioxide[J]. Chemical Industry and Engineering Progress, 2010, 29(12): 305-310.
[3]陈红萍, 郭红霞, 王艳彦, 等. 二氧化碳合成碳酸二甲酯催化体系及活化机理的研究进展[J]. 可再生能源, 2010, 28(5): 120-123.Chen Hongping, Guo Hongxia, Wang Yanyan, et al. The research status of the catalytic system of CO2synthesis for dimethyl carbonate and the activation mechanism[J]. Renewable Energy Resources, 2010, 28(5): 120-123.
[4]Cai Qinghai, Lu Bin, Guo Lingji, et al. Studies on synthesis of dimethyl carbonate from methanol and carbon dioxide[J]. Catalysis Communications, 2009, 10(11): 605-609.
[5]Aouissi A, Alothman Z A, Alamro A. Gas-phase synthesis of dimethyl carbonate from methanol and carbon dioxide over Co1.5PW12O40Keggin-type heteropolyanion[J]. International Journal of Molecular Sciences, 2010, 11(10): 1343-1351.
[6]Tomishige K, Sakaihori T, Ikeda Y, et al. Catalysic properties and strncture of zirconia catalysts for direct synthesis of dimethyl carbonate from methanol and carbon dioxide[J]. Journal of Catalysis, 2000, 192(2): 355-362.
[7]Jung K T, Bell A T. An in situ infrared study of dimethyl carbonate synthesis from carbon dioxide and methanol over zirconia[J].Journal of Catalysis, 2001, 204(9): 339-347.
[8]Tomishige K, Sakaihori T, Ikeda Y, et al. CeO2-ZrO2solid solution catalyst for selective synthesis of dimethyl carbonate form methanol and carbon dioxide[J]. Catalysis Letters, 2001, 76(1/2): 71-74.
[9]Ikeda Y, Asadullah M, Fujimoto K, et al. Structure of the active sites on H3PO4/ZrO2catalysts for dimethyl carbonate synthesis from methanol and carbon dioxide[J]. Journal of Physico and Chimica, 2001, 105(8): 10653-10658.
[10]周奇志. 二氧化碳和甲醇直接合成碳酸二甲酯的研究进展[J]. 化学通报, 2009, 3(3): 222-228.Zhou Qizhi. Progress in study on the synthesis of dimethyl carbonate from carbon dioxide and methanol[J]. Chemistry, 2009, 3(3):222-228.
[11]钟顺和, 黎汉生, 王建伟, 等. CO2和CH3OH直接合成碳酸二甲酯用Cu-Ni/ZrO2-SiO2催化剂[J]. 催化学报, 2000, 21(2): 117-120.Zhong Shunhe, Li Hansheng, Wang Jianwei, et al. The direct synthesized dimthyl carbonate of CO2and CH3OH using Cu-Ni/ZrO2-SiO2catalyst[J]. Chinese Journal of Catalysis, 2000, 21(2): 117-120.
[12]钟顺和, 黎汉生, 王建伟, 等. CO2和 CH3OH 直接合成碳酸二甲酯用 Cu-Ni/V2O5-SiO2催化剂[J]. 物理化学学报, 2000, 16(3):226-231.Zhong Shunhe, Li Hansheng, Wang Jianwei, et al. The direct synthesized dimthyl carbonate of CO2and CH3OH using Cu-Ni/V2O5-SiO2catalyst[J]. Acta Physico-Chimica Sinica, 2000, 16(3): 226-231.
[13]钟顺和, 黎汉生, 王建伟, 等. 用二氧化碳和甲醇直接合成碳酸二甲酯的研究[J]. 石油炼制与化工, 2000, 31(6): 51-55.Zhong Shunhe, Li Hansheng, Wang Jianwei, et al. Research on the direct synthesized dimthyl carbonate of CO2and CH3OH[J].Petroleum Processing and Petrochemicals, 2000, 31(6): 51-55.
[14]Bian J, Xiao M, Wang S J, et al. Direct synthesis of DMC from CH3OH and CO2over V-doped Cu-Ni/AC catalysts[J]. Catalysis Communications, 2009, 10(10): 1142-1145.
[15]Wang Haiyan, Ji Weidong, Han Daxiong. Layered zirconium phosphate-supported metallophyrin: synthesis and catalytic application[J].2008, 19(7): 1330-1332.
[16]Zhang Fazhi, Xie Yaru, Lu Wei, et al. Preparation of microsphericalα-zirconium phosphate catalysts for conversion of fatty acid methyl esters to monoethanolamides[J]. Journal of Colloid and Interface Science, 2010, 349(5): 571-577.
[17]Wang Haiyan, Zhou Mingjian, Li Na, et al. Preparation and characterization of ionic liquid intercalation compounds into layered zirconium phosphates[J]. Mater Science, 2007, 42(6): 7738-7744.
[18]Hashimoto C, Nakajima Y, Tadashi Terada, et al. Effect of the preparation conditions of zirconium phosphate on the characteristics of Sr immobilization[J]. Journal of Nuclear Materials, 2011, 408(3): 231-235.
[19]Bellezza F, Cipiciani A, Costantino U, et al. Aza-Diels-Alder reaction of danishefsky’s diene with immines catalyzed by porousα-zirconium hydrogen phosphate and SDS under solvent-free conditions[J]. Catalysis Today, 2010, 152(1): 61-65.
[20]Curini M, Chimichi F E, Montanari F, et al. Potassium exchanged layered zirconium phosphate as catalyst in the preparation of 4H-chromenes[J]. Tetrahedron Letters, 2005, 46(3): 3497-3499.

