醋酸环己酯催化水解动力学
张竹修,汤吉海,陈幸福,金 浩,陈 献,费兆阳,2,刘 清,崔咪芬,乔 旭,2
1.南京工业大学化工学院,江苏 南京 210009 2.南京工业大学材料化学工程国家重点实验室,江苏 南京 210009
环己醇是重要化工中间体,在生产尼龙和己内酰胺等方面具有广泛的应用价值[1]。传统工艺,如日本旭化成公司开发的由苯部分加氢生成环己烯再直接水合生产环己醇的生产路线,受到环己烯在水中溶解度低及平衡转化率低的影响,存在环己烯直接水合难度大和环己醇收率低的缺点[2-4]。环己酯水解制备环己醇的工艺采用环己烯先酯化再水解的间接水合路线,具有很高的转化率和环己醇收率[5,6]。Steyer等[7]研究了树脂催化甲酸环己酯水解制备环己醇,但是水解生成的甲酸高温易分解,采用醋酸环己酯水解生成环己醇和醋酸,醋酸比甲酸稳定,过程更友好。靳敬敬等[8]在研究HZSM-5催化醋酸环己酯水解制备环己醇的反应过程中发现,离子液体[HSO3-bmim]HSO4可以抑制醋酸环己酯的高温分解,最终环己醇的收率可达到65%。磺酸树脂在醋酸环己酯水解反应中体现出较高的催化性能,是生产环己醇的优良催化剂,本工作采用D006型磺酸树脂为催化剂,研究醋酸环己酯水解的动力学规律,建立反应动力学模型,为水解反应器的优化设计及反应精馏过程开发奠定基础,推动环己烯经酯化水解两步法生产环己醇技术的工业化。
1 实验部分
1.1 醋酸环己酯水解制环己醇
称取适量的催化剂于真空干燥箱中50 ℃干燥1 d。在间歇釜式反应器中分别加入催化剂、醋酸环己酯和蒸馏水。边搅拌边加热至反应温度后开始计时。通过分析反应液组成随时间的变化来跟踪反应进程。
1.2 分析方法
利用毛细管气相色谱分析反应混合液组成。色谱仪为配备FID检测器的FULI-9750(浙江福立化工仪器有限公司),毛细管柱型号为XE-60(30 m×0.32 mm×0.25 μm)。载气为N2,柱前压力为0.1 MPa,汽化室温度为200 ℃,检测器温度为200 ℃,柱温为100 ℃。程序升温参数设置:初始温度为100 ℃,保留时间为2 min,升温速率为40 ℃/min,终点温度150 ℃,内标物为甲苯。
2 结果与讨论
2.1 外扩散影响
由于搅拌速率决定线速度,因此,在反应温度为 95 ℃,水与醋酸环己酯的物质的量之比1.0:1.5,催化剂用量12.5%(质量分数,以水和醋酸环己酯的总质量计),反应时间均为6 h的条件下,采用不同转速对水转化率(XB)的影响来考察外扩散对实验的影响,结果如图1所示。由图可知,在反应未达到化学平衡前,当搅拌速率从300 r/min增加到400 r/min时,水的转化速率随搅拌速率的增大明显加快;当转速在400 r/min增加至500 r/min时,水的转化速率变化减小,继续增加转速至700 r/min时,水的转化速率无变化。因此可以认为转速在超过500 r/min时,已将反应限制在动力学的可控区域内,外扩散影响基本消除。基于上述结果,本工作所有动力学实验都在700 r/min的转速下进行。

图1 搅拌转速对水转化率的影响Fig.1 Effects of stirring speed on the conversion of water
2.2 工艺条件影响
在水与醋酸环己酯物质的量之比为1.0:1.0,催化剂用量为12.5%的条件下,考察反应温度对醋酸环己酯催化水解反应的影响,结果见图2。由图可知,升高反应温度对反应速率是有利的,并且水的平衡转化率随着温度的升高而变大,表明水解反应为可逆吸热反应。
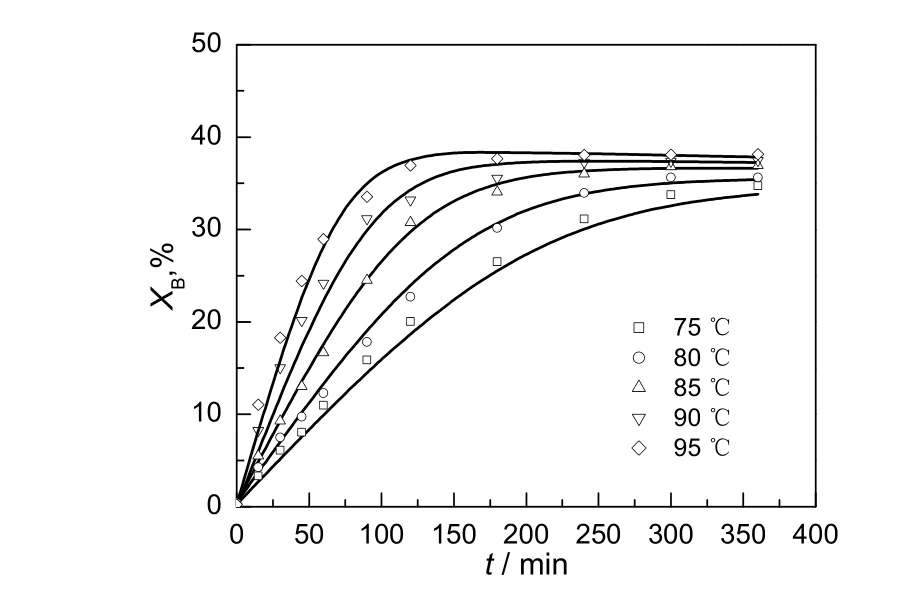
图2 温度对反应的影响Fig.2 Effects of reaction temperature on the conversion of water

图3 催化剂用量对反应的影响Fig.3 Effects of catalyst loading on the conversion of water
在水与醋酸环己酯物质的量之比为1.0:1.0,反应温度90 ℃的条件下,考察催化剂用量对醋酸环己酯催化水解反应的影响,结果见图3。由图可知,催化剂用量从10.0%增加到12.5%时,水的转化率达到35%所需时间由155 min缩短至125 min,继续增加催化剂用量至15.0%,水的转化率达到35%时所需时间继续缩短至105 min,反应时间缩短的幅度减小。
在催化剂用量为12.5%,反应温度90 ℃的条件下,考察反应物比例对醋酸环己酯催化水解反应的影响,结果见图4。由图可知,水的反应速率随着醋酸环己酯含量的增大而加快,而在醋酸环己酯过量时,水的转化率在达到最大值之后会出现降低的情况,这是由于醋酸环己酯在水解反应达到平衡后继续反应分解为醋酸与环己烯。

图4 水酯比对反应的影响Fig.4 Effects of initial molar ratio of water to cyclohexyl acetate on the conversion of water
2.3 动力学模型
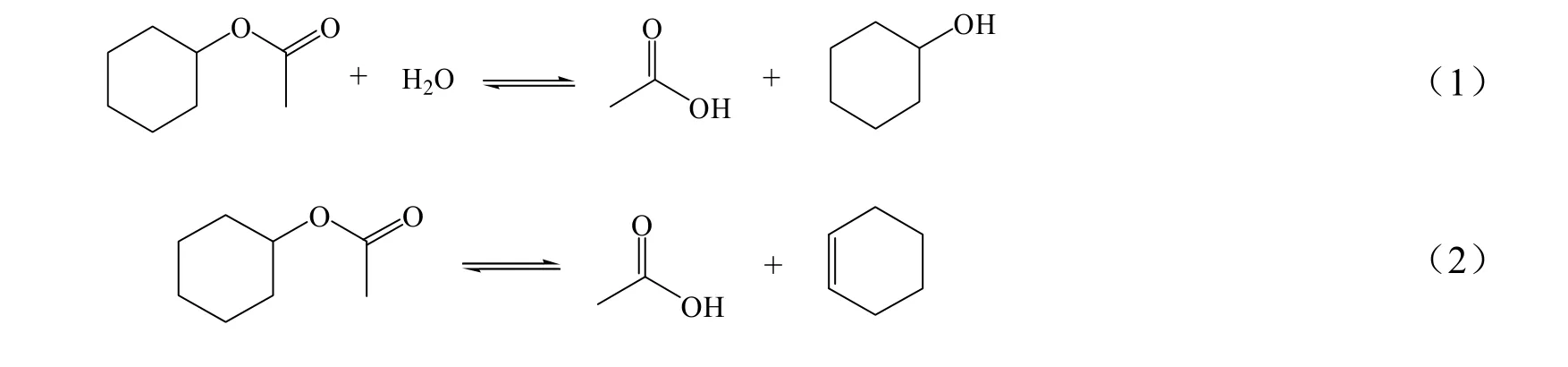
虽然醋酸环己酯(A)与水(B)的相互溶解度低,但在水含量少且反应温度高于75 ℃时,两者可互溶,并且考虑到反应时,部分水吸附在磺酸树脂催化剂表面的活性位,因此,实验时酯的物质的量将大于或等于水的量。醋酸环己酯水解生成环己醇(C)及醋酸(D)的过程中会伴随醋酸环己酯分解为醋酸及环己烯(E)的副反应,该反应也是可逆反应,具体反应式见式(1)和(2)。前期已对酯化反应的宏观动力学进行研究[9],因此本工作只对主反应进行数据回归。
采用LHHW模型研究水解反应动力学行为,用活度(α)来代替物质的量分数,见式(3)。采用NRTL模型计算活度。
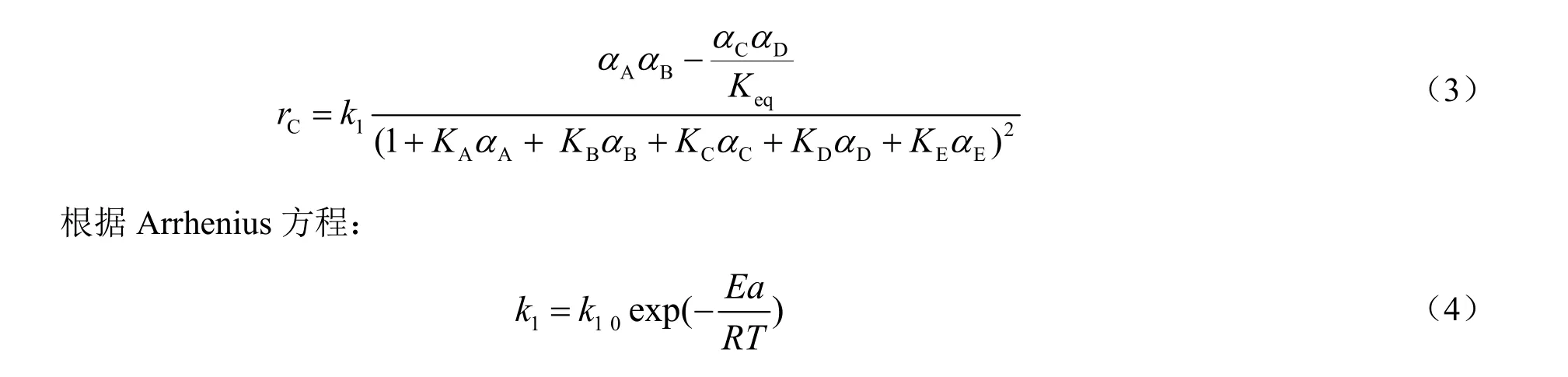
由于磺酸树脂催化剂具有亲水性,所以水的吸附平衡常数(Keq)将会远大于其他组分,同时忽略醋酸环己酯、环己醇及醋酸的吸附[10,11]。将式(4)代入式(3)可得到基于催化剂质量的环己醇生成速率表达式(5):
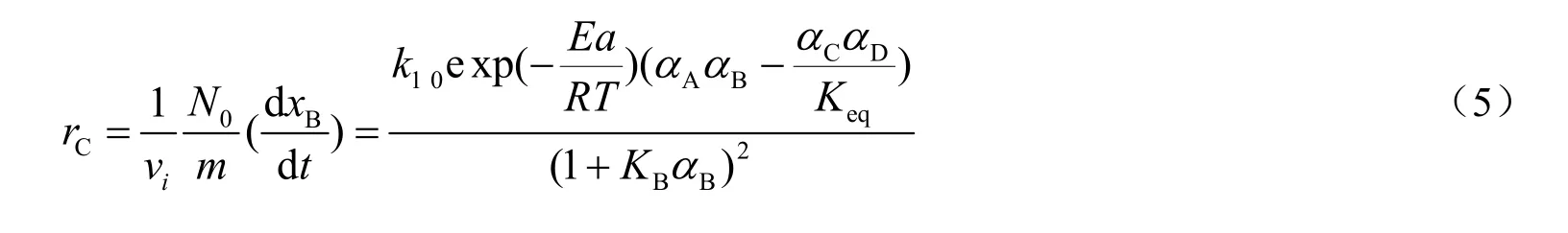
化学反应平衡常数由标准吉布斯自由能和反应温度共同决定,如式(6)所示[12,13],两边取自然对数后得到式(7):

化学反应平衡常数可通过式(8)计算,其中x和γ分别为各组分的物质的量分数和活度系数。

由水与醋酸环己酯的物质的量之比为 1.0:1.0时不同温度下的活度数据计算出化学平衡常数,将lnKeq对T-1作图,结果见图5。由图可知,化学平衡常数随温度的升高而增大,说明醋酸环己酯水解反应是吸热反应,升高温度可提高平衡转化率。通过图5中斜率和截距可求得该反应的标准反应焓及熵分别为 21.85 kJ/mol和 37.5 J/(mol·K)。公式(7)可变为:


图5 反应平衡常数与温度的关系Fig.5 Relationship between the reaction equilibrium constant and temperature
结合反应平衡常数及式(4)可得到积分方程式(10)。

2.4 动力学模型参数求解及验证
利用gPROMS编程进行醋酸环己酯水解反应实验数据的回归分析,图6为反应温度75 ℃,催化剂用量为12.5%的条件下,不同水与醋酸环己酯物质的量之比下,LHHW模型拟合结果与实验值比较。

图6 LHHW模型拟合和实验结果比较Fig.6 Comparison of experimental data and the LHHW kinetic model fitting a-molar ratio of water to cyclohexyl acetate 1.0:1.5; b-molar ratio of water to cyclohexyl acetate 1.0:1.0
由图6可知,各组分活度实验值与拟合曲线吻合良好,说明此模型对实验条件下的反应有非常高的拟合度。LHHW模型拟合得到的模型参数k10为9.532×106mol/(g·min),E1为60.939 J/mol,KB为5.2。在前期工作中[9]已得出醋酸、环己烯及醋酸环己酯的吸附平衡常数分别为0.04,0.23和0.11,因此,只考虑水的吸附平衡常数是合理的。
为检验动力学方程的适用性,同样采用F统计检验进行分析。模型的统计结果显示,该模型相关性系数ρ2为0.999,大于0.9;F为86 788,远大于10F0.05(F0.05为9.23)。这说明LHHW模型在统计上是显著的,模型是可靠的。
3 结 论
在消除反应外扩散影响基础上,研究了 80~95 ℃内 D006型催化剂催化醋酸环己酯水解的宏观动力学特性,并根据不同温度下反应平衡常数计算得到标准反应焓和反应熵分别为 21.85 kJ/mol和37.5 J/(mol·K)。根据反应动力学数据进行LHHW动力学模型拟合,拟合效果较好。为环己烯与醋酸酯化生产醋酸环己酯的反应器设计与反应精馏集成工艺开发奠定了基础。

[1]Ye J C, Li J, Sha Y. Evaluation of reactive distillation and side reactor configuration for direct hydration of cyclohexene to cyclohexanol[J]. Industrial & Engineering Chemistry Research, 2014, 53(4): 1461-1469.
[2]Misono M, Inui T. New catalytic technologies in Japan[J]. Catalysis Today, 1999, 51(3/4): 369-375.
[3]单祥雷, 程振民. 环己烯水合制备环己醇反应条件的优化[J]. 化学反应工程与工艺, 2008, 24(3): 252-256.Shan Xianglei, Cheng Zhenmin. Optimization of cyclohexanol synthesis from hydration of cyclohexene[J]. Chemical Reaction Engineering and Technology, 2008, 24(3): 252-256.
[4]Qiu T, Wang X D, Tian H. Liquid-liquid equilibrium for the system water + 1,4-dioxane + cyclohexanol over the temperature range of 313.2-343.2 K[J]. Fluid Phase Equilibria, 2012, 324: 28-32.
[5]Imam R A, Freund H, Guit R. Evaluation of different process concepts for the indirect hydration of cyclohexene to cyclohexanol[J].Organic Process Research & Development, 2013, 17(3): 343-358.
[6]Steyer F, Freund H, Sundmacher K A. Novel reactive distillation process for the indirect hydration of cyclohexene to cyclohexanol using a reactive entrainer[J]. Industrial & Engineering Chemistry Research, 2008, 47(23): 9581-9587.
[7]Steyer F, Sundmacher K. Cyclohexanol production via esterification of cyclohexene with formic acid and subsequent hydration of the esters reaction kinetics[J]. Industrial & Engineering Chemistry Research, 2007, 46(4): 1099-1104.
[8]靳敬敬, 李 芳, 杨丽红. HZSM-5催化乙酸环己酯水解反应[J]. 石油学报(石油加工), 2014, 30(1): 169-174.Jin Jingjing, Li Fang, Yang Lihong. Hydrolyzation of cyclohexyl acetate over HZSM-5 catalyst[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2014, 30(1): 169-174.
[9]陈幸福, 陈 献, 汤吉海. 醋酸与环己烯酯化合成醋酸环己酯宏观动力学[J]. 石油化工, 2015, 31(1): 63-68.Chen Xingfu, Chen Xian, Tang Jihai. Intrinsic kinetic research on synthesis tea-butyl acrylate by addition esterification of acrylic acid and isobuten[J]. Petrochemical Technology, 2015, 31(1): 63-68.
[10]Ostaniewicz-Cydzik A M, Pereira C S M, Molga E. Reaction kinetics and thermodynamic equilibrium for butyl acrylate synthesis fromn-butanol and acrylic acid[J]. Industrial & Engineering Chemistry Research, 2014, 53(16): 6647-6654.
[11]Graca N S, Pais L S, Silva V M T M, et al. Oxygenated biofuels from butanol for diesel blends: synthesis of the acetal 1,1-dibutoxyethane catalyzed by amberlyst-15 ion-exchange resin[J]. Industrial & Engineering Chemistry Research, 2010, 49(15):6763-6771.
[12]Shan X, Cheng Z, Yuan P. Reaction kinetics and mechanism for hydration of cyclohexene over ion-exchange resin and H-ZSM-5[J].Chemical Engineering Journal, 2011, 175: 423-432.
[13]Mao W, Wang X, Wang H. Thermodynamic and kinetic study of tert-amyl methyl ether (TAME) synthesis[J]. Chemical Engineering and Processing: Process Intensification, 2008, 47(5): 761-769.
[14]杨仙健, 汤吉海, 费兆阳. 丙烯酸与异丁烯酯化合成丙烯酸叔丁酯动力学[J]. 化学反应工程与工艺, 2015, 31(1): 63-68.Yang Xianjian, Tang Jihai, Fei Zhaoyang. Intrinsic kinetic research on synthesis tea-butyl acrylate by addition esterification of acrylic acid and isobutene[J]. Chemical Reaction Engineering and Technology, 2015, 31(1): 63-68.

