乙醇中硝酸还原工艺条件及Pd-Cu催化剂研究
李文龙,李 扬,王 科,董玲玉,袁小金,范 鑫
西南化工研究设计院有限公司,四川 成都 610225
乙二醇属于大宗化工产品,是重要的有机化工原料[1,2]。石油法生产的乙二醇是国内的主要供应来源,但产量有限,每年仍需大量进口乙二醇[3,4]。我国具有丰富的煤炭资源,采用煤制合成气经草酸酯制乙二醇路线在我国迅速发展[5]。在煤制乙二醇技术路线中,亚硝酸酯再生反应过程中会产生大量的副产物硝酸,硝酸的浓度大概为2%(质量分数)左右,目前,工业中对该硝酸的处理方法主要为加入化学计量的NaOH中和,然后将含有大量硝酸钠的废液直接排放,环保成本较大。因此,含酸废水的处理一直成为煤制乙二醇项目正常运行的一大难题。
NO与HNO3和醇的混合溶液反应会生成亚硝酸酯(见式1),在该反应中硝酸是氧化剂,而NO作为还原剂与硝酸发生氧化还原反应生产NO2,NO2再与NO反应生产N2O3,进而再与醇溶液进行酯化反应生成亚硝酸酯。该反应可以使HNO3中的N元素被转化为目的产物亚硝酸酯,提高了亚硝酸酯的收率,同时减少了后续过程甲醇废液分离精制步骤中的能耗及硝酸处理的问题。目前关于乙二醇生产中硝酸还原再利用的报道较少,Sugise等[6]提出采用NO与HNO3和醇的混合溶液反应制取亚硝酸酯,同时可以通过添加硝酸盐的方式增加亚硝酸酯的收率,但是该过程会引入新的杂质,对乙二醇后续工艺将造成分离困难的问题。陈鹏等[7,8]对NO与HNO3和甲醇制亚硝酸甲酯的工艺条件进行了研究,考察了气体流速、反应时间、温度和压力等因素对亚硝酸甲酯收率的影响,对于催化剂的开发并未见相关研究。高明亮[9]对乙二醇生产中硝酸的还原进行较为详细的研究,从理论上研究了硝酸还原实验的可行性,同时制备了催化剂,考察了载体及载体形式、活性组分及负载量,最终选择以Pd为活性组分,改性硅胶作为载体,在液相空速1 h-1、气相空速不低于200 h-1、催化剂床层温度不低于75 ℃、压力0.2 MPa、原料酯化循环甲醇液中HNO3含量为1.5%的条件下,硝酸的转化率不低于85%。但是贵金属Pd负载量为3.5%(质量分数),负载量过高,催化剂的成本增加。
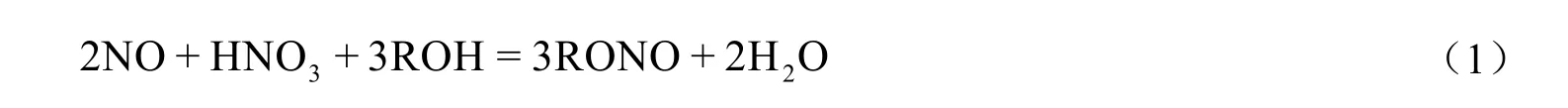
合成气经草酸酯制乙二醇工艺可以分为甲醇和乙醇体系两种路线。相比乙醇体系,由于甲醇的沸点比乙醇的低,采用甲醇体系合成乙二醇,可以减少后端工序分离提纯的能耗,但是草酸二甲酯的熔点较高(54℃),对管道保温要求高,且极易发生管道堵塞。而采用乙醇体系可以避免管道堵塞,同时在加氢工序可以减少副产物的种类,如避免副产物1,3-丙二醇的生成。鉴于目前对乙醇体系制乙二醇中硝酸还原反应的研究未见报道,本工作采用间歇反应釜,对乙醇体系中硝酸还原工艺条件进行考察,并以Pd和Cu为活性组分,采用不同的载体用浸渍法制备了双金属负载型Pd-Cu催化剂,考察了制备条件对该催化剂的影响以及其在硝酸还原反应中的催化性能。
1 实验部分
1.1 催化剂的制备
所用载体:椰壳活性炭(AC)购自重庆天池化工有限公司;a-Al2O3由西南化工研究设计院有限公司提供;LiAlO载体自制[10];纯SiO2和SiO2硅胶颗粒购自青岛海洋化工有限公司。
采用浸渍法制备负载型催化剂。以Pd(NO3)2为前驱物,配置成Pd溶液,取一定量颗粒大小分布在0.18~0.25 mm(40~80目)的载体,将配置好的Pd溶液缓慢滴加到载体中,其中Pd的负载量为2%(质量分数),等体积浸渍4 h,110 ℃干燥12 h,300 ℃焙烧4 h。最后在纯H2条件下,250 ℃还原4 h,获得单金属Pd催化剂。
以Pd(NO3)2和Cu(NO3)2·3H2O为前驱物,配置成Pd和Cu的混合溶液,取一定量颗粒大小分布在0.18~0.25 mm(40~80目)的载体,将配置好的Pd和Cu混合溶液缓慢滴加到载体中,其中Pd的负载量为2%(质量分数),Pd和Cu物质的量之比1:2,等体积浸渍4 h,110 ℃干燥12 h,300 ℃焙烧4 h。最后在纯H2条件下,250 ℃还原4 h,获得双金属Pd-Cu催化剂。
1.2 催化剂评价
硝酸还原反应在间歇搅拌反应釜中进行,反应器体积为100 mL,采用水浴加热控温,磁力转子搅拌。反应时,先加入1 g催化剂和30 g反应液,然后水浴加热控制反应温度,N2备压到反应压力0.2 MPa时,关闭N2,通入反应气体NO,开启磁力搅拌,转速为20 r/min,尾气经背压阀后排空,反应一段时间后,停止反应,收集液相。采用酸碱滴定分析液相,测定溶液中硝酸的浓度。
2 结果与讨论
2.1 工艺条件对硝酸还原反应的影响
为了实验数据更接近实际工业中乙二醇生产的操作,本研究将乙醇体系中亚硝酸酯再生反应产生的废液(质量分数分别为2.005%的HNO3和74%的乙醇水溶液)和系统压力(0.2 MPa)作为反应液和反应压力,对硝酸还原反应的工艺条件进行考察。
2.1.1 NO含量的影响
在反应温度70 ℃,压力0.2 MPa,液相60 g,气体流量为25 mL/min,反应时间60 min的条件下,NO含量对硝酸还原反应的影响见表1。由表可看出,采用纯NO经反应一段时间后,能够有效降低硝酸的浓度,硝酸最终浓度可降到0.130%。在乙二醇工业生产中,再生反应塔反应设备出口气体中NO的含量约为10%(体积分数),将该工艺气体的一部分和再生反应的废液引入下一个设备进行硝酸还原反应以减少废液中硝酸的浓度,采用10%的NO进行反应,反应后硝酸消耗较少,硝酸的浓度仅降低至1.877%。NO作为反应气的原料气,其浓度对反应的结果影响较大,在后续的研究中均采用体积分数为10%的NO。

表1 NO含量的影响Table 1 Effect of NO concentration on reaction
2.1.2 气体流量的影响
在反应温度70 ℃,压力0.2 MPa,液相30 g,反应时间30 min条件下,硝酸转化率和浓度随气体流速的变化结果如表2所示。由表可看出,当气体流量为26.50 mL/min时,硝酸转化率仅为22.16%,反应后硝酸浓度仅降到1.738%。增大气体流量为92.80 mL/min,硝酸转化率提高到40.18%,反应后硝酸的浓度降低到1.363%。当气体流速增大到148.88 mL/min,硝酸转化率达到了54.26%,硝酸的浓度降为1.035%,继续增大气体流量到201.60 mL/min,硝酸转化率为51.94%,硝酸的浓度降为1.095%。经计算,质量分数为2.005%的30 g HNO3反应液与10%的NO反应30 min,HNO3完全转化所需的最小气体流量为142 mL/min。因此,气体流速由26.50 mL/min增加到148.88 mL/min时,气体进料量增大,液相中的HNO3消耗量增多,硝酸转化率提高,反应后硝酸的浓度逐渐降低。当气体流速超过148.88 mL/min时,液相中HNO3的消耗达到平衡状态,但是NO气体在液相中的停留时间变短,因此硝酸的转化率略微有所降低,反应后硝酸的浓度略微有所增加,但是变化不大。考虑到NO成本较高,气体流量为148.88 mL/min为宜。
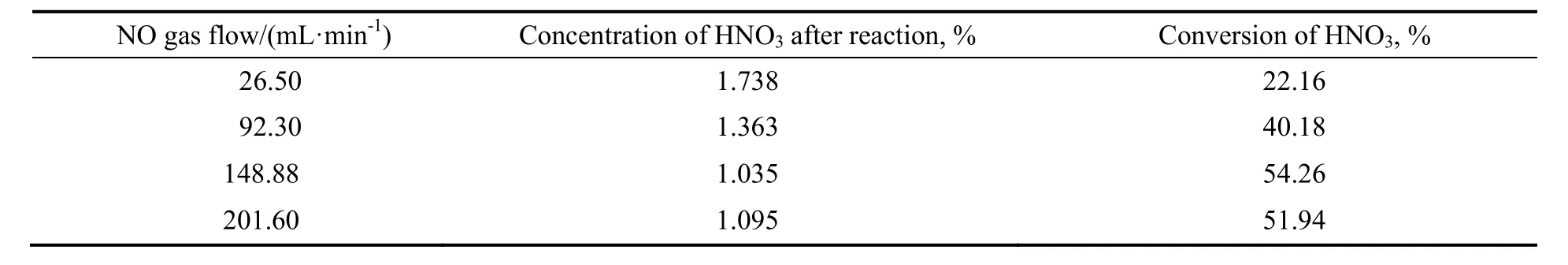
表2 NO气体流量的影响Table 2 Effect of NO gas flow on reaction
2.1.3 反应时间的影响
在反应温度70 ℃,压力0.2 MPa,液相30 g,气体流量为148.88 mL/min条件下,硝酸转化率和浓度随反应时间的变化结果如表3所示。由表可看出,在反应时间为30 min时,硝酸的转化率为54.26%,硝酸由最初的2.005%降低到1.035%,浓度降为原来浓度的一半,随着反应时间增加,硝酸浓度持续降低,反应60 min后,硝酸转化率达到了92.94%,硝酸的浓度已经降低到0.168%。为了便于考察催化剂的催化效果,选择反应时间为30 min来进行催化剂的评价。
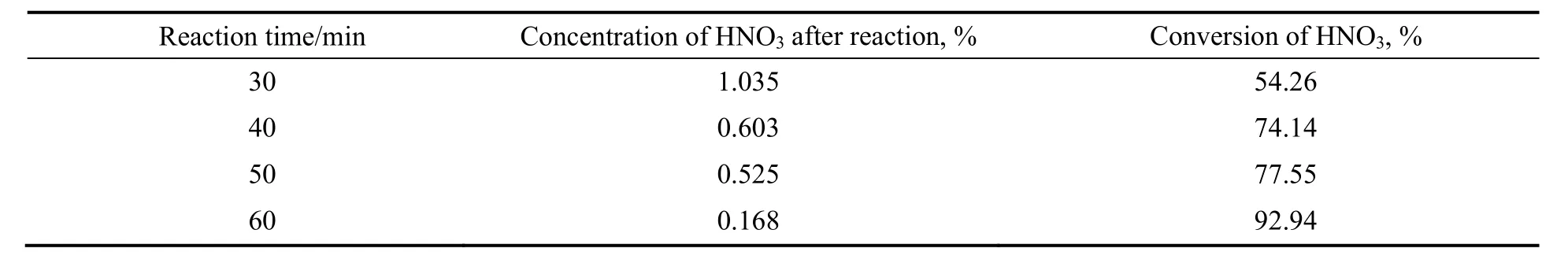
表3 反应时间的影响Table 3 Effect of reaction time on reaction
2.1.4 反应温度的影响
在压力0.2 MPa,液相30 g,气体流量为148.88 mL/min,反应时间30 min条件下,反应温度对硝酸转化率与浓度的影响如表4所示。由表可看出,在室温25 ℃下,稀硝酸、乙醇与NO几乎不发生反应,当温度升高到50 ℃,反应30 min后,硝酸有所消耗,硝酸转化率不高,仅为26.79%。当反应温度为60 ℃,硝酸转化率进一步提高到43.66%,硝酸浓度降低到1.334%。反应温度升高到70 ℃,硝酸转化率达到 54.26%,但是总体变化不大。这是由于温度较低时,反应速率相对较低,硝酸消耗减慢,导致硝酸转化率不高。反应温度升高,反应速率增大,但是原料气在液相中的溶解量相应减少,硝酸的消耗也相应减少,致使硝酸的总体转化率变化不大。考虑到反应温度高,生成的亚硝酸乙酯气体在溶液中的溶解量少,为了减少分析误差,反应温度为70 ℃较合适。
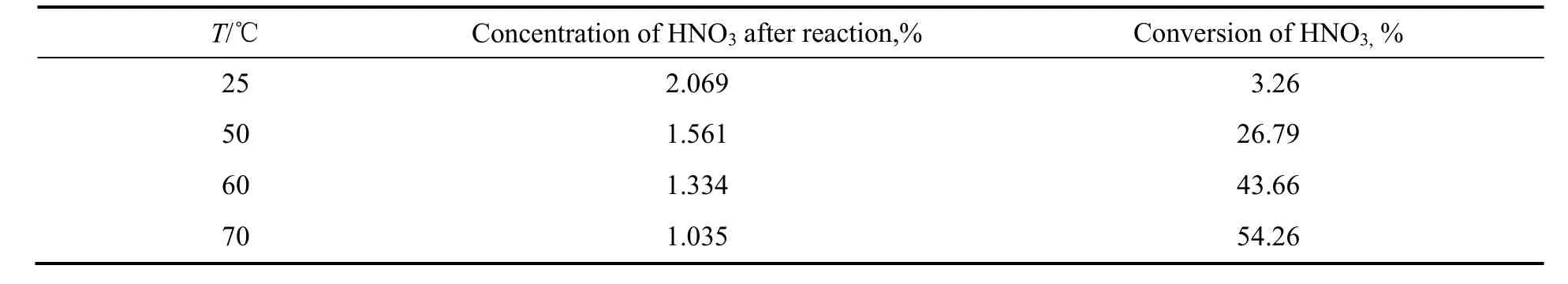
表4 反应温度的影响Table 4 Effect of reaction temperature on reaction
2.2 催化剂性能
在硝酸还原实验中,添加催化剂能够提高反应效率,缩短反应时间,提高硝酸转化率,以达到降低液相中硝酸的浓度。在催化剂装填量1 g,反应温度70 ℃,压力0.2 MPa,HNO3质量分数为2.005%的液相30 g,体积分数为10%的NO流量为148.88 mL/min和反应时间30 min的条件下,考察了Pd-Cu催化剂催化硝酸还原的性能以及制备条件对催化剂性能的影响。
2.2.1 Pd-Cu催化剂的催化性能
单金属Pd与双金属Pd-Cu催化剂的硝酸催化还原实验结果如表5所示。由表可看出,Pd/SiO2催化剂的催化活性较差,其反应后的硝酸浓度及转化率与未添加催化剂时相近;添加第二金属元素Cu后,硝酸转化率提高到72.48%,反应后硝酸浓度降到0.660%。表明Cu元素的添加能够明显提高催化剂催化硝酸还原的性能。双金属Pd-Cu催化剂常用于水溶液中硝酸盐的还原研究[11-16],金属Cu作为第二活性组分,在硝酸根的还原过程中起着重要作用,研究表明,单独金属Pd在硝酸盐还原实验中表现出较弱的活性,而引入Cu离子后,载体表面形成了Pd-Cu活性位,Pd-Cu活性位对NO3-还原为NO2-具有较强的活性[13],促进了NO3-的还原,进而提高了催化剂活性和选择性[14,15]。在本研究中,Cu离子的引入,可能使得载体表面形成Pd-Cu活性位,促进了NO3-还原为NO2-,进而提高了硝酸转化率,最终使得硝酸的浓度降低。

表5 Pd-Cu催化剂的催化性能Table 5 Catalytic performance of Pd-Cu catalyst
2.2.2 焙烧温度的影响
在反应结束后,反应液变黄,表明催化剂载体表面部分活性组分Pd和Cu出现溶解现象[17],因此,在催化剂制备过程中,提高焙烧温度至 500和 700 ℃,以增强活性组分与载体之间的结合力,减少活性组分的流失。焙烧温度对Pd-Cu/SiO2催化剂性能的影响如表6所示。由表可看出,焙烧温度为 500 ℃时,Pd-Cu/SiO2催化剂的催化性能变化不大,当焙烧温度达到 700 ℃时,Pd-Cu/SiO2催化剂活性有所降低,硝酸转化率降到了 61.08%。可能由于较高焙烧温度下,载体表面金属组分出现团聚,载体孔道结构部分遭到破坏,引起催化剂活性降低。反应结束后,反应液呈淡黄色,颜色变浅,表明提高焙烧温度,能够部分减少活性组分的流失。

表6 焙烧温度对Pd-Cu催化剂性能的影响Table 6 Effect of calcination temperature on performance of Pd-Cu catalyst
2.2.3 载体种类的影响
载体种类对Pd-Cu催化剂性能的影响如表7所示。由表可看出,当以LiAlO尖晶石、a-Al2O3和纯SiO2为载体时,其催化性能较差,且反应后出现活性组分溶解现象,LiAlO尖晶石和a-Al2O3载体部分溶解;以SiO2硅胶为载体时,Pd-Cu催化剂的活性部分提高,硝酸转化率提高到72.48%,反应后硝酸浓度降到0.660%,但是催化剂失活较快(见表8);当采用AC做催化剂时,硝酸的转化率偏低,与未添加催化剂的反应效果接近,而以AC为载体负载活性组分Pd-Cu时,催化剂表现出较高的催化活性,硝酸的转化率高达83.54%,反应后硝酸浓度降为0.395%。这是因为活性炭载体空隙结构发达、表面化学性质稳定以及有较大的比表面积,负载活性组分后更有利于活性组分的分散[17-19],进而提高了催化剂的催化性能,但仍有活性组分流失现象。
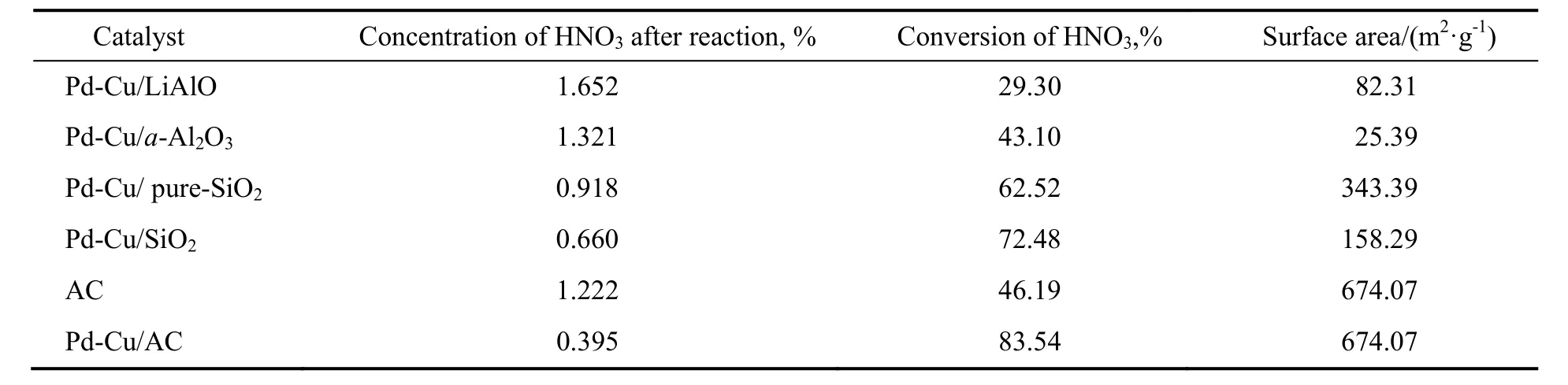
表7 载体对Pd-Cu催化剂性能的影响Table 7 Effect of support on performance of Pd-Cu catalyst
2.3 催化剂稳定性
在反应温度70 ℃,压力0.2 MPa,液相30 g,气体流量为148.88 mL/min,催化剂装填量1 g,每次反应时间30 min的条件下,Pd-Cu催化剂循环使用次数的实验结果如表8和9所示。
表8为Pd-Cu/SiO2催化剂循环实验次数的实验结果。从表可看出,第一次反应,Pd-Cu/SiO2催化活性较高,硝酸转化率可达72.48%;循环使用一次后,催化剂开始失活,循环使用第3次,Pd-Cu/SiO2催化剂已经失活,硝酸的转化率降到了49.90%,与未添加催化剂的反应结果相近。

表8 P d-Cu/SiO2催化剂稳定性Table 8 Stability of Pd-Cu/SiO2 catalyst
表9为Pd-Cu/AC催化剂循环实验次数的实验结果。由表可以看出,AC为载体的催化剂具有较好的催化活性和稳定性。反应后硝酸的转化率维持在 68%~87%,多次循环使用后,Pd-Cu/AC催化剂依然能保持较好的催化活性。
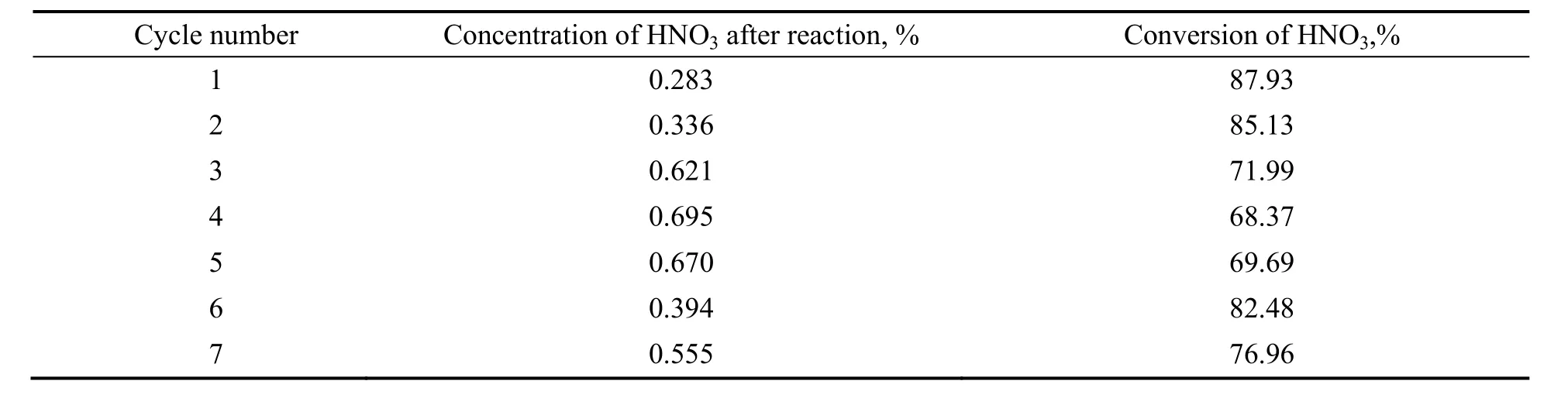
表9 Pd-Cu/AC催化剂稳定性Table 9 Stability of Pd-Cu/AC catalyst
3 结 论
a)在间歇反应釜中进行乙醇体系的硝酸催化还原实验是可行的,能够有效降低反应后液相中硝酸的浓度,进而可以减少后续精馏工艺的能耗以及含酸废水的排放,同时为工业中乙醇体系的硝酸还原工艺提供理论依据。
b)硝酸的转化率随原料气 NO的体积分数、反应时间及反应温度的增加而增大;气体流量增大,硝酸转化率增加,最后趋于稳定。较佳的工艺条件为:反应温度70 ℃、压力0.2 MPa,体积分数为10%的NO气体流量148.88 mL/min,反应时间30 min,HNO3质量分数为2.005%的反应液30 g。在该实验条件及无催化剂下,硝酸的转化率为54.26%,反应后硝酸的浓度降为1.035%。
c)Cu离子的引入能够增强单金属Pd催化剂的活性;催化剂焙烧温度增加,能够适当减少活性组分的流失,焙烧温度为700 ℃,催化剂活性降低。
d)相比于其他载体,活性炭载体负载的Pd-Cu双金属催化剂具有较好的催化活性和稳定性,能够有效降低液相中硝酸的浓度,在较佳工艺条件下催化硝酸还原反应,硝酸的转化率高达 83.54%,反应后硝酸浓度降为0.395%。
[1]Yue H, Zhao Y, Ma X, et al. ChemInform abstract: ethylene glycol: properties, synthesis, and applications[J]. Chemical Society Reviews,2012, 43(35): 42-18.
[2]骆 雁. 国内乙二醇生产现状及发展趋势[J]. 齐鲁石油化工, 2012, 40(1): 64-67.Luo Yan. Status and development of domestic ethanediol[J]. Qilu Petrochemical Technology, 2012, 40(1): 64-67.
[3]洪 海, 费利江, 唐 勇, 等. 国内煤制乙二醇研究与产业化进展[J]. 化工进展, 2010, 29(S1): 349-352.Hong Hai, Fei Lijiang, Tang Yong, et al. Research and industrialization of ethylene glycol in China[J]. Chemical and Engineering Progress, 2010, 29(S1): 349-352.
[4]Song Mei, Fei Lijiang, Tang Yong, et al. Progress in synthesis of ethylene glycol through C1 chemical industry routes[J]. Chinese Journal of Catalysis, 2013, 6(34): 1035-1050.
[5]丰存礼. 国内乙二醇生产工艺技术情况与市场分析[J]. 化工进展, 2013, 32(5): 1200-1204.Feng Cunli. Production technology and market analysis of domestic ethylene glycol[J]. Chemical Industry and Engineering Progress,2013, 32(5): 1200-1204.
[6]Sugise R, Tanaka S, Hirofumi I I, et al. Process for producing alkyl nitrite: EP, 1346976A1[P]. 2003-09-24.
[7]陈 鹏. 自吸式搅拌鼓泡反应器中硝酸还原反应的研究[J]. 化学工程与装备, 2016, (9): 59-61.Chen Peng. Study of nitric acid reduction reaction in self-priming bubbling reactor[J]. Chemical Engineering & Equipment, 2016, (9): 59-61.
[8]李文龙, 王玮涵, 李振花, 等. 一氧化氮与硝酸和甲醇反应制亚硝酸甲酯[J]. 化学反应工程与工艺, 2015, 31(2): 188-192.Li Wenlong, Wang Weihan, Li Zhenhua, et al. Synthesis of methyl nitrite from nitric oxide, nitric acid and methanol[J]. Chemical Reaction Engineering and Technology, 2015, 31(2): 188-192.
[9]高明亮. 乙二醇生产中硝酸催化还原的实验研究及应用[J]. 河南化工, 2016, (8): 33-37.Gao Mingliang. Study and application of catalytic nitric acid reduction in process of producing ethylene glycol[J]. Henan Chemical Industry, 2016, (8): 33-37.
[10]Yoshinaga Y, Akita T, Mikami I, et al. Hydrogenation of nitrate in water to nitrogen over Pd-Cu supported on active carbon[J]. Journal of Catalysis, 2002, 207(1): 37-45.
[11]Sakamoto Y, Kamiya Y, Okuhara T. Selective hydrogenation of nitrate to nitrite in water over Cu-Pd bimetallic clusters supported on active carbon[J]. Journal of Molecular Catalysis A Chemical, 2006, 250(1): 80-86.
[12]Soares O S G P, órfão J J M, Pereira M F R. Activated carbon supported metal catalysts for nitrate and nitrite reduction in water[J].Catalysis Letters, 2008, 126(3/4): 253-260.
[13]Chinthaginjala J K, Lefferts L. Support effect on selectivity of nitrite reduction in water[J]. Applied Catalysis B Environmental, 2010,101(1): 144-149.
[14]Soares O S G P, órfão J J M, Ruiz-Martínez J, et al. Pd-Cu/AC and Pt-Cu/AC catalysts for nitrate reduction with hydrogen: influence of calcination and reduction temperatures[J]. Chemical Engineering Journal, 2010, 165(1): 78-88.
[15]Trawczyński J, Gheek P, Okal J, et al. Reduction of nitrate on active carbon supported Pd-Cu catalysts[J]. Applied Catalysis A General,2011, 409(23): 39-47.
[16]李文龙, 董玲玉, 李 扬, 等. PdCl2-CuCl2/Li-Al-O催化CO和亚硝酸乙酯合成碳酸二乙酯的研究[J]. 天然气化工(C1化学与化工),2017, 42(2): 1-4.Li Wenlong, Dong Lingyu, Li Yang, et al. Synthesis of diethyl carbonate from CO and ethyl nitrite over PdCl2-CuCl2/Li-Al-O[J].Natural Gas Chemical Industry, 2017, 42(2): 1-4.
[17]Ramos A L D, Alves P D S, Aranda D A G, et al. Characterization of carbon supported palladium catalysts: inference of electronic and particle size effects using reaction probes[J]. Applied Catalysis A General, 2004, 277(1/2): 71-81.
[18]栗云彦,顾永万,张云峰,等. 活性炭载体的改性对钯炭催化剂性能的影响研究进展[J]. 贵金属, 2013, 34(3): 82-87.Li Yunyan, Gu Yongwang, Zhang Yunfeng, et al. Progress in the performance of Pd/C catalyst by the modification of activated carbon[J].Precious Metals, 2013, 34(3): 82-87.
[19]Wang L, Feng Y, Zhang Y, et al. Effect of original activated carbon support and the presence of NOxon CO oxidation over supported Wacker-type catalysts[J]. Fuel, 2012, 96(7): 440-445.

