P53-MDM2在普萘洛尔诱导血管瘤内皮细胞凋亡中的作用
姚天华 李全雁 李立峰 杜婧婷 Krishna Regmi葛苏蒙 屠军波
血管瘤是一种由血管内皮细胞异常增殖所形成的良性肿瘤,临床上,曾使用激光、干扰素、血管栓塞以及外科手术等方法来治疗血管瘤,但是,这些治疗只是抑制了血管内皮细胞的过度增殖,而促使血管瘤收缩的作用并不是很理想。2008年法国医生Léauté-Labrèze偶然发现口服普萘洛尔对婴幼儿血管瘤有不错的疗效后[1],很多学者对此进行了研究,充分肯定了这种非选择性β受体阻滞剂在婴幼儿血管瘤上的疗效[2~5]。JiYi等学者,用 100umol/L 普萘洛尔处理血管瘤内皮细胞诱发凋亡时[6],检测到caspase3、caspase9、bax等表达上调;我们运用生物信息学分析,发现这些相关的基因都位于P53凋亡通路的下游,这是否提示了我们P53信号转导通路参与了普萘洛尔诱导体外培养的人血管瘤内皮细胞的凋亡,而MDM2被认为是最重要的P53调节蛋白[7],能使细胞内的P53维持在一个较低的水平[8~10]。在本实验中,我们将对普萘洛尔诱导的血管瘤内皮细胞凋亡机制进行研究,初步研究P53、MDM2与普萘洛尔诱导血管瘤内皮细胞凋亡的关系,为血管瘤的治疗提供新的思路和靶点。
资料和方法
一、细胞来源及分组
离体血管瘤内皮细胞是人增殖期血管瘤内皮细胞(西安交通大学第二附属医院惠赠)。经培养、鉴定后,随机分为普萘洛尔组和空白对照组;普萘洛尔组调整药物浓度为100umol/L;空白对照组不给特殊处理。
二、形态学观察
1.倒置显微镜下观察细胞形态学改变:将处于对数生长期的细胞接种于6孔板中,每孔2×105/ml个细胞,在倒置显微镜下,连续动态观察24小时,记录两组细胞在形态学上的变化。
2.透射电镜观察细胞形态学改变:将处理24h后的细胞消化,放于10ml离心管中离心,弃上清液,电镜固定液固定,透射电镜观察记录(日本日立H-600)。
3.流式细胞仪检测细胞凋亡率:将处理24h后的细胞消化,10ml离心管离心,弃上清液,PBS(4℃)清洗沉淀的细胞两次,250μl结合缓冲液重悬,调整细胞密度为1×106/ml,100μl离体细胞悬液溶于5ml的流式管中,加入 Annexin V-FITC(5μl)和碘化丙锭溶液(10μl 20μg/ml)混均,室温下避光孵育(15min),反应管中加入400μl PBS,分析并记录数据。
4.PCR检测TP53与MDM2表达:①引物序列:首先NCBI数据库,查阅各检测基因,PRIMER5.0引物设计软件,进行设计,委托北京三博远志生物技术限公司合成引物。②收集24h时两组细胞,根据试剂盒说明书,依次进行细胞总RNA提取,DNase处理(选用)去除RNA样品中残留DNA,逆转录,实时荧光定量PCR,RT-PCR产物特异性检测。
5.Western blot鉴定凋亡关键蛋白P53和MDM2的表达:收集24h时两组细胞,根据试剂盒说明书,进行Ripa蛋白裂解液提取细胞蛋白,BCAkit蛋白定量,样品煮沸变性,将10%凝胶板放入电泳槽内,倒入1×RunningBuffer,每孔上样30ug总蛋白,电泳,流水冲洗下,取出胶片,湿转,用含5%脱脂奶粉的TBS室温封闭2小时,结合一抗,4℃过夜,漂洗,结合二抗,漂洗,发光:按商品说明于暗室中操作,梯度曝光。
6.统计学分析:每组样本设置三个平行副孔,重复三次独立实验,将所得到相近的数据,应用GraphPad Prism进行分析,用平均值±标准差表示,绘制柱状图;SPSS 13.0分析,t检验组间差异;P<0.05,组间差异有统计学意义。
结 果
一、细胞形态学观察
1.倒置显微镜观察结果:用100umol/L的普萘洛尔处理体外培养的血管瘤内皮细胞,在倒置纤维镜下,在24小时内,连续不断的观察血管瘤内皮细胞在形态学上的变化;细胞如图1,0~3h,体外培养的血管瘤内皮细胞,细胞形态呈现典型的“铺路石”状,细胞伸展充分,边缘锐利,细胞贴壁;8h,大部分血管瘤内皮细胞的细胞形态未出现明显的变化,小部分血管瘤内皮细胞的细胞边缘变得圆润,细胞贴壁良好,尚未出现细胞游离;到24h时,大部分细胞边缘圆润,呈凋亡相,如图1。
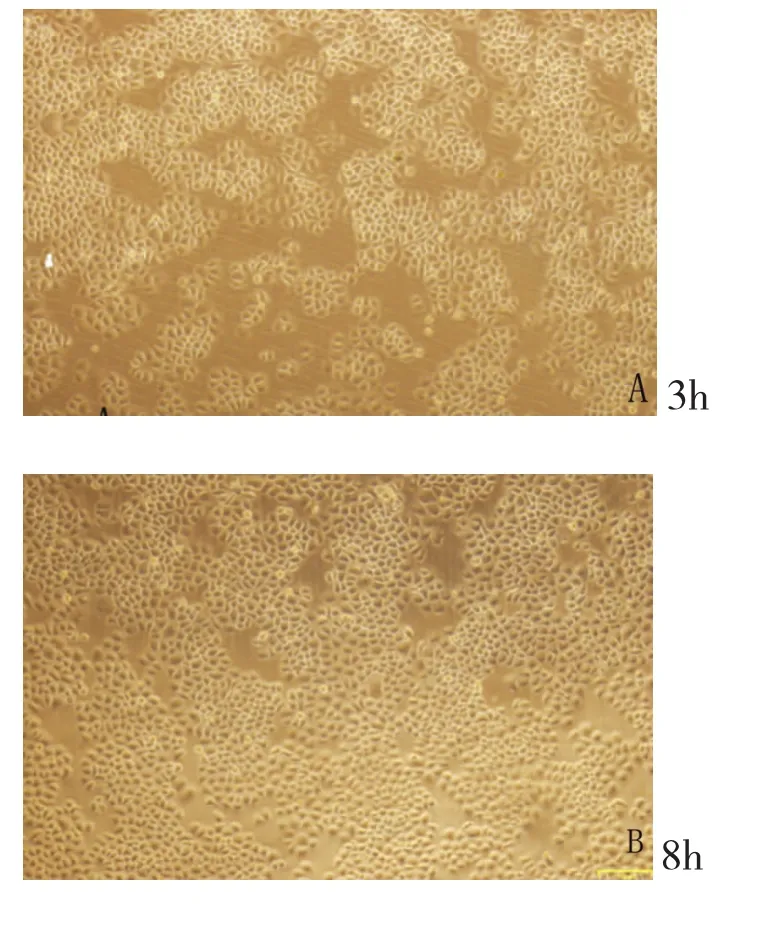
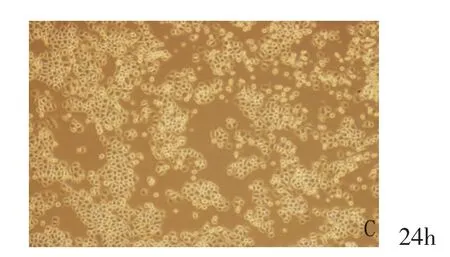
图1 实验组(100umol/L)各时间点倒置显微镜观察结果(标尺为161um)
2.血管瘤内皮细胞的鉴定:血管瘤内皮细胞的细胞质中有第Ⅷ凝血因子抗原的表达,在倒置显微镜下,经生物素标记抗体,DBA显色后,可看见血管瘤内皮细胞的细胞质中有棕黄色阳性颗粒散在分布,结合体外培养的细胞形态学特征和免疫组化学检测,证实培养的细胞为HEC;如图2。

图2 血管瘤内皮细胞第Ⅷ凝血因子抗原检测
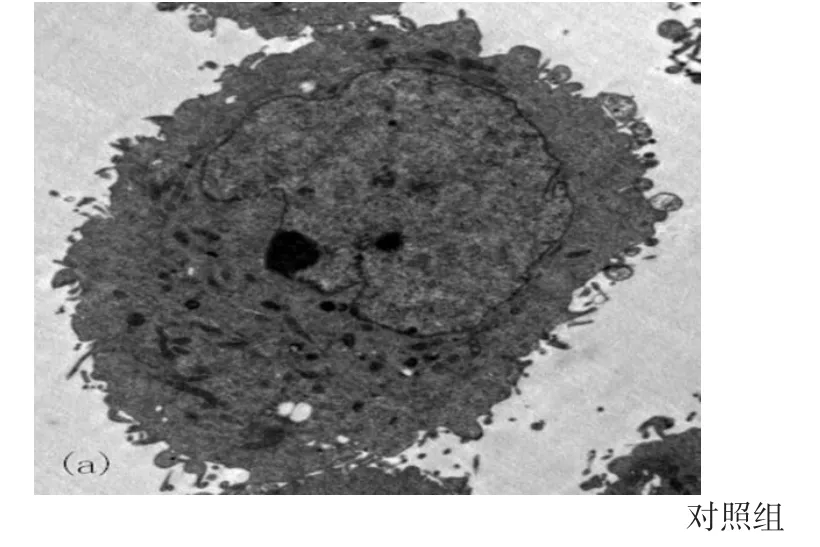

图3 电镜下,实验组与对照组24小时后,电镜下细胞形态学上的变化(标尺为5um)
3.透射电镜观察结果:如图3,对照组血管瘤内皮细胞的胞浆均一,表面有微绒毛存在。实验组细胞表面微绒毛消失,染色质边缘化,细胞核膜、细胞膜内陷,形成新月形致密小斑块,胞吐出w-p小体。
二、流式细胞仪检测凋亡率
通过流式细胞仪测量空白对照组和实验组血管瘤内皮细胞的凋亡情况,对照组凋亡率为4.87%,实验组细胞凋亡率为14.67%,两者相比具有统计学意义(P<0.05)。
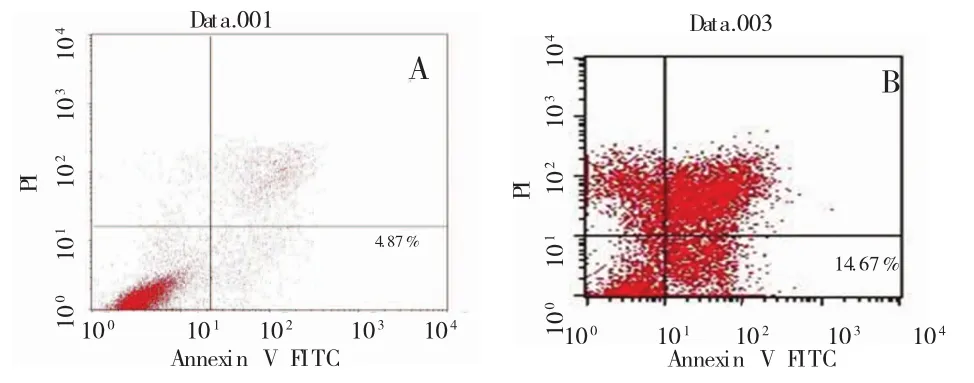
图4 流式细胞仪检测细胞凋亡率
三、RT-PCR鉴定凋亡蛋白相关基因
RT-PCR检测P53、MDM2表达水平:实时定量PCR结果显示,空白对照组相比,加药组中的P53、MDM2出现高表达,P<0.05,具有统计学差异(图5、6)。
四、Western blot鉴定凋亡相关蛋白
Western blot结果显示,与空白对照相比,加药组中的 P53、MDM2 出现高表达,P<0.05(图 7、8),具有统计学意义,与RT-PCR结果一致。
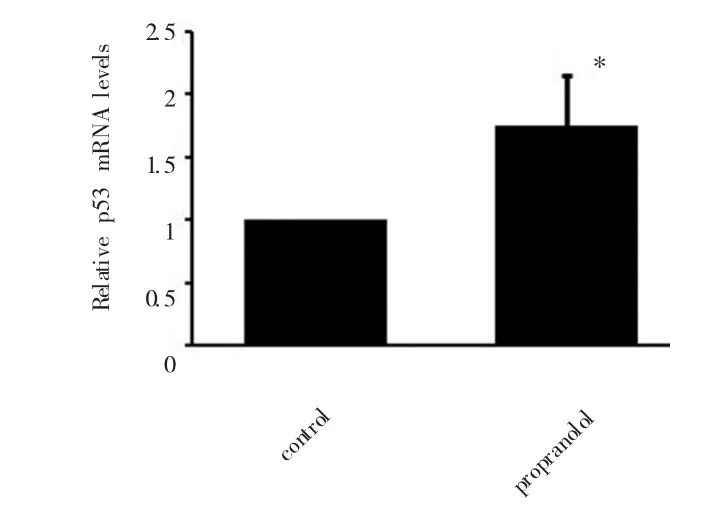
图5 RT-PCR检测P53的表达水平

图6 RT-PCR检测MDM2的表达水平
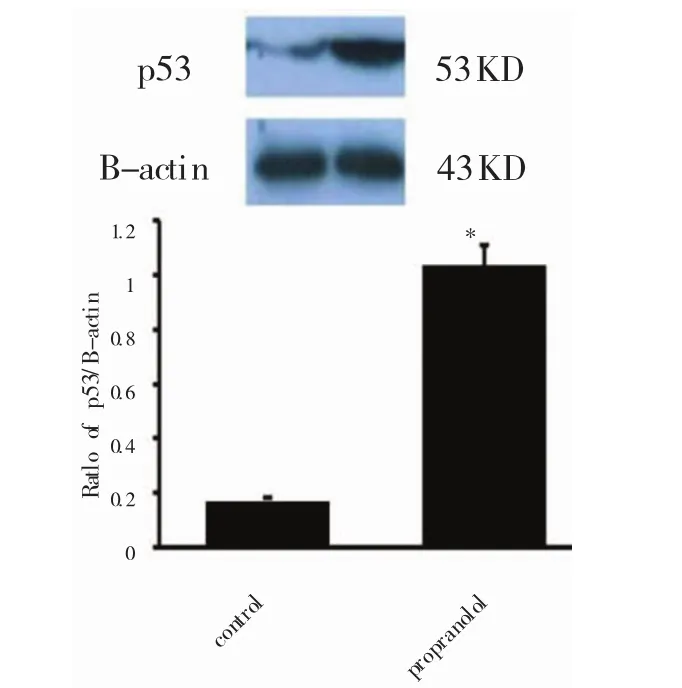
图7 W estrnblot检测P53蛋白表达水平
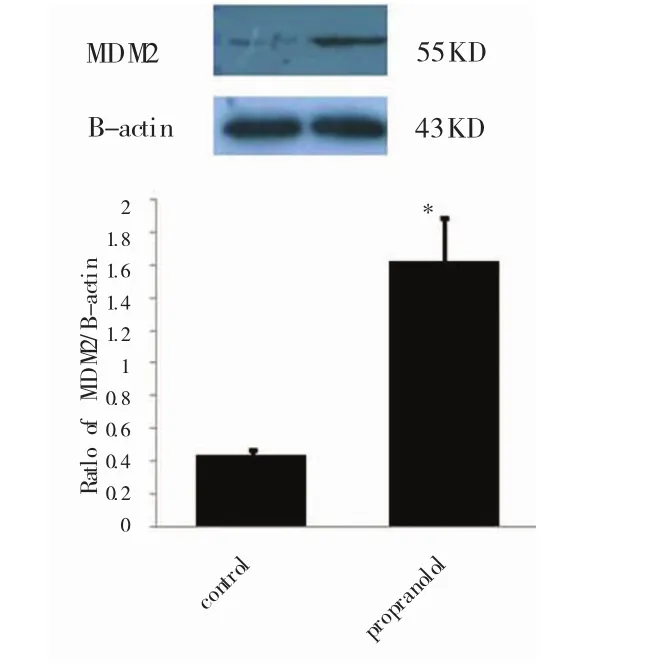
图8 W estrn-blot检测MDM2蛋白表达水平
讨 论
2012年,Wong A[11]通过用100umol/L的普萘洛尔处理血管瘤内皮细胞,发现血管瘤消退后,镜下出现了大量脂肪纤维组织,认为普萘洛尔通过在血管瘤内部形成脂肪组织,进而加速血管瘤内皮细胞的凋亡。JiYi等人[6]也用100umol/L的普萘洛尔干预体外培养的血管瘤细胞后发现血管瘤内皮细胞发生了凋亡,并发现VEGF下调,而caspase3、caspase9和bax呈现出了高表达;VEGF是血管内皮生长因子,能够促进血管瘤内皮细胞分化和增殖[12,13];许多学者通过研究发现在血管瘤增殖期时,VEGF呈高表达,并且用糖皮质激素治疗血管瘤时,发现VEGF下调[12],说明普萘洛尔可能对血管瘤内皮细胞的增殖造成了影响。在我们的前期实验[14]中,用50ug/ml的普萘洛尔处理离体血管瘤内皮细胞,通过基因芯片技术,发现有 caspase3、caspase8、Cyt-c、AIF、PARP1、laminB1等蛋白呈现高表达;caspase家族、Cyt-c、bax等蛋白是与细胞凋亡发生的高度相关的凋亡蛋白。所以我们推测,普萘洛尔作用于体外培养血管瘤内皮细胞后,使这些凋亡蛋白表达上调,进而使血管瘤内皮细胞进入凋亡进程。说明普萘洛尔作用于血管瘤的机制,可能是抑制了血管瘤内皮细胞的增殖,同时,普萘洛尔也促进了血管瘤内皮细胞的凋亡。
在本次实验中,我们观察到随着100umol/L普萘洛尔药物作用的时间增加,体外培养的血管瘤内皮细胞形态开始由紧密铺满壁底的“铺路石”型,逐渐出现细胞变圆,小部分细胞脱壁、漂浮。处理24h后,透射电镜下发现血管瘤内皮细胞胞膜内陷、破裂,有凋亡小体和致密的新月形小斑块。流式细胞仪测得空白对照组凋亡率4.87%,而普萘洛尔组的凋亡率为14.67%,明显高于对照组。同时,加药组P53和MDM2均呈现出明显的高表达态势。证明普萘洛尔确实能够引起体外培养的血管瘤内皮细胞发生凋亡,并且P53和MDM2均参与该过程。
通过对P53基因的研究,够使我们更有目的的去研究普萘洛尔诱导的血管瘤内皮细胞的凋亡途径,更有目的的去检测一些凋亡相关基因,同时,有利于我们对普萘洛尔治疗血管瘤的机制的探索。同时,对P53及MDM2的研究,是否能够给我们在医学的其他方向带来新的进展或突破,如抑制P53的表达或促进MDM2的表达,是否有利于组织再生或减轻组织移植的免疫排斥,P53靶向药物给肿瘤患者能否带来新的希望等,都有待于我们的进一步深入研究。
1 Léauté-Labrèze C,de la Roque ED,Hubiche T,et al.Propranolol for severe hemangiomas of infancy.New England Journal of Medicine,2008,358(24):2649-2651.
2 Sans V,de la Roque ED,Berge J,et al.Propranolol for severe infantile hemangiomas:follow-up report.Pediatrics,2009,124(3):e423-e431.
3 Jephson CG,Manunza F,Syed S,et al.Successful treatment of isolated subglottic haemangioma with propranolol alone.International journal of pediatric otorhinolaryngology,2009,73(12):1821-1823.
4 秦中平,刘学键,李克雷,等.小剂量普萘洛尔口服治疗婴儿血管瘤的近期疗效与安全性评价.中华医学杂志,2009,89(44):3130-3134.
5 刘文英.血管瘤治疗的进展及普萘洛尔临床应用问题.中华妇幼临床医学杂志(电子版),2010,6(3):156-159.
6 Ji Y,Li K,Xiao X,et al.Effects of propranolol on the proliferation and apoptosisofhemangioma-derived endothelial cells.Journal of Pediatric Surgery,2012,47(12):2216-2223.
7 Haupt Y,Maya R,Kazaz A,et al.Mdm2 promotes the rapid degradation of p53.Nature,1997,387(6630):296-299.
8 Vassilev LT,Vu BT,Graves B,et al.In vivo activation of the p53 pathway by small-molecule antagonistsofMDM2.Science,2004,303(5659):844-848.
9 Kubbutat MH,Jones SN,Vousden KH.Regulation of p53 stability by Mdm2.Nature,1997,387(6630):299-303.
10 Momand J,Wu H-H,Dasgupta G.MDM2-master regulator of the p53 tumorsuppressorprotein.Gene, 2000, 242(1):15-29.
11 Wong A,Hardy KL,Kitajewski AM,et al.Propranolol accelerates adipogenesis in hemangioma stem cells and causes apoptosis of hemangioma endothelial cells.Plastic and reconstructive surgery,2012,130(5):1012.
12 GreenbergerS, Boscolo E, AdiniI, etal.Corticosteroid suppression of VEGF-A in infantile hemangioma-derived stem cells.New England Journal of Medicine, 2010, 362 (11):1005-1013.
13 Bielenberg DR,Bucana CD,Sanchez R,et al.Progressive growth of infantile cutaneous hemangiomas is directly correlated with hyperplasia and angiogenesis of adjacent epidermis and inversely correlated with expression of the endogenous angiogenesis inhibitor, IFN-beta. International journal of oncology,1999,14(3):401-409.
14 Tu J-B,Ma R-Z,Dong Q,et al.Induction of apoptosis in infantile hemangioma endothelial cells by propranolol.Experimental and Therapeutic Medicine,2013,6(2):574-578.

