HDPSCs在体外促进血管再生的潜能及其分子机理研究
刘 景 袁 媛
牙髓组织是由成牙本质细胞、基质细胞以及疏松的神经血管结缔组织组成[1,2]。其中心含有丰富的基质细胞和牙髓干细胞(human dental pulp stem cells,HDPSCs)[3]。HDPSCs具有间叶干细胞的特征,不仅与牙本质细胞的发生有关,而且能够促进牙髓血管再生[4]。有研究[5]表示体外培养HDPSCs能够促进损伤牙髓血管再生,对牙髓的损伤修复具有非常重要的意义。其以获得容易、高增值、免疫抑制、多向分化等特点成为临床上常用的一种牙髓组织损伤修复的治疗方法[6]。p-ERK1/2和p-p38是细胞中重要的信号传导通路,当细胞间信号加速传递时,可加速组织血管再生,体外培养HDPSCs后能诱导p-ERK1/2和p-p38蛋白加速表达,从而加速牙髓血管再生能力。在体外条件下牙髓组织细胞较难存活,需要较高的生存条件,有研究表明[7],人微血管内皮细胞(human microvascular endothelial cell,HMEC)有与牙髓组织细胞相似的生理基础,其血管再生能力也与牙髓血管再生性相似。因此,为了进一步探讨人HDPSCs在体外培养促进血管再生的潜能及机制,本研究选取HMEC[7]随机分成阴性对照组、阳性对照组和HDPSCs组,通过测量每组HMEC细胞增殖、迁移情况以及p-ERK1/2和p-p38蛋白相对表达量揭露HDPSCs促进牙髓血管再生的机制,现将报道如下。
资料和方法
1.材料及试剂
HMEC(购自上海拜力生物科技有限公司,货号:HEK-293),胎牛血清(FBS)、DMSO 和丽春红 s染液(购自南京森贝伽生物科技有限公司,货号:SBJ-O0001、SBJ-1050、SBJ-0844),VEGF 抗 体 、HRP-IgG抗体、MTS增殖试剂和rip-a细胞蛋白裂解液(购自上海齐一生物科技有限公司,货号:3489-100、6908-250、K300-2500、SH0634),PBS 和DMEM培养液(购自上海哈灵生物科技有限公司,货号:HLCZ0024、HL12052.3.1),α-MEM、胰蛋白酶和TBST(购自南京科佰生物科技有限公司,货号:SH30265.01B、T1300、524753-1EACN)。
分组:选取人微血管内皮细胞随机分为阴性对照组,阳性对照组和HDPSCs组,阴性对照组采用不含胎牛血清(FBS)的α-MEM培养基,阳性对照组加入含100ml/l FBS的α-MEM培养基,HDPSCs组加入HDPSCs培养。
2.HDPSCs分离、培养及鉴定
取16~20岁志愿者正畸减数健康前磨牙,用超净工作台将前磨牙劈开取出牙髓组织,将牙髓组织剪碎后放入离心管,用十倍量的组织消化液消化1h,消化过程中不断轻微吹打,最终在显微镜下看到细胞呈现圆形悬浮液为止。1000r/min的离心机下离心6min,弃上清液。取100ml/l胎牛血清的α-MEM培养基培养细胞,不断的轻微吹打,直到细胞充分离散。用细胞筛网过滤得到单个离散细胞,细胞密度为1×105/ml,37℃、50ml/l二氧化碳的条件下接种培养。三天更换培养基,弃去没有贴壁的细胞。用滤纸转移法挑出克隆成功的细胞,在2.5g/l的消化液中进行消化,10min之后用1000r/min的离心机离心6min弃上清液,剩余的细胞以1:2的浓度进行传代培养,取第三代细胞HDPSCs用于实验。
鉴定:按上述方法扩大培养克隆的人牙髓干细胞至约1×107/ml,胰酶消化后用PBS冲洗,加重悬细胞,再加入预冷的无水乙醇吹打混匀,过夜,离心弃乙醇,洗两遍,染色后用目的尼龙筛网过滤,流式细胞仪上机,进行细胞周期检测。ABC法将生长良好的克隆化培养细胞做细胞爬片进行抗Vimitin、CD44、ON、DSP免疫细胞化学染色,显色,操作严格按说明书进行。光镜下观察。
3.人微血管内皮细胞(HMEC)增殖能力观察
HMEC培养于含10%FBS的α-MEM培养液,添加100μg/ml链霉素和100U/ml青霉素双抗,于 50ml/l CO2,37℃的条件下培养,2~3d 传代 1次。用PBS将传代后的HMEC洗涤2次后接种于96孔板。复6孔为一组,将细胞随机分配给HDPSCs组、阳性对照组和阴性对照组。各组加入实验设定培养液培养,于培养后0、12、24、48h弃原培养液取细胞,然后添加5mg/ml的MTS于各组孔,置37℃培养箱培养4h,再添加150μl的DMSO后放置于摇床,震荡20min致结晶完全溶解后对各孔570nm处的吸光值测定。为保证实验数据准确,重复3次实验并求平均值。
4.HMEC迁移能力观察
通过Trans-well小室实验进行测定HMEC迁移能力。将5×104/cm2的密度第3代HDPSCs细胞接种于24孔板(下室),添加100ml/l FBS的α-MEM培养基,37℃的条件下培养24h使其贴壁后,弃原培养液更换为不含FBS的α-MEM培养基培养;培养HDPSCs的小室中同时插入接种有HMEC的聚碳酸酯滤膜;然后将其分为三组,HDPSCs组、阴性对照和阳性对照的下室中分别加入HDPSCs、不含FBS的α-MEM培养基和含100 ml/l FBS的α-MEM培养基,均继续培养于37℃,50ml/l CO2条件下。培养24h后,滤膜下表面细胞用4%PFA进行固定,在结晶紫染色10min后PBS冲洗,镜下对细胞计数。
5.Western blot检测 p-ERK1/2和 p-p38蛋白表达
取第三代HDPSCs细胞在ripa细胞蛋白裂解液中裂解取30ml细胞悬浊液,蛋白质浓度采用BCA法测定后再行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)电离,电泳完成后将蛋白质转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,用丽春红s染色观察转膜效果。洗去丽春红s染液用50g/l的脱脂奶粉4℃的情况下进行蛋白封闭杂交,4℃ 50g/l脱脂奶粉封闭过夜;一抗(1:1000)室温孵育2h后TBST冲洗三次,HRP-IgG(1:2000)温孵育1.5h后TBST冲洗三次。最后DAB显色,在暗室曝光。
6.统计学处理
结 果
1.HDPSCs分离、培养及鉴定
采用酶消化组织块贴壁法分离培养人牙髓组织,培养5d后组织周围有梭形细胞爬出,似成纤维细胞,见图1A,10d后细胞呈集落状融合,见图1B,利用有限稀释法挑选细胞克隆,培养10d左右,使用0.25%胰酶消化克隆并扩大培养,获得纯化HDPSCs,见图 1C。
2.各组HEMC增殖情况比较
阴性对照组、阳性对照组和HDPSCs组培养0h和12h HEMC细胞OD值比较差异无统计学意义(P>0.05);阳性对照组培养24h和48h HEMC细胞OD值明显高于阴性对照组和HDPSCs组(P<0.05);HDPSCs组培养24h和48h HEMC细胞OD值明显高于阴性对照组(P<0.05),见表1。

图1 HDPSCs分离、培养

图2 各组HEMC细胞迁移图(400,倍数) (A:阳性对照组;B:HDPSCs组;C:阴性对照组)
表1 各组HEMC细胞OD值(±s,n=6)

表1 各组HEMC细胞OD值(±s,n=6)
注:a与阴性对照组比较P<0.05;b与阳性对照组比较P<0.05
组别阴性对照组阳性对照组H D P S C s组F p 4 8 h 0.3 5 2±0.0 8 8 0.6 2 4±0.1 0 3 a 0.4 5 5±0.0 9 6 ab 9.8 2 2<0.0 5 0 h 0.3 1 2±0.0 6 1 0.3 2 0±0.0 5 7 0.3 1 8±0.0 6 8 1.0 6 7>0.0 5 1 2 h 0.3 2 2±0.0 9 8 0.3 4 4±0.1 0 1 0.3 3 4±0.0 9 7 1.5 6 7>0.0 5 2 4 h 0.3 3 5±0.1 0 4 0.5 1 1±0.0 9 9 a 0.3 9 0±0.0 9 8 ab 5.3 2 7<0.0 5
3.各组HEMC细胞迁移比较
阳性对照组HEMC细胞迁移数明显多于阴性对照组和HDPSCs组(P<0.05);HDPSCs组HEMC细胞迁移数明显多于阴性对照组(P<0.05),见表2、图 2。
表2 各组HEMC细胞迁移比较(±s,n=6)
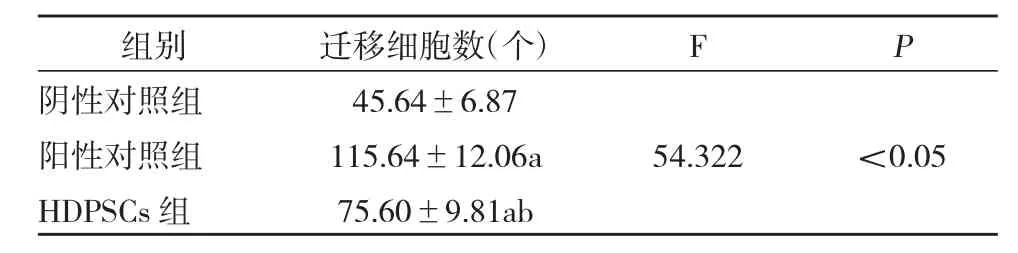
表2 各组HEMC细胞迁移比较(±s,n=6)
注:a与阴性对照组比较P<0.05;b与阳性对照组比较P<0.05
组别阴性对照组阳性对照组H D P S C s组迁移细胞数(个)4 5.6 4±6.8 7 1 1 5.6 4±1 2.0 6 a 7 5.6 0±9.8 1 a b F P 5 4.3 2 2<0.0 5
4.各组 ERK1/2、p-ERK1/2、p38和 p-p38蛋白表达比较
阳性对照组 ERK1/2、p-ERK1/2、p38和 p-p38蛋白相对表达量明显高于阴性对照组和HDPSCs组(P<0.05);HDPSCs 组 ERK1/2、p-ERK1/2、p38 和p-p38蛋白相对表达量明显高于阴性对照组(P<0.05),见表 3。
表3 各组ERK1/2、p-ERK1/2、p38和p-p38 蛋白表达比较(±s,n=6)

表3 各组ERK1/2、p-ERK1/2、p38和p-p38 蛋白表达比较(±s,n=6)
注:a与阴性对照组比较P<0.05;b与阳性对照组比较P<0.05
组别阴性对照组阳性对照组H D P S C s组F p E R K 1/2蛋白相对表达0.2 1 4±0.0 4 7 0.9 4 7±0.0 3 7 a 0.5 2 8±0.0 4 6 ab 1 5.2 0 1<0.0 5 p-E R K 1/2蛋白相对表达0.1 5 4±0.0 2 6 0.8 6 7±0.0 4 3 a 0.4 2 2±0.0 5 0 ab 1 2.0 6 4<0.0 5 p 3 8蛋白相对表达0.1 7 4±0.0 6 3 0.8 3 3±0.0 6 9 a 0.5 5 4±0.0 7 4 ab 1 4.0 3 2<0.0 5 p-p 3 8蛋白相对表达0.1 3 4±0.0 7 0 0.7 9 2±0.0 8 6 a 0.5 1 2±0.0 7 7 ab 1 3.1 5 5<0.0 5
讨 论
牙髓损伤修复涉及复杂的生物学过程,其关键在于牙髓血管再生。有研究表明HDPSCs能促进血管内皮细胞增殖及迁移,具有促进血管再生的潜能[8]。HDPSCs包括胚胎干细胞和成体干细胞,HDPSCs的发展受到各种内部机制和微环境因素的影响,其在条件适宜的情况下可在体外培养成功。有研究发现,成人HDPSCs可以定向分化成其他类型的细胞和组织,这为HDPSCs的广泛应用提供了基础。HDPSCs来源于外胚间叶多功能干细胞,可以分化为成釉细胞、成牙本质细胞、成牙骨质细胞和牙髓成纤维细胞,并且还可重新编码诱导分化其他牙髓多功能干细胞增殖分化,增殖效率比较高且容易获得[9]。一般在脱落乳牙中分离提取得到HDPSCs,通过体外扩增,用于自体某些组织的损伤修复[10],排除了免疫排斥反应的发生。
有研究发现[11]在牙髓损伤过程中增加血液供应可减少牙髓的损伤程度,所以牙髓损伤中牙髓和牙本质修复的关键是血管再生成。正常情况下,牙髓中含有丰富血管及干细胞,当牙髓损伤严重时其血液供应不足,HDPSCs大大减少[11]。牙髓血管丰富,在受到外界刺激或者细菌侵入时,深层的未分化牙髓组织受到HDPSCs诱导后,能重新分化出新生牙髓血管,继续运输营养物质[12]。HMEC有与牙髓细胞相似的生理结构,细胞间相互连接后能形成丰富的血管系统,其对环境要求不高,在室温下给予合适的湿度和营养物质即可存活。而牙髓组织较脆弱,目前仅能在人类正常牙髓腔中存活,其可代替牙髓细胞进行体外研究实验[13]。因此,本研究采用HMEC进行体外培养实验。
牙髓细胞转导信号通路是一种由联级放大反应活化丝/苏氨酸蛋白激酶组成,联级反应可放大牙髓组织电生物信号,并将其传导在牙髓细胞内进行调节,控制细胞相关的生命活动,促进牙髓血管再生。该通路主要由两种蛋白组成,分别是p-ERK1/2和p-p38。有大量的研究[14]表示当细胞过度表达p-p38上游激活因子时,能够激活牙髓干细胞增殖迁移能力,对牙髓损伤组织修复具有非常重要的意义。p-ERK1/2信号通路是牙髓细胞信号转导通路当中最经典途径,对细胞增殖、分化和凋亡都起着非常重要的调控作用,它能诱导牙髓成纤维细胞加速分化[14],使牙髓血管加速再生。p-ERK1/2作为牙髓细胞激酶途径中重要的激活因子,能加速HDPSCs进行加速分化过程。当HDPSCs在体外进行加速诱导时,能同时对p-ERK1/2和p-p38蛋白进行表达,可使牙髓细胞诱导至最大化加快牙髓血管再生,激活细胞转导通路,促进HDPSCs定向分化对牙髓血管再生具有重要的意义[15]。本研究中表3显示,HDPSCs组中p-ERK1/2和p-p38蛋白的相对表达量较高,说明应用人牙髓干细胞能增加细胞信号转导通路,从而减缓牙髓损伤,加速牙髓血流通畅。研究所得结果与叶国的相关研究成果一致[16]。
本研究中表1显示,加入人牙髓干细胞的HDPSCs组培养24h和48h HEMC细胞OD值为(0.390±0.098)和(0.455±0.096),对比阴性对照组的(0.335±0.104)、(0.352±0.088)明显上升,说明应用人牙髓干细胞能分化出相应牙髓细胞,从而加快牙髓血管再生反应。表2显示,HDPSCs组中的HEMC细胞迁移数为(75.60±9.81)个,明显多于阴性对照组的(45.64±6.87)个,少于阳性对照组的(115.64±12.06)个,图2也很直观的显示出HDPSCs组的HEMC细胞个数逐渐增多,说明应用人牙髓干细胞能起到对牙髓细胞加速增殖分化,并能加快迁移至牙髓表层,加快牙髓血管网的构建。以上研究结果也与冯毅等学者的相关研究成果一致[17]。
本研究的创新之处在于,分析多项指标与牙髓血管再生及损伤修复的相关性使结果更加客观,为HDPSCs在体外促进血管再生的机制提供了更深入的研究思路,为牙髓损伤修复提供了更安全有效的治疗方法。
综上所述,HDPSCs在在体外可促进血管内皮细胞增殖和迁移,可能与其参与ERK1/2和p-38 MAPK信号通路有关。
1 赵千宁,王健平,佟玮玮,等.SonicFill超声树脂对大鼠成牙本质细胞和牙髓微血管的影响.中国组织工程研究,2016,20(16):2369-2375.
2 刘皓,姜建萍,张娟娟,等.FGF8辅助牙源性上皮诱导hDPSCs分化为成牙本质细胞及牙髓细胞.中国病理生理杂志,2017,33(4):730-734.
3 Pisciotta A,Carnevale G,Meloni S,et al.Human dental pulp stem cells (hDPSCs):isolation, enrichment and comparative differentiation of two sub-populations. BMC Developmental Biology,2015,15(1):1-16.
4 孙蕾,范晓敏,何文喜,等.阿司匹林对人牙髓干细胞体外增殖、分化的影响及分子机制的研究.牙体牙髓牙周病学杂志,2016,26(4):213-217.
5 刘艳玲,牟雁东.负载牙周祖细胞的钛种植体治疗单根牙缺失的实验研究.中国现代医学杂志,2017,27(5):232-236.
6 林颖,秦伟,邹瑞,等.促丝裂原激活蛋白激酶在牙髓干细胞向成牙本质细胞分化和牙髓损伤修复中的作用.国际口腔医学杂志,2016,43(3):343-347.
7 Wang W,Tan J,Xing Y,et al.p43 induces IP-10 expression through the JAK-STAT signaling pathway in HMEC-1 cells.InternationalJournalofMolecularMedicine, 2016, 38(4):1217-1221.
8 陈犹白,张启旭,Charles E.Butler,等.血管内皮生长因子基因转染的人脂肪干细胞具有较强的增殖和分化能力.细胞与分子免疫学杂志,2017,33(3):117-122.
9 王飞翔,贺慧霞,贾雅丽,等.牙髓、牙周膜及脐带间充质干细胞三系分化能力的体外比较研究.口腔颌面修复学杂志,2016,17(3):129-134.
10 路博闻,刘娜,徐璐璐,等.人脱落乳牙牙髓干细胞与人恒牙牙髓干细胞成骨分化及破骨能力的差异.南方医科大学学报,2016,36(2):180-185.
11 赵千宁,王健平,佟玮玮,等.SonicFill超声树脂对大鼠成牙本质细胞和牙髓微血管的影响.中国组织工程研究,2016,20(16):2369-2375.
12 Liu H,Dong Y,Cheng P,et al.Study on the effect of PKC-味 in SDF-1伪/CXCR4 axis induced migration of rat bone marrow mesenchymal stem cells. Journal of Orthopaedic Translation,2016,7(C):134-134.
13 Rybalko VY,Pham CB,Hsieh PL,et al.Controlled delivery of SDF-1伪 and IGF-1:CXCR4(+) cell recruitment and functional skeletal muscle recovery.Biomaterials Science,2015,3(11):1475-1486.
14 Kaufmann J, Martinka P, Moede O, et al.Noradrenaline enhances angiotensin IIresponses via p38 MAPK activation afterhypoxia/re-oxygenation in renalinterlobararteries.Acta Physiologica,2015,213(4):920-932.
15 Alawad A,Altuwaijri S,Aljarbu A,et al.Depletion of androgen receptor (AR) inmesenchymal stem cells (MSCs) inhibits induction of CD4+CD25+FOX3+regulatory T (Treg) cells via androgen TGF-β interaction.Journal of Applied Biomedicine,2015,13(4):263-271.
16 叶国.p38和ERK1/2 MAPK通路在BMP9诱导人牙周膜干细胞成骨分化中的作用研究.重庆医科大学,2014.
17 冯毅,马静,黄贞.牙髓干细胞促进牙髓血管生成的相关分子机制研究.牙体牙髓牙周病学杂志,2013,23(12):768-772.

