妊娠期抗真菌药物的应用
赵 苗, 张 菁
妊娠期感染风险大,包括严重的真菌感染,然而抗真菌药物在孕妇中的应用是一大难题,因药物对胎儿的毒性及母体药动学参数的变化可能影响药物疗效或增加对母体和胎儿的不良反应。除了药物的药动学特点和抗真菌活性外,在制定抗真菌药物给药方案时,还需要考虑妊娠的时期,胎儿的药物暴露水平,母体的生理变化[1],目前仍缺乏相应的抗真菌治疗方案。由于妊娠期是抗真菌药物对照研究中的禁忌,相关的数据极少,而且是基于体外或动物研究、药理学研究、少数病例报道。美国FDA关于妊娠期风险的分级(A-X,根据药物对胎儿毒性的预估)提供了妊娠各阶段的大致框架(表1、2)。本文对妊娠期抗真菌药物的应用进行综述。

表1 FDA对孕妇用药风险评估分类[2]
1 抗真菌药和妊娠
1.1 全身性唑类抗真菌药
该类药物通过作用于C14α的去甲基过程,抑制真菌细胞膜的主要成分麦角甾醇的合成。动物实验和人体试验表明唑类抗真菌药可能致畸。
1.1.1 酮康唑 高剂量酮康唑(80 mg·kg-1·d-1)在动物体内有致畸和胎盘毒性[3]。虽然在动物研究中,酮康唑很难穿越胎盘屏障,但理论上仍可能影响胎儿性器官的分化[4-5]。
1.1.2 氟康唑 氟康唑仅对念珠菌属和隐球菌属有抗菌作用。它可渗入胎盘,并引起兔胚胎毒性和大鼠胚胎致畸,诱导头颅面和肋骨异常[6]。已有报道5例因子宫内暴露氟康唑而导致儿童先天性畸形的报道[7-9]。
迄今为止最新、最大病例数的一项研究显示,口服氟康唑暴露引起的自发性流产率显著增加(Hazard Ratio,HR 1.48, 1.23~1.77);剂量分层分析结果显示:低剂量组(150~300 mg)自发性流产的风险率(HR 1.47, 1.22~1.77)与高剂量组(300~5 600 mg)自发性流产的风险率(HR 1.55,0.94~2.58)无显著差异(P=0.84);氟康唑暴露并没有增加死胎的风险(HR 1.32,0.82~2.14),但高剂量组(300~5 600 mg)死胎的风险率(HR 4.10,1.89~8.90)较低剂量组(150~300 mg)死胎的风险率(HR 0.99,0.56~1.74)显著增加(P=0.002)[10]。将口服氟康唑病例与局部使用氟康唑病例进行比较,口服氟康唑自发性流产发生率显著增加(HR 1.62,1.26~2.07), 死胎发生率未显著变化(HR 1.18, 0.64~2.16)。该研究引起了FDA的高度重视,将重新评估口服氟康唑在妊娠期的安全性[11]。氟康唑总剂量>300 mg 应当视为可致畸,并应在妊娠过程中限制使用,FDA将氟康唑由“C类”改为“D类”(除单次给药150 mg用于治疗阴道念珠菌病)[12]。在妊娠前3个月过后,在无可替代药物的情况下可以考虑谨慎使用。
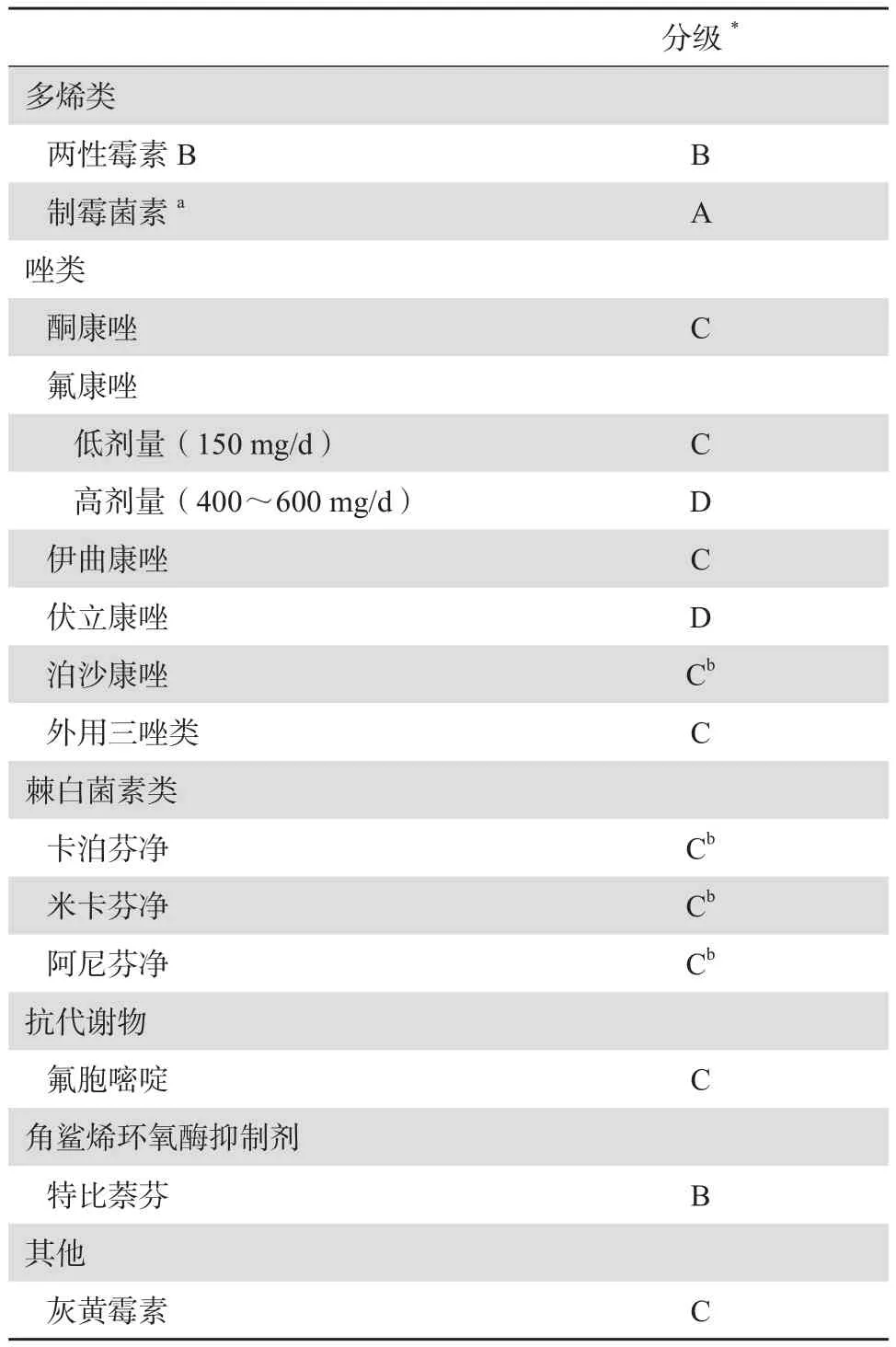
表2 抗真菌药和妊娠期风险等级[2]
1.1.3 伊曲康唑 伊曲康唑抗菌谱较氟康唑广,包括地方性真菌和大部分曲霉。它对啮齿类动物具有胎盘毒性和致畸性,包括颅面和肋骨致畸[3]。但是一项前瞻性研究中,198例孕妇在妊娠前3个月接受伊曲康唑治疗,日剂量50~800 mg(中位数200 mg),连续使用1~90 d(中位数3 d),未见胎儿畸形风险增加,但早产率显著增加(12% 对4%)[13]。一项大的流行病学调查[14],观察伊曲康唑在妊娠早期的风险,将病例组的206例在妊娠前3个月接受伊曲康唑治疗的孕妇与207名对照组(在妊娠前3个月未接受致畸药物暴露孕妇)相比,致畸风险未增加 [日平均剂量为(182±63) mg,疗程(6.9±6.4)d],但早期胎儿流产率增加(11% 对 4.8%)。
伊曲康唑在啮齿类动物中有胚胎毒性和致畸性。临床研究中并未发现妊娠过程中增加任何风险,尤其是妊娠前3个月,FDA将其归为C类。考虑到三唑类药物在人体中的风险概率,仍然要限制伊曲康唑在妊娠期,尤其是妊娠前3个月的使用。生产厂家建议在接受伊曲康唑治疗期间及治疗后2个月内采取避孕措施。
1.1.4 伏立康唑 伏立康唑对念珠菌属和新生隐球菌具有抑菌作用,对烟曲霉具有杀菌作用。与其他三唑类一样,伏立康唑高剂量时在啮齿类动物中具有胚胎毒性,且低剂量(相当于人维持剂量的0.3倍)时也有毒性,导致骨骼和内脏畸形[3]。由于缺乏人体数据,FDA将其归为D类,在妊娠期应避免使用伏立康唑[12]。自从2002年被FDA和欧洲药品管理局(EMA)批准上市以来,仅有1例妊娠期伏立康唑暴露的报道,是中性粒细胞减少的孕妇,因侵袭性曲霉病在妊娠第3~9个月接受伏立康唑治疗,在胎儿出生和6个月随访时未发现不良反应[15]。有专家认为在妊娠3个月以后,受到生命威胁且缺乏其他更安全的治疗方法时方考虑使用该药。
1.1.5 泊沙康唑 泊沙康唑是新上市的三唑类抗真菌药。在2005年10月和2006年9月分别通过EMA和FDA上市。抗菌谱扩展到了毛霉目,对大部分酵母和霉菌具有抗菌活性[16]。泊沙康唑在大鼠中有致畸效应(骨骼畸形和肋骨异常),在兔中有胚胎毒性和致畸性[17]。FDA将泊沙康唑归为C类。但目前缺乏人体数据,妊娠期应避免使用。
1.2 棘白菌素类
棘白菌素类作用是抑制参与真菌细胞壁合成的1, 3-β-D-葡聚糖的合成。这类药耐受性好,抗菌谱广,包括念珠菌属、曲霉属等酵母,但是对隐球菌或毛霉目、镰刀菌等霉菌无活性。
卡泊芬净可通过大鼠和兔的胎盘屏障,在人推荐剂量下表现出胚胎毒性和致畸性(产仔数减少,骨化,肋骨畸形)[18]。卡泊芬净是否可通过人胎盘屏障尚未可知。它的分子量及其与血浆结合可限制其穿越屏障,但这种限制也可被其长的半衰期(9~11 h)抵消[3]。目前无卡泊芬净在妊娠期应用的报道。
米卡芬净在2005年3月和2008年4月分别被FDA和EMA批准上市;阿尼芬净在2006年2月和2010年9月被FDA和EMA批准上市。米卡芬净可通过兔胎盘屏障,显示出胚胎毒性和致畸性(在人推荐剂量的4倍时,可导致内脏畸形和流产)[19]。阿尼芬净可通过大鼠胎盘屏障,在啮齿类动物中显示致畸性(在人推荐剂量的2倍时可致骨骼异常)[20]。米卡芬净和阿尼芬净是否可通过人胎盘屏障尚未可知。这些药物在妊娠期的使用尚无数据支持。
所有的棘白菌素类抗真菌药被FDA归为C类,在啮齿类动物和兔中有胚胎毒性和致畸作用。目前尚无人体数据报道。此类药物被认为在妊娠期是安全的。
1.3 氟胞嘧啶
氟胞嘧啶早期是作为抗代谢药被研发,它在真菌细胞内被转化成氟尿嘧啶,从而干扰DNA和蛋白质的合成。氟胞嘧啶的抗真菌谱局限于酵母(念珠菌属,隐球菌属)。不良反应包括骨髓、肝和胃肠道毒性,这些不良反应多数是由于少量(<5%)氟胞嘧啶在静脉注射过程中或在胃肠道摄入时转化为氟尿嘧啶[21]。
氟尿嘧啶可通过人胎盘屏障,并在羊水和脐带血中达到高的浓度,已有报道在妊娠前3个月氟胞嘧啶暴露的流产胎儿结构异常,这期间应禁忌使用氟胞嘧啶[3]。氟胞嘧啶被FDA归为C类。但有限的病例报道无法证实氟胞嘧啶在妊娠3~9个月应用时的不良反应。其对胎儿毒性的研究数据匮乏,妊娠期应避免使用。
1.4 全身性用多烯类
多烯类是最老的抗真菌药之一。它与麦角甾醇结合,形成跨膜毛孔,离子外漏从而导致真菌死亡。
两性霉素B抗菌谱广,覆盖多数酵母,包括毛霉目在内的霉菌和二相性真菌。脂质制剂的出现降低了两性霉素B的毒性,包括脂质体、胶体分散体和脂质复合体。两性霉素B是妊娠期最安全的全身性抗真菌药。对孕妇的毒性与未怀孕患者相近[22]。两性霉素B可通过胎盘屏障,通过脐带血在胎儿血液循环中达到治疗浓度,脐带血和母体血药浓度比达0.38~1[23-24]。当剂量达到10倍于人体推荐剂量时,即使在妊娠前3个月,在啮齿类动物和兔中没有致畸性[3,25-26]。一项回顾性分析在患有内脏利什曼病的39例孕妇中对比了两性霉素B脂质体和葡萄糖酸锑钠的作用,葡萄糖酸锑钠患者组57%(13/23)孕妇在妊娠前3个月或3~6个月流产,两性霉素B患者组未发生流产(0/16)。两组均未发生胎儿畸形[27]。另外2项报道中分别有5例 [妊娠(11±2)周]和4例 [妊娠(928±7)周]患有内脏利什曼病的孕妇使用了两性霉素B脂质体,结果显示孕妇和胎儿均健康[28-29]。
两性霉素B被FDA归为B类,被视为妊娠期使用最安全的抗真菌药,也是主要用药。两性霉素B脂质体也应被认为是安全的。其他脂质体衍生物的安全性数据匮乏,仅在其他多烯类抗真菌药无法使用的情况下使用。
1.5 特比萘芬
特比萘芬是烯丙基胺类化合物,可局部和口服用药。它通过选择性的抑制真菌角鲨烯环氧化,增加角鲨烯致毒性水平,从而杀死真菌细胞。它可用于皮肤癣感染、甲癣等皮肤癣菌,包括着色真菌病和足菌肿的治疗,这些疾病在妊娠期不需要紧急治疗。
研究显示口服剂量为人体推荐最大剂量的23倍时,对兔和大鼠无胚胎胎儿毒性[3]。特比萘芬是否可通过胎盘屏障未可知,也从未有妊娠期口服此药的报道。尽管特比萘芬被归为B类,但人体数据缺乏,妊娠期应限制全身性使用。因特比萘芬可通过母乳排出,哺乳期也应尽量避免服用[30]。
1.6 灰黄霉素
灰黄霉素是口服抑菌剂,通过改变DNA复制来抑制真菌有丝分裂。用于治疗皮肤癣菌病[2,31]。灰黄霉素可通过胎盘屏障[32],在人体推荐剂量3~45倍时,对兔有致瘤、胚胎毒性和致畸作用[3]。灰黄霉素被FDA归为C类。由于人体数据匮乏,不支持其在妊娠期,尤其是妊娠前3个月的使用。
1.7 局部用药
局部用抗真菌药吸收均很差,除了可引起胎儿甲状腺肿的碘化钾之外,其他药物均可在妊娠期使用。
1.7.1 局部用三唑类 三唑类局部用于治疗浅部真菌感染,包括皮肤、口腔和外阴阴道念珠菌病。局部用三唑类吸收很少,在妊娠任何时期都可以使用。
咪康唑黏膜粘合片于2008年6月和2010年4月分别由EMA和FDA批准。FDA已将咪康唑归为C类,无论何种制剂。与其他局部用三唑类一样,局部用咪康唑在动物实验中未表现出胚胎毒性和致畸性。由于缺乏妊娠期研究,咪康唑应仅在无其他治疗选择,且利大于弊的情况下使用[3,22]。两项病例对照研究对咪康唑乳膏进行评估显示,在妊娠期前3个月接受咪康唑局部治疗并没有增加先天性缺陷的风险(OR 0.9,0.6~1.6)[33],但甲硝唑和咪康唑联合的阴道治疗可能会略微增加多趾和并指畸形的风险(OR 1.2,1.0~1.3)[1]。
1.7.2 制霉菌素 制霉菌素口服吸收差,甚至几乎不吸收,缺乏动物实验数据。Czeizel等[34]对口服制霉菌素在妊娠期的致畸作用研究发现,妊娠期口服制霉菌素会略微提高先天性缺陷的风险(OR 1.2,1.0~1.6)。研究还发现口服制霉菌素可能与尿道下裂有关(OR 1.94, 1.22~3.09),但这需要进一步的研究证实[35]。
制霉菌素被FDA归为A类。因吸收极差,多年来被认为在妊娠期使用是安全的。但近期数据显示在制霉菌素暴露的胎儿中尿道下裂的风险轻度增加。在妊娠8~14周时应尽量避免使用此药。
1.7.3 特比萘芬 局部用特比萘芬因吸收差,可在妊娠期使用。
1.7.4 环吡酮胺 环吡酮胺仅局部用药,全身吸收差。FDA将其归为B类,若对胎儿利大于弊,可考虑使用[36-37]。
1.7.5 阿莫罗芬 阿莫罗芬是吗啉的衍生物,通过抑制真菌麦角甾醇的生物合成,导致膜渗透性改变,真菌代谢过程受阻。阿莫罗芬可用于治疗灰指甲。此药吸收差,动物实验中对妊娠无害[3]。因此阿莫罗芬在妊娠期可以使用。
1.7.6 碘化钾 碘化钾因其有效性、安全性和低价格,仍在一些地区被用于皮肤孢子丝菌病、蛙粪霉的治疗。碘化物易通过胎盘,它的使用与胎儿甲状腺肿、气管压迫,甚至某些情况与死亡有关。但也有研究显示在妊娠6~9个月使用此药并未对孕妇和胎儿有不良影响[38-40]。
2 孕妇治疗推荐
两性霉素B及其脂质体衍生物被认为是妊娠期治疗任何侵袭性真菌感染的基石。一些专家也指出在妊娠前3个月过后,缺乏治疗选择的情况下,可考虑氟康唑[41]。主要系统性真菌感染的治疗推荐更新总结见表3。
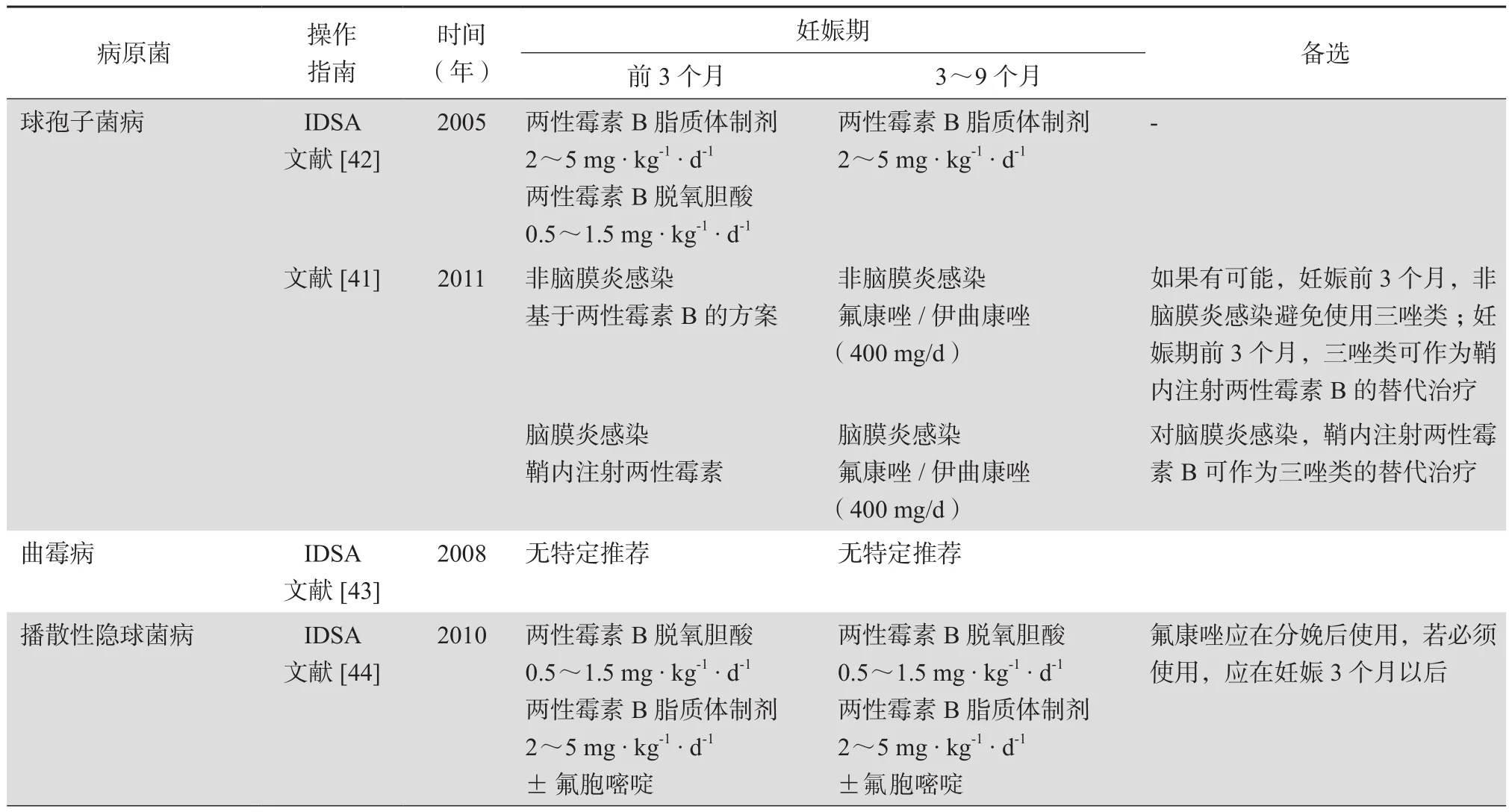
表3 妊娠期侵袭性真菌感染治疗主要操作指南
妊娠期的浅部真菌感染需局部治疗,可使用局部抗真菌药,包括局部用药的三唑类。需要全身性治疗的浅部真菌感染,如灰指甲、着色真菌病、足菌肿等,孕妇应在分娩后再接受治疗。
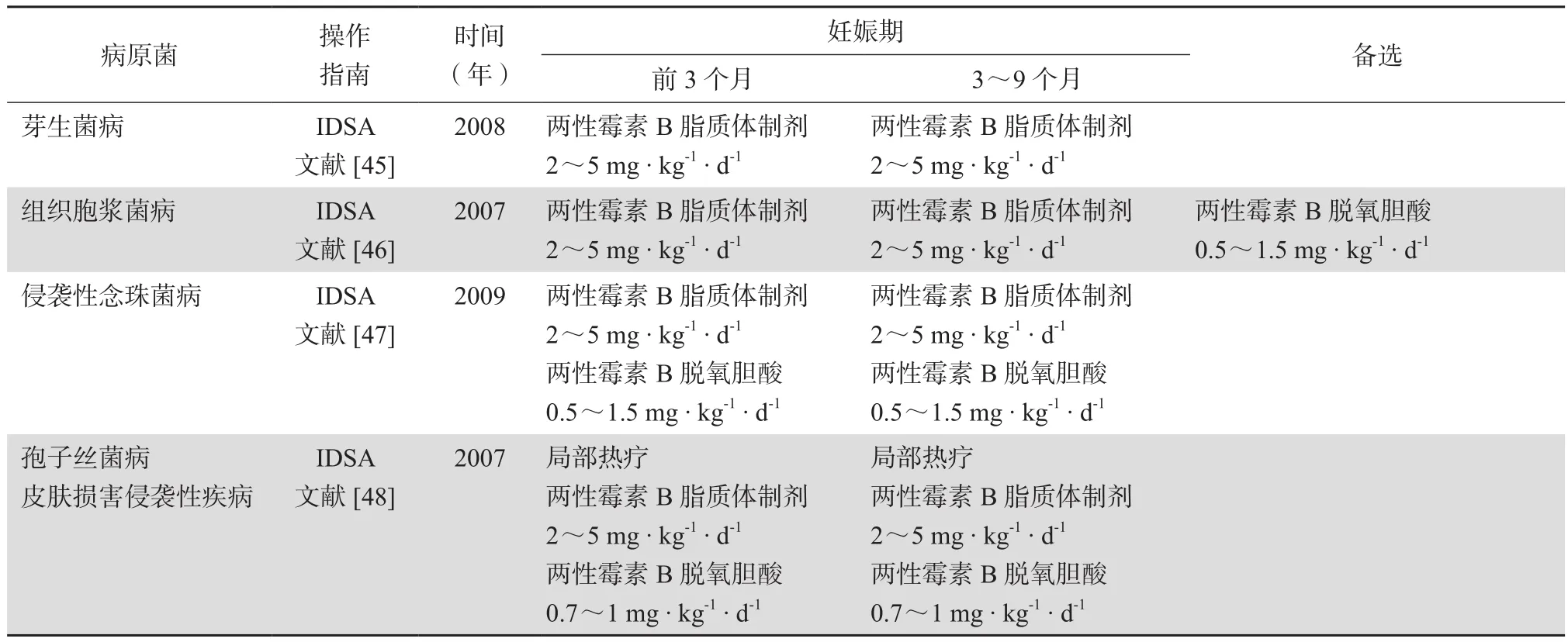
表3 (续)Table 3(continued)
3 总结和展望
妊娠期抗真菌药物的使用需求越来越大,孕妇免疫功能低下的越来越多,更易受真菌感染,需要更为精准的抗真菌治疗。然而抗真菌药在妊娠期使用的知识探索进展缓慢,仍有许多空白有待填补。两性霉素B脱氧胆酸,这一最古老的、耐受性最差的抗真菌药,目前仍然是妊娠期抗真菌的关键药物。一些专家认为在妊娠3个月后,无其他治疗选择情况下可使用氟康唑,然而这期间氟康唑暴露的安全性还未得到评估。泊沙康唑和棘白菌素类从未在孕妇中进行过研究,因此不推荐使用。由于药动学和耐受性的数据很少,妊娠期间任何抗真菌药处方必须进行安全性评价并报告,以提高我们药品安全性和有效性的认知。同时,应多学科联合谨慎评估母体胎儿风险和收益,提供个性化的、专业的抗真菌药处方。
[1]CHOW AW, JEWESSON PJ. Pharmacokinetics and safety of antimicrobial agents during pregnancy[J]. Rev Infect Dis,1985,7(3):287-313.
[2]BRIGGS GG FR, YAFFE SJ. Drugs in pregnancy and lactation:a reference guide to fetal and neonatal risk[M]. Philadelphia:Lippincott Williams & Wilkins,2011.
[3]SONINO N. The use of ketoconazole as an inhibitor of steroidproduction[J]. New Engl J Med, 1987, 317(13):812-818.
[4]HEEL RC, BROGDEN RN, CARMINE A, et al. Ketoconazole:a review of its therapeutic efficacy in superficial and systemic fungal infections[J]. Drugs,1982, 23(1-2):1-36.
[5]TIBONI GM. Second branchial arch anomalies induced byfluconazole, a bis-triazole antifungal agent, in cultured mouse embryos[J]. Res Commun Chem Pathol Pharmacol,1993, 79(3):381-384.
[6]ALECK KA, BARTLEY DL. Multiple malformation syndrome following fluconazole use in pregnancy : report of an additional patient[J]. Am J Med Genet,1997, 72(3):253-256.
[7]PURSLEY TJ, BLOMQUIST IK, ABRAHAM J, et al.Fluconazole-induced congenital anomalies in three infants[J].Clin Infect Dis,1996, 22(2):336-340.
[8]LEE BE, FEINBERG M, ABRAHAM JJ, et al. Congenitalmalformations in an infant born to a woman treated withfluconazole[J]. Pediatr Infect Dis J,1992, 11(12):1062-1064.
[9]MOLGAARD-NIELSEN D, SVANSTROM H, MELBYE M, et al. Association between use of oral fluconazole during pregnancy and risk of spontaneous abortion and stillbirth[J].Jama J Am Med Assoc,2016, 315(1):58-67.
[10]ASCHENBRENNER DS. The fda reevaluates oral fluconazole use in pregnancy[J]. Am J Nurs, 2016, 116(8):22-22.
[11]VLACHADIS N, ILIODROMITI Z, VRACHNIS N. Oralfluconazole during pregnancy and risk of birth defects[J]. N Engl J Med,2013, 369(21):2061.
[12]BAR-OZ B, MORETTI ME, BISHAI R, et al. Pregnancy outcome after in utero exposure to itraconazole: a prospective cohort study[J]. Am J Obstet Gynecol,2000, 183(3):617-620.
[13]DE SANTIS M, DI GIANANTONIO E, CESARI E, et al.First-trimester itraconazole exposure and pregnancy outcome: a prospective cohort study of women contacting teratology information services in Italy[J]. Drug Saf,2009, 32(3):239-244.
[14]Food and Drug Administration. Pregnancy categories[J]. Federal Register, 1980, 44 :37434-37467.
[15]TEHRANI MS, DE FONTBRUNE FS, ROTH P, et al. Case report of exposure to voriconazole in the second and third trimesters of pregnancy[J]. Antimicrob Agents Chemother,2013, 57(2):1094-1095.
[16]BITAR D, MORIZOT G, VAN CAUTEREN D, et al.Estimating the burden of mucormycosis infections in France(2005-2007) through a capture-recapture method on laboratory and administrative data[J]. Rev Epidemiol Sante Publique,2012, 60(5):383-387.
[17]Noxafil packageinsert [EB/OL]. [2017-07-24]. https://www.merck. com/product/usa/pi_circulars/n/noxafil/noxafil_pi. pdf.
[18]Cancidas package insert [EB/OL]. [2017-07-24]. https://www.merck. com/product/usa/pi_circulars/c/cancidas/cancidas_pi. pdf.[19]CAPPELLETTY D, EISELSTEIN-MCKITRICK K. The echinocandins[J]. Pharmacotherapy, 2007, 27(3):369-388.
[20]Eraxis package insert [EB/OL]. [2017-07-24]. https://www.accessdata. fda. gov/drugsatfda_docs/label/2006/021632s000,021948s000lbl. pdf.
[21]DIASIO RB, LAKINGS DE, BENNETT JE. Evidence for conversion of 5-fluorocytosine to 5-fluorouracil in humans:possible factor in 5-fluorocytosine clinical toxicity[J]. Antimicrob Agents Chemother,1978, 14(6):903-908.
[22]MOUDGAL VV, SOBEL JD. Antifungal drugs in pregnancy : a review[J]. Expert Opin Drug Saf,2003, 2(5):475-483.
[23]ISMAIL MA, LERNER SA. Disseminated blastomycosis in a pregnant woman: review of amphotericin B usage during pregnancy[J]. Am Rev Respir Dis, 1982, 126(2):350-353.
[24]HAGER H, WELT SI, CARDASIS JP, et al. Disseminated blastomycosis in a pregnant woman successfully treated with amphotericin-B. A case report[J]. J Reprod Med,1988, 33(5):485-488.
[25]Amphotec package insert [EB/OL]. [2017-07-24].https://dailymed. nlm. nih. gov/dailymed/drugInfo.cfm?setid=9b8ea543-1de8-472f-9666-34f99ca2f183.
[26]AmBisome package insert [EB/OL]. [2017-07-24]. https://www. astellas. us/docs/ambisome. pdf.
[27]MUELLER M, BALASEGARAM M, KOUMMUKI Y, et al. A comparison of liposomal amphotericin B with sodium stibogluconate for the treatment of visceral leishmaniasis in pregnancy in Sudan[J].J Antimicrob Chemother, 2006, 58(4):811-815.
[28]PAGLIANO P, CARANNANTE N, ROSSI M, et al. Visceral leishmaniasis in pregnancy: a case series and a systematic review of the literature[J]. J Antimicrob Chemother, 2005, 55(2):229-233.
[29]FIGUEIRO-FILHO EA, EL BEITUNE P, QUEIROZ GT, et al.Visceral leishmaniasis and pregnancy: analysis of cases reported in a central-western region of Brazil[J]. Arch Gynecol Obstet,2008, 278(1):13-16.
[30]Lamisil pakage insert [EB/OL]. [2017-07-24]. https://www.accessdata. fda. gov/drugsatfda_docs/label/2012/020539s021lbl.pdf.
[31]ALY R. Ecology and epidemiology of dermatophyte infections[J].J Am Acad Dermatol,1994, 31(3 Pt 2):S21-25.
[32]RUBIN A, DVORNIK D. Placental Transfer of Griseofulvin[J].Am J Obstet Gynecol, 1965, 92 :882-883.
[33]CZEIZEL AE, KAZY Z, PUHO E. Population-based casecontrol teratologic study of topical miconazole[J]. Congenit Anom (Kyoto),2004, 44(1):41-45.
[34]CZEIZEL AE, KAZY Z, PUHO E. A population-based casecontrol teratological study of oral nystatin treatment during pregnancy[J]. Scand J Infect Dis, 2003, 35(11-12):830-835.
[35]MAVROGENIS S, URBAN R, CZEIZEL AE, et al. Maternal risk factors in the origin of isolated hypospadias: a populationbased case-control study[J]. Congenit Anom (Kyoto), 2014, 54(2):110-115.
[36]MENDLING W, BRASCH J, GERMAN SOCIETY FOR G, et al. Guideline vulvovaginal candidosis (2010) of the German Society for Gynecology and Obstetrics, the Working Group for Infections and Infectimmunology in Gynecology and Obstetrics, the German Society of Dermatology, the Board of German Dermatologists and the German Speaking Mycological Society[J]. Mycoses, 2012, 55 (Suppl 3):1-13.
[37]MENDLING W, KRAUSS C, FLADUNG B. A clinical multicenter study comparing efficacy and tolerability of topical combination therapy with clotrimazole (Canesten, two formats)with oral single dose fluconazole (Diflucan) in vulvovaginal mycoses[J]. Mycoses, 2004, 47(3-4):136-142.
[38]WOLFF J. Iodide goiter and the pharmacologic effects of excess iodide[J]. Am J Med,1969, 47(1):101-124.
[39]CARSWELL F, KERR MM, HUTCHISON JH. Congenital goitre and hypothyroidism produced by maternal ingestion of iodides[J]. Lancet, 1970, 1(7659):1241-1243.
[40]PLAUCHE WC. Sporotrichosis in pregnancy[J]. Am J Obstet Gynecol, 1968, 100(8):1150-1151.
[41]BERCOVITCH RS, CATANZARO A, SCHWARTZ BS,et al. Coccidioidomycosis during pregnancy: a review and recommendations for management[J]. Clin Infect Dis, 2011, 53(4):363-368.
[42]GALGIANI JN, AMPEL NM, BLAIR JE, et al.Coccidioidomycosis[J]. Clin Infect Dis,2005, 41(9):1217-1223.
[43]WALSH TJ, ANAISSIE EJ, DENNING DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America[J]. Clin Infect Dis, 2008, 46(3):327-360.
[44]PERFECT JR, DISMUKES WE, DROMER F, et al. Clinical practice guidelines for the management of cryptococcal disease:2010 update by the Infectious Diseases Society of America[J].Clin Infect Dis,2010, 50(3):291-322.
[45]CHAPMAN SW, DISMUKES WE, PROIA LA, et al. Clinical practice guidelines for the management of blastomycosis: 2008 update by the Infectious Diseases Society of America[J]. Clin Infect Dis,2008, 46(12):1801-1812.
[46]WHEAT LJ, FREIFELD AG, KLEIMAN MB, et al. Clinical practice guidelines for the management of patients with histoplasmosis: 2007 update by the Infectious Diseases Society of America[J]. Clin Infect Dis,2007, 45(7):807-825.
[47]PAPPAS PG, KAUFFMAN CA, ANDES D, et al. Clinical practice guidelines for the management of candidiasis: 2009 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 48(5):503-535.
[48]KAUFFMAN CA, BUSTAMANTE B, CHAPMAN SW,et al. Clinical practice guidelines for the management of sporotrichosis: 2007 update by the Infectious Diseases Society of America[J]. Clin Infect Dis, 2007, 45(10):1255-1265.

