左股骨放疗后骨坏死合并病理性骨折1例报告
吴旻昊,闫飞飞,孙文超,许可可,雷军,蔡林
(武汉大学中南医院骨科中心骨肿瘤病区,湖北 武汉 430071)
放疗(radiation therapy,RT)是恶性骨肿瘤的有效治疗方法之一,目前已有的多项大样本、多中心的随机临床试验,均证实了放疗能显著降低恶性骨肿瘤术后的局部复发率,改善患者总生存率[1-2]。但是,随着其应用的日益广泛,人们在注重疗效的同时,也更加关注放疗所导致的不良反应。放射性骨损伤(radiation bone injure,RBI)是指骨组织在接受射线照射后出现(临床发现)骨损伤,一般表现为迟发性损伤,平均2.4~10.0年,其病理改变包括骨萎缩、不全骨折及骨坏死[3-4]。该病临床表现及影像学检查缺乏特异性,对于恶性骨肿瘤术后的患者,常被误诊为肿瘤复发。现总结我院收治的1例左股骨恶性肿瘤放疗后骨坏死误诊为肿瘤复发的患者的临床资料,初步报道如下。
1 临床资料
53岁女性患者,因“左股骨下段肿瘤综合治疗后4年余,伴疼痛1年”,分别于2015年9月及2015年11月入我院治疗。
2000年左右,患者开始出现左膝关节无痛性肿块,不影响工作及休息,肿块未见明显增大,未予诊治。2011年3月开始出现劳作时肿块部位疼痛,休息后缓解,偶伴夜间痛,影响睡眠,随后疼痛逐渐加重并伴跛行。X线片示左股骨下段可见一囊状透光区,边缘较光整,其内可见骨嵴,考虑良性骨肿瘤病变(见图1);MRI示左股骨下段骨皮质旁可见一与股骨分界不清的囊实性肿块影,大小约6.0 cm×5.8 cm×8.2 cm,肿块实质部分见锯齿状边缘,相邻骨髓腔内也可见以长T1长T2信号为主的异常信号影,肿块与周边软组织肌肉分界尚清并压迫周边软组织(见图2)。外院意见:左股骨下段内侧皮质旁异常信号,累及骨髓腔并见周边骨膜反应,考虑肿瘤或肿瘤样病变。2011年5月在当地医院行“左股骨下段肿瘤切除+植骨术”,术后病检提示:左股骨下段滑膜肉瘤,免疫组化:PCK(-)、EMA(+)、calponin(+)、CD99(-)、CD33(+)、CD34(-)、S-100(-)、CD68可疑阳性、CD163(-)、Ki67 2%(+)。6月复查MRI示,左侧股骨下段见片状异常信号,大小约5.1 cm×2.4 cm其内信号不均,周边肌肉见高信号。诊断意见:左侧股骨下段术后改变。8月再次复查MRI示,原左大腿下段滑膜肉瘤术后改变(左股骨下段骨质缺损)(见图3)。10月开始行2周期CYV联合ADIC方案化疗(CTX、VCR、KSM、DTIC具体不详)及放疗(患者自述30次左右,具体不详)。恢复良好,未出现疼痛。
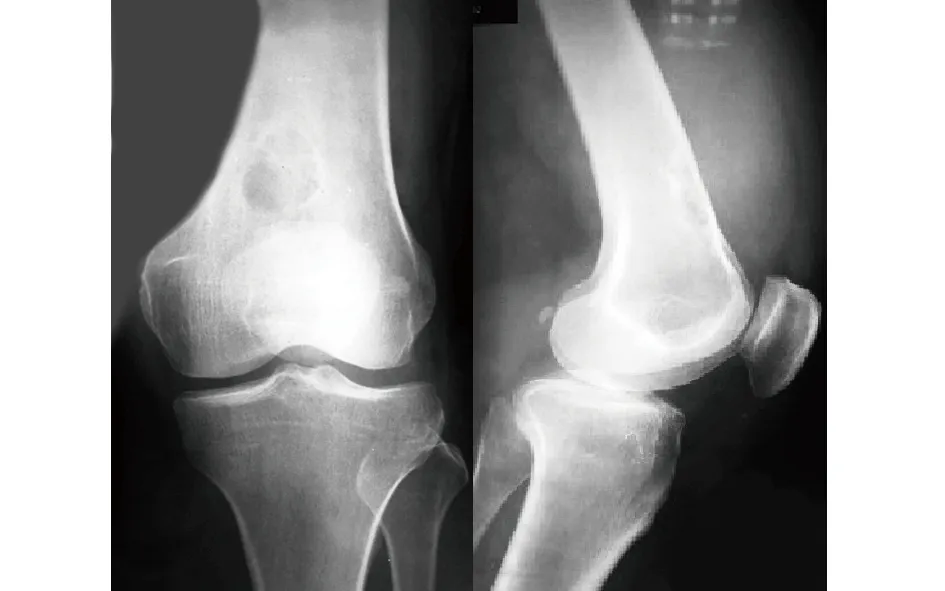
图1 术前X线片示左股骨下段近关节处见一囊状透光区,边缘较光整,其内可见骨嵴
图2 术前MRI示左股骨下段髓腔内病变呈T1WI低信号,T2WI/FS中高信号,骨皮质旁可见囊实性肿块影,相邻骨髓腔内也可见以长T1长T2信号为主的异常信号影
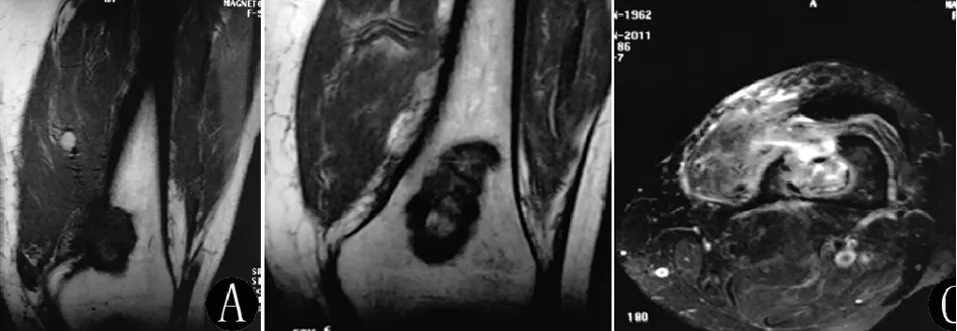
图3 术后MRI示左大腿下段内侧滑膜肉瘤术后改变
2014年患者再次出现原病灶部位疼痛,逐渐加重并需要拄拐。2015年9月行股骨X线片及MRI示,左股骨下段可见局限性低密度影,骨皮质不连续,伴塌陷,可见骨膜反应,左股骨下段病理性骨折,考虑肿瘤复发可能性大。患者在当地住院治疗效果欠佳,遂转入我院。入院后申请原病理切片于我院病理科会诊示:左股骨滑膜肉瘤,免疫组化BCL-1(-)、CD163(-)、CD68(灶+)、CD199(-)、CK(+)、Vimentin(+)、Desmin(-)、SMA(-)、Ki67 1%。申请肿瘤医院病理科会诊:(左股骨下段软组织)弥漫性腱鞘巨细胞瘤,侵犯骨组织。IHC示:CD68(-)、CK19(灶+)、CK8/18(灶+)、EMA(+)、S100(-)、P63(-)、demin(-)、calponin(-)、CD30(-)、Ki67 1%。为进一步明确诊断及制定治疗方案,于2015年9月在我院CT定位下行左股骨下段病灶穿刺活检。病检提示:送检物为死骨及变性之纤维结缔组织,故申请我院放化疗科与病理科会诊:建议先行手术治疗,待大体标本病检确诊后,可考虑行放疗。经过多学科讨论建议患者行切开活检,明确病理诊断,患者拒绝。出院后未行诊疗,疼痛性质如前,拄拐伴跛行。2015年12月患者因疼痛难忍,再次来我院就诊,复查X线片及MRI示左股骨下段病变较3个月前无明显变化(见图4~5)。入院后查体:左侧股骨下段压痛明显,无反跳痛,内侧可见一手术切口瘢痕约10 cm,已愈合,右侧肢体肌力Ⅴ级,左侧大腿肌力Ⅴ级,小腿肌力Ⅲ级,左下肢内翻畸形,足背动脉可触及,末梢感觉及循环可,生理反射存在,未引出病理反射。
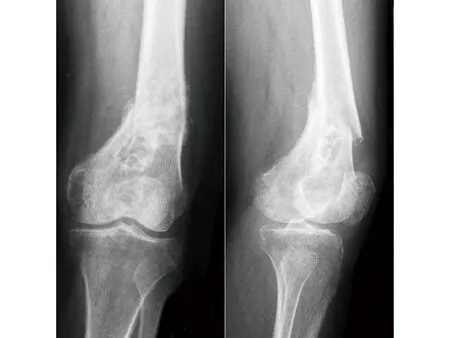
图4 X线片示左股骨下段可见局限性低密度影,骨皮质不连续,伴塌陷,可见骨膜反应
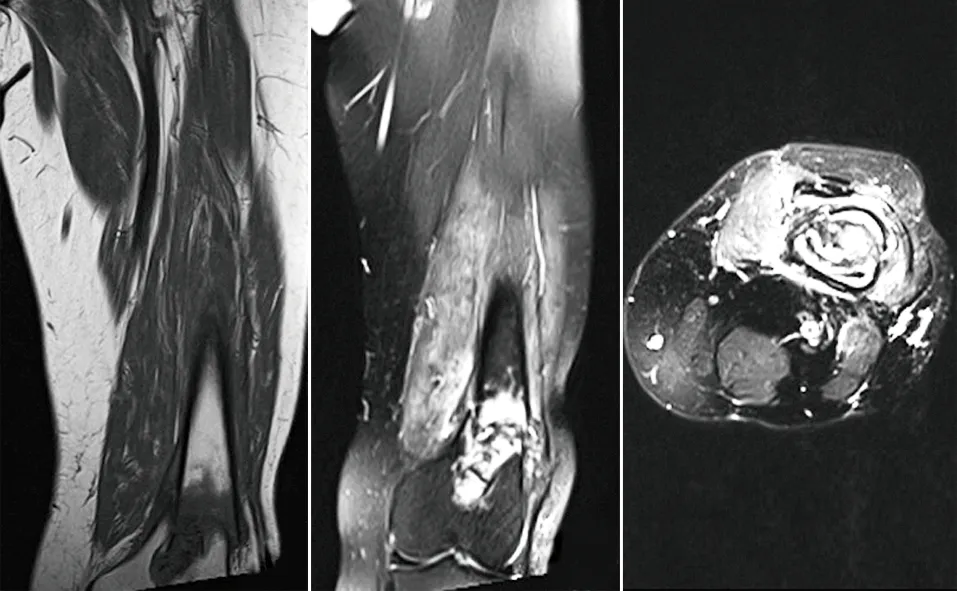
图5 MRI示股骨下段内可见T1WI低信号,T2WI混杂高信号,局部骨皮质断裂,周围软组织肿胀,呈不均匀高信号,累及骨髓腔,较前无明显变化
2016年1月,患者在静吸全麻下行“左股骨下段病灶切除术+自体双腓骨移植+双钢板支撑股骨重建术”(见图6),术中未见明显肿瘤组织,病变外观呈砂砾样,伴大量炎性坏死物。术后病检示:不规则死骨伴反应性增生,周围骨骼肌及纤维结缔组织呈慢性炎性改变,申请外院病检:部分死骨伴软组织呈炎性反应(见图7)。术后未行相关放化疗,随访1年,患者功能恢复可,内固定物牢固,无断裂、松动及移位,未见肿瘤复发迹象(见图8~9)。
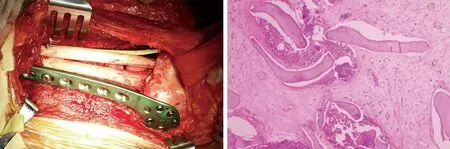
图6 术中大体照示取双侧腓骨支撑固定 图7 病理图显示无明显肿瘤组织
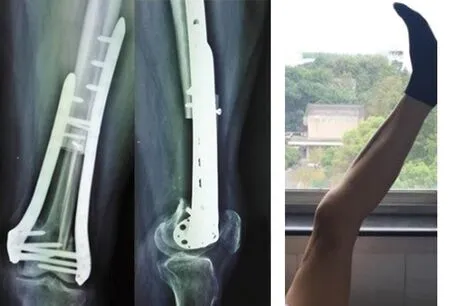
图8 术后1年X线片示内固定物固定牢靠,未见肿瘤复发迹象 图9 术后1年大体照示功能活动尚可
2 讨 论
放疗是恶性骨肿瘤的重要治疗手段之一,是不断提高肿瘤患者生存率的重要治疗措施。但是大剂量、不规范的放疗有导致肿瘤恶变及加重正常组织损伤的风险[1,5-6]。Bolek等[7]通过研究认为,骨折的发生率与放疗的分割剂量大小有很强的正相关性。放射性骨损伤是指在接受放疗后,辐射区肿瘤周围的正常骨组织出现骨萎缩或者骨丢失的现象。由于大部分癌症患者年纪较大,又或是绝经的女性,基础骨量偏低,因而容易导致病理性骨折[2]。此类患者早期缺乏特异性的诊断指标,通常无明确外伤史,临床表现呈渐进性加重,直到出现微骨折或脆性骨折,才来就诊。若病史、临床特征及X线片检查结果不典型,会给诊断和治疗带来一定困难,且手术创伤、放疗均会导致软组织及骨骼的结构形态发生改变,对影像学及病理学的诊断产生极大干扰,即使采用CT或MRI等影像学检查,也极易与肿瘤或肿瘤样病变相互混淆[1,8]。尤其是对于本例患者,既往存在恶性肿瘤及手术病史,当影像学上提示原手术部位出现病理性骨折,病变累及周围肌肉、骨骼时,容易误诊为恶性肿瘤复发,延误诊断及治疗。
充分了解放射性骨损伤的发病机制对于该病的诊断及鉴别起到了重要作用。目前,该病的发病机制仍存在争议[9]。由放射性骨损伤所导致的病理性骨折,其发病机制也尚不清楚。有文献表明骨组织受到电离辐射后,出现脱钙、细胞变性或坏死,从而造成骨质疏松有关;另一方面是由于电离辐射可导致骨的营养血管发生变化,骨在此基础上发生病理性骨折[10];Schmeler等[9]研究发现正常骨组织受到射线照射后,最短2.1个月即可出现放射性骨损伤。Hopewell等[11]指出放射治疗可以显著增加破骨细胞活性,并以此作为放疗后骨质丢失、骨量减少的主要原因。本例患者在第1次术后曾行30余次放疗(具体剂量不详),存在大剂量。不规范化放疗的可能,术后1年左右出现病理性骨折。而在考虑病史时极其容易忽视这一点,更偏重于手术及恶性肿瘤的病史,导致临床医生对病理性骨折主观臆断,存在思维偏差,忽视其他表现,是导致误诊的主要原因。恶性肿瘤的复发和放射性骨损伤是截然不同的两种疾病,前者提示病情加重,是一种危害严重、死亡率极高的恶性病变,后者为放疗导致的不良反应,倘若治疗不及时,仍存在截肢、致残的风险。两种疾病在治疗方式的选择及预后上也存在明显差异。虽然放射性骨损伤在临床上并不罕见,但其早期由于缺乏典型的特征性表现,临床医师对该病的认识不足,在诊治过程中很容易被误诊误治。
本例患者在早期被误诊为恶性肿瘤复发,综合原因较多,笔者总结了以下几点:a)缺乏对该病的全面认识,孤立地对待某一临床症状或医技检查,没有从整体上分析病情,从而忽视了其他表现。本例患者在外院第1次术后诊断为恶性骨肿瘤,且无论是滑膜肉瘤还是腱鞘巨细胞瘤,在首次手术切除过程中均存在切除不彻底的可能,且患者第1次术前未行穿刺病检,手术中很可能是按照良性肿瘤的囊内切除进行,切缘难以到达广泛的外科边界,虽然术后行放、化疗,但仍有局部复发的可能[12]。b)该病早期与恶性骨肿瘤的影像学表现或肿瘤样病变有相似之处。该患者在第1次来我院就诊时,X线片提示股骨下段出现病理性骨折,作者通过回顾文献发现,放射性骨损伤所导致的骨折往往是渐进性,病程较长,这是由于骨损伤与修复往往同时进行,当修复的程度不足以弥补损伤所带来的骨质破坏,骨小梁及骨密度下降时就会出现病理性骨折。骨折后可出现异常修复,导致邻近软组织钙化,这与软组织经放射损伤引起的纤维变性有关,是该病的特征性表现[13]。不同于恶性骨肿瘤导致的病理性骨折,肿瘤细胞由于快速增殖,生长常常侵犯骨皮质及周围软组织,导致骨折区广泛的溶骨性破坏,并可见软组织肿块,病情进展迅速,逐渐加重,短期内可导致重要的神经,血管受累。该患者前后两次入院相隔3个月,期间X线片、MRI均提示病变未见明显加重,这值得我们思考。该患者外院的影像学资料均考虑:肿瘤复发合并病理性骨折,病变处的骨骼及软组织呈肿瘤样改变,MRI上可见广泛明显的高信号带,这和肿瘤的出血、囊性变极为相似,病变在T1WI上呈现低信号,T2WI上呈混杂高信号,并可见软组织肿块,髓腔中也可见软组织受累并伴有明显强化。但是笔者分析后认为,患者在2011年术后曾行30余次放疗(剂量未知),放疗不仅对骨组织有损伤,对软组织(肌肉,血管等)也存在很大影响,可导致软组织的水肿-纤维化-坏死等结构改变。由于MRI对软组织的高分辨率和高灵敏度,因此,这些组织结构的改变对于MRI及CT的诊断均有着较大的干扰。Reginster等[5]通过研究认为,骨坏死早期的MRI表现为坏死区中央T1WI呈中等或略低信号,边缘区域为边界清楚的低信号带,T2WI上骨坏死的中央区域和相邻正常骨髓组织信号相近或略高,边缘为高信号带,病灶常为多发。而恶性骨肿瘤常常为单一病灶,T1WI为均匀、等或稍低信号,而在T2WI上呈现混杂或不均匀高信号。到了骨坏死的晚期,T1WI和T2WI在坏死的中央区和边缘均呈现低信号,常为不均质的低信号,这是骨硬化和钙化所致。除此之外骨髓水肿也是骨坏死的特异性表现,它代表骨坏死的早期MRI表现,分为局限性与弥漫性,前者表现为条索状或环形影,而恶性骨肿瘤的骨髓水肿常常累及范围较广,沿病变向四周侵犯[14]。c)手术创伤对影像学检查也存在一定的干扰。手术后组织修复产生的纤维瘢痕结构与正常人体组织的结构存在差异[1],术中曾植入同种异体骨修复骨缺损,但多项研究表明同种异体骨在人体内融合时间较长,且长期、大剂量的放疗可能会对同种异体骨的融合造成影响,甚至引起异体骨的变性、坏死等[4,8]。
手术、放疗、肿瘤复发、病理性骨折及异体植骨等因素相互影响,给该患者的诊治造成了极大干扰。本例患者在我院术后的病理标本经多次取材切片,外院会诊,均未见明显肿瘤组织,最终得以明确诊断。目前,对于放射性骨损伤,临床上尚无很好的预防及治疗方法[11,13]。但对于高剂量的放疗导致的骨质丢失,有必要采取一些措施,预防随之而来的骨质疏松,甚至病理性骨折。药物治疗中包括双膦酸盐、维生素D、降钙素和激素治疗等[5]。但是病理性骨折后的治疗方式,尚没有多中心、大样本的临床研究,有文献[3]报道放射性骨损伤导致的骨折治疗效果很差,骨不连或者骨折延迟愈合发生率高,严重损害患者的生活质量,死亡率及致残率大大增加。研究显示,有近20%放疗导致的髋部骨折患者将在骨折1年内死亡[11]。
综上所述,放射性骨损伤可严重影响肿瘤患者生活质量,早期诊断上容易和恶性肿瘤复发相混淆,临床上需要我们进一步研究该病的发病机制及影像学表现,加强对该病的全面认识,进行全面的影像学及病理学检查是防止误诊的关键。
[1]Strander H,Turesson I,Cavallin-St?倞hl E.A systematic overview of radiation therapy effects in soft tissue sarcomas[J].Acta Oncol,2003,42(5-6):516-531.
[2]Bentzen SM.Preventing or reducing late side effects of radiation therapy:radiobiology meets molecular pathology[J].Nat Rev Cancer,2006,6(9):702-713.
[3]Lane NE.Epidemiology,etiology,and diagnosis of osteoporosis[J].Am J Obstet Gynecol,2006,194(2 Suppl):S3-11.
[4]李建福,程天民.放射性骨损伤病理学改变的研究近况[J].中华放射医学与防护杂志,2000,20(3):77-80.
[5]Reginster JY,Neuprez A,Dardenne N,et al.Efficacy and safety of currently marketed anti-osteoporosis medications[J].Best Pract Res Clin Endocrinol Metab,2014,28(6):809-834.
[6]Baxter NN,Habermann EB,Tepper JE,et al.Risk of pelvic fractures in older women following pelvic irradiation[J].JAMA.2005,294(20):2587-2593.
[7]Bolek TW,Marcus RB Jr,Mendenhall NP,et al.Local control and functional results after twice-daily radiotherapy for Ewing's sarcoma of the extremities[J].Int J Radiat Oncol Biol Phys,1996,35(4):687-692.
[8]Aoki M,Sato M,Hirose K,et al.Radiation-induced rib fracture after stereotactic body radiotherapy with a total dose of 54~56 Gy given in 9~7 fractions for patients with peripheral lung tumor:impact of maximum dose and fraction size[J].Radiat Oncol,2015,10(1):99.
[9]Schmeler KM,Jhingran A,Iyer RB,et al.Pelvic fractures after radiotherapy for cervical cancer:implications for survivors[J].Cancer,2010,116(3):625-630.
[10]Emami B,Lyman J,Brown A,et al.Tolerance of normal tissue to therapeutic irradiation[J].Int J Radiat Oncol Biol Phys,1991,21(1):109-122.
[11]Hopewell JW,J Nyman,I Turesson I.Time factor for acute tissue reactions following fractionated irradiation:a balance between repopulation and enhanced radiosensitivity[J].Int J Radiat Biol,2003,79(7):513-524.
[12]王臻,王佳玉,徐海荣,等.肢体软组织肉瘤临床诊疗专家共识的解读[J].临床肿瘤学杂志,2014,22(7):637-648.
[13]Nicholls F,Janic K,Filomeno P,et al.Effects of radiation and surgery on healing of femoral fractures in a rat model[J].J Orthop Res,2013,31(8):1323-1331.
[14]张雪哲.骨坏死的影像学表现[J].中华放射学杂志,2006,40(5):451-454.
[15]张荣国.骨坏死45例的磁共振诊断及分析[J].转化医学电子杂志,2015,2(5):68-69.

