食用/工业明胶的凝胶及LF-NMR弛豫特性的比较
王 欣,郭 琦,黄远芬,谷桂英,刘宝林
(上海理工大学 医疗器械与食品学院,上海 200093)
明胶按其用途可分为药用明胶、食用明胶、工业明胶与照相明胶,其中药用明胶与食用明胶具有严格的国家或行业标准。2012年“毒胶囊”与“皮革酸奶”事件引起了人们对于食品及胶囊中所添加的明胶质量的关注。工业与食用明胶在品质及安全性上存在较大差异,工业明胶的原材料来源多为经过鞣制的皮革下脚料,其中含有重金属的鞣制剂及其他杂质会对人体健康造成危害[1]。
但若依照现有标准中反映明胶品质的重要指标(凝冻强度、黏度)进行判别,则会发现,QB/T 1995-2005《工业明胶》中规定明胶(12.5%)的凝冻强度≥200 g,黏度≥6 mPa·s,GB 6783-2015《食用明胶》中规定明胶(6.67%)的凝冻强度≥50 g,对黏度则无要求,标准之间存在一定的模糊性,难以有效鉴别明胶的品质。尽管目前主要通过石墨炉原子吸收光谱法[2]、电感耦合等离子体质谱法[3]、激光诱导击穿光谱法[4]检测明胶样品中的铬含量是否超标来判断明胶品质。但仅通过测定铬含量很难准确鉴别食品体系中是否添加工业明胶,尤其是不法企业若将工业明胶与食用明胶搀兑使用,其铬含量则可能满足国标(2 mg/kg) 要求。因此,卫生部发布的《食品中可能添加的非食用物质和易滥用的食品添加剂名单》上缺少工业明胶的检测方法[5]。说明仍有必要对能够反映食用和工业明胶品质差异的特性进行比较研究,从而为保证食用明胶安全提供新的方法。
低场核磁共振技术(Low-field nuclear magnetic resonance,LF-NMR)可以表征生物大分子系统内水分子的状态、流动性和分布[6]。黄远芬等[7]研究发现,LF-NMR技术可以有效反映明胶-蔗糖/NaCl凝胶体系中水分状态及其比例的变化,且弛豫特性与凝冻强度间有良好的相关性。Hansen等[8]比较了不同淀粉胶体的LF-NMR弛豫特性,发现淀粉种类不同、改性程度不同,其LF-NMR弛豫图谱有所区别,伴随峰宽度及弛豫时间的改变。
考虑到由皮革下脚料所生产的工业明胶的螺旋结构、分子量分布及蛋白质链的尺寸均与食用明胶有所区别,因此,在胶凝过程中,其中的水分状态及分布可能与食用明胶也不同。本研究在比较食品和工业明胶的黏度、凝冻强度及LF-NMR弛豫特性的基础上,进一步分析了工业明胶搀兑比例对食用明胶相关特性的影响;分析了添加不同浓度的蔗糖或NaCl对食品/工业或二者混合物相关特性的影响。研究可为采用LF-NMR技术鉴别明胶品质提供一定的理论指导作用。
1 实验部分
1.1 材料与仪器
食用明胶(B型骨胶):罗赛洛明胶有限公司;工业明胶(B型):杭州骏马磨具五金商行;蔗糖、NaCl(均为分析纯)购于上海国药化学试剂有限公司;实验用水为去离子水(自制)。
低场核磁共振分析仪(LF-NMR):PQ-001型,氢谱,磁场强度(0.5±0.08) T,质子共振频率23 MHz,上海纽迈电子科技有限公司;质构分析仪:TA. XT Plus型,英国SMS公司;数显旋转粘度计:NDJ-5S型,上海昌吉地质仪器有限公司;恒温水浴锅:HH·S21型,上海博讯实业有限公司。
1.2 实验方法
1.2.1样品的配制按表1中各处理条件的要求,称取一定量的明胶至相应的溶剂中,在室温下放置1~2 h,充分溶胀后,60 ℃水浴搅拌,形成一定浓度、均匀的明胶溶液后,室温下过夜,备用。
明胶溶液浓度是指体系的总浓度,工业明胶的掺入以质量分数计,为10%~100%;研究蔗糖和NaCl对明胶体系的影响时,混合明胶是指食用/工业明胶(质量比60∶40)。

表1 不同明胶溶液的配制Table 1 Preparation of different gelatin solutions
1.2.2检测方法黏度:取400 mL待测溶液恒温至35 ℃后,采用旋转粘度计测量其黏度。
凝冻强度:移取120 mL待测溶液至冻力瓶中,4 ℃冰箱放置12 h,充分凝胶后,采用质构仪测量凝冻强度。具体参数如下:探头P/0.5,测试前速度1.50 mm/s,触发力10 g,测试速度1.00 mm/s,测试距离20.00 mm,返回速度10.00 mm/s。
LF-NMR弛豫特性:准确移取3 mL明胶溶液于直径为15 mm的核磁共振专用试管中,置于4 ℃下保持12 h后,在以下参数条件下采样:CPMG 脉冲序列,重复采样等待时间(TR)=6 000 ms,重复扫描次数(NS)=4次,谱宽(SW)=250 kHz,半回波时间(τ)=500 μs,回波个数(EchoCount)=15 000个,采样点数(TD)=3 750 126。
应用T-invfit软件对采样得到的CPMG指数衰减曲线进行反演拟合,得到明胶凝胶体系的多组分弛豫图谱,并获知各弛豫峰的弛豫时间(按出峰时间从小到大命名为T21、T22、…、T2i等)及其相应的峰面积百分比(S21、S22、…、S2i等)。将样品看作一个整体组分分析时,可反演得到样品的单组分弛豫时间(T2w,ms)。
1.3 数据处理
每个样品重复检测3次,应用SPSS 18.0软件对数据进行显著性差异分析,以P<0.05(差异显著)作为差异显著性判断标准,应用Origin 8.0软件绘图。
2 结果与讨论
2.1 食用/工业明胶体系的凝胶特性与LF-NMR弛豫特性
2.1.1凝胶特性明胶的浓度、分子量分布及蛋白质链的尺寸是影响明胶凝胶特性的重要因素[9]。考察了食用/工业明胶体系的黏度和凝冻强度随明胶浓度的变化,结果显示,随明胶浓度的增加,食用/工业明胶体系的黏度均呈二项式增大趋势(r2>0.96),凝冻强度均呈线性增大趋势(r2>0.96)。这是由于,明胶的亲水基团可与水分子相互作用形成氢键,随着明胶浓度的增加,体系中氢键的数目增多,使明胶分子间相互作用及明胶水合作用增强,促进了明胶的凝胶化,凝冻强度增大;同时,体系的流动性整体降低,黏度随之增大,这与安广杰等[10]的研究结果相符。另一方面,与食用明胶相比,由于工业明胶是由皮革下脚料所生产,其原料、提取过程的区别使其分子量分布及蛋白质链的尺寸均与食用明胶有所不同,加之含有杂质相对较多,使其凝冻强度和黏度较低,且浓度越高,两体系的区分越大。

图1 食用/工业明胶体系的LF-NMR多组分弛豫图谱Fig.1 LF-NMR multi-component relaxation map of edible/industrial gelatin systemedible gelatin system(EG),industrial gelatin system(IG)
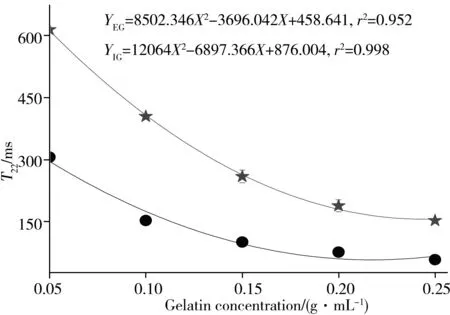
2.1.2LF-NMR弛豫特性食用/工业明胶体系的部分多组分弛豫图谱如图1所示。由图1可知,水仅在1 873.82 ms处产生1个峰,而食用/工业明胶体系产生了2~3个弛豫峰,依弛豫时间分别命名为T2b、T21和T22峰。T2b峰反映了明胶肽链上不可交换的氢质子的核磁响应[11],其信号较弱,重现性较差,且与明胶浓度间无规律性变化。T21峰与T22峰稳定存在,食用明胶的T21峰在3.00~15.24 ms之间,T22在57.22~305.39 ms之间,工业明胶的T21峰则位于14.18~29.38 ms,T22位于152.99~613.59 ms之间,一般认为,弛豫时间较短的T21峰反映的是与明胶肽链上亲水基团通过氢键紧密结合的“结合水”,而弛豫时间较长的T22峰则反映了与明胶相互作用较弱的“自由水”[7]。进一步分析食用/工业明胶体系的多组分弛豫特性随浓度的变化。结果如图2所示。
由图2可知,随明胶浓度的增加,两明胶体系的T21、T22均呈二项式缩短趋势(r2>0.99),S21线性增大(r2>0.97),而S22线性降低(r2>0.99)。这说明随明胶浓度的增加,明胶的水合作用及明胶分子之间的相互作用增强,水分子中的氢质子所受束缚增强,水分的流动性降低,弛豫时间(T21、T22)均相对缩短,结合水比例(S21)增大,而自由水比例(S22)减小。
与食用明胶相比,工业明胶具有相对较大的弛豫时间(T21、T22),说明整体而言,工业明胶对氢质子的束缚相对较弱。但比较各峰的峰面积比例可以发现,工业明胶的S21相对较高,而S22相对较低。这可能是由于工业明胶的蛋白质链尺寸较小,且存在有较多数量的小分子量组分,使得更多的亲水基团(如羧基、氨基等)暴露出来并与水结合,因而使反映结合水比例的S21相对增大,而自由水比例(S22)相对较小。
2.2 混合明胶体系的凝胶特性与LF-NMR弛豫特性
2.2.1凝胶特性混合明胶体系的黏度与凝冻强度的变化如图3所示。
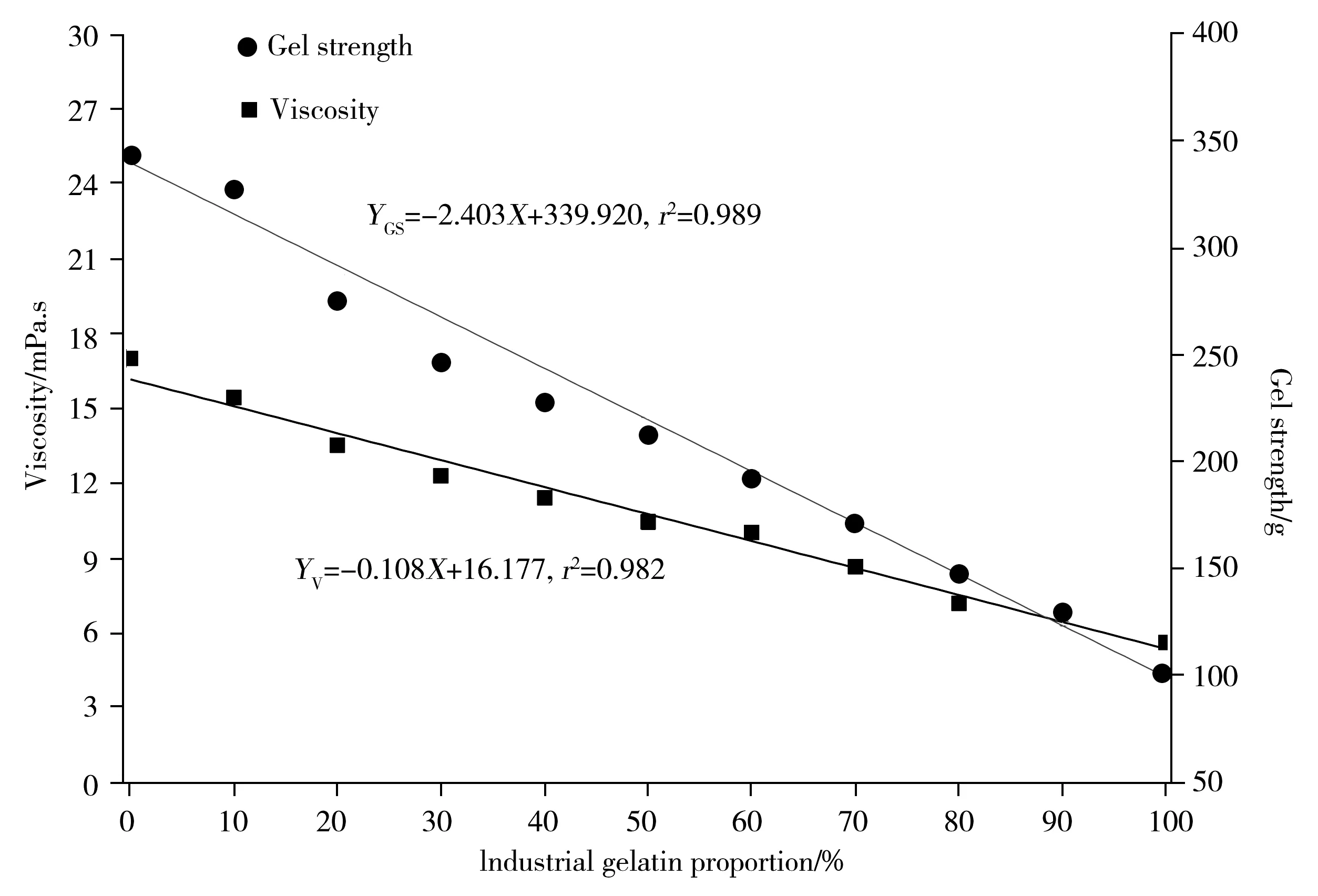
图3 混合明胶体系的黏度与凝冻强度随工业明胶含量的变化Fig.3 Changes in viscosity and gel strength of edible/industrial gelatin with gel concentrations
由“2.1.1”可知,工业明胶的凝冻强度与黏度均相对较低,图3显示,当掺入10%的工业明胶时,食用明胶体系的黏度及凝冻强度均显著降低(P<0.05),且随掺杂量的增加,体系的黏度和凝冻强度均呈线性降低(r2>0.98),说明可以借助黏度和凝冻强度随工业明胶比例增加而减小的规律来区分明胶品质。
2.2.2LF-NMR弛豫特性混合明胶体系的弛豫特性随工业明胶含量的变化如图4所示。由前文可知,工业明胶体系的弛豫时间相对较大,图4表明,对混合明胶体系而言,随工业明胶含量的增加,体系的弛豫时间(T21、T22)、结合水比例(S21)均呈良好的线性增加趋势(r2>0.98),而自由水比例(S22)呈线性降低趋势(r2=0.97)。以上结果表明,随着工业明胶掺兑比例的增加,混合体系的LF-NMR弛豫特性(T21、T22、S21、S22)呈一定规律的变化,且与黏度和凝冻强度的测定过程不同,LF-NMR分析具有无损、快速的优势,为快速确定明胶体系中工业明胶搀兑比例提供了新的可能途径。

2.3 蔗糖对不同明胶体系的凝胶特性与LF-NMR弛豫特性的影响
2.3.1凝胶特性凝胶体系的凝胶特性不仅与胶体种类及浓度有关,其它组分的添加也会影响其凝胶特性。添加蔗糖对食用、工业及混合明胶体系的黏度与凝冻强度的影响如图5所示。
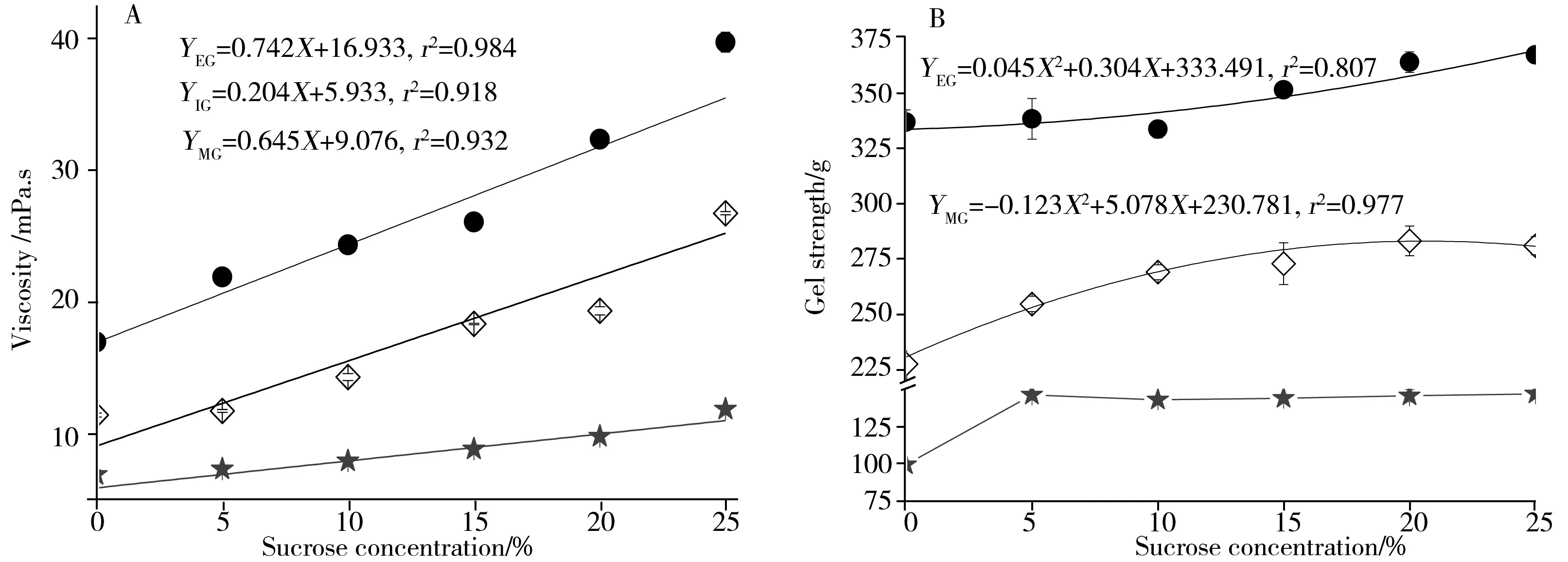
图5 不同明胶体系的黏度(A)与凝冻强度(B)随蔗糖质量分数的变化Fig.5 Changes of viscosity(A) and gel strength(B) of different gelatin systems with sucrose concentrationedible gelatin system(EG);industrial gelatin system(IG);mixed gelatin system(MG)
由图5可知,整体而言,食用明胶体系的黏度、凝冻强度相对较大,混合明胶体系次之,而工业明胶体系最小。由图5A可知,随蔗糖质量分数的增加,各明胶体系的黏度均线性增大(r2>0.91);由图5B可知,食用明胶与混合明胶(质量比:食用∶工业=60∶40)体系的凝冻强度均随蔗糖质量分数的增加而呈二项式增大趋势(r2>0.80),而对工业明胶体系而言,添加5%蔗糖时,体系的凝冻强度相对增大,而当蔗糖质量分数>5%时,体系的凝冻强度则基本不变(P>0.05)。这是由于:一方面,蔗糖浓度的增加增大了溶液的黏度[12],同时蔗糖的加入能够促进明胶肽链与水的相互作用,削弱明胶体系的流动性,促进明胶的凝胶化,使体系黏度呈增大趋势,增强凝胶体系的刚性。对工业明胶体系而言,其肽链上的大多数亲水基团已与水分子“结合”,因此蔗糖的添加对工业明胶水合作用的促进作用并不明显,因而对凝冻强度的影响较小。
2.3.2LF-NMR弛豫特性不同明胶体系的弛豫特性随蔗糖质量分数的变化如图6所示。由图6可知,工业明胶体系的结合水弛豫时间(T21)相对较大,且T21随蔗糖浓度的增大呈线性增加趋势(r2=0.93);对食用明胶和混合明胶体系而言,虽然与对照组相比,添加蔗糖后其T21显著缩短(P<0.05),但随蔗糖浓度变化不大;各明胶体系的自由水弛豫时间(T22)均随蔗糖浓度的增大而线性缩短(r2>0.92)。而各明胶体系的S21均呈二项式递增趋势(r2>0.88),S22则均呈二项式递减趋势(r2>0.83)。整体而言,无论从弛豫时间还是弛豫峰面积比例上进行比较,添加蔗糖后,各系列间仍有明显区别。


2.4 NaCl对不同明胶体系的凝冻强度与LF-NMR弛豫特性的影响

图7 不同明胶体系的凝冻强度随NaCl浓度的变化Fig.7 Changes of gel strength of different gelatin systems with NaCl concentration
2.4.1凝冻强度不同明胶体系的凝冻强度随NaCl浓度的变化如图7所示。 由图7可知,食用明胶的凝冻强度最大,混合明胶次之,工业明胶最小;随NaCl浓度的增加,食用明胶体系的凝冻强度呈二项式降低趋势,工业/混合明胶体系的凝冻强度则呈线性降低趋势。这是因为,NaCl的引入中和了蛋白质表面所带电荷,改变了体系的静电作用力,不利于明胶的胶凝作用[13],因此随NaCl浓度的升高,明胶凝胶的刚性减弱,凝冻强度减小。
2.4.2弛豫特性各体系的弛豫特性随NaCl浓度的变化如图8所示。由图8可知,工业明胶体系的弛豫时间(T21、T22)仍相对较大,且具有较大的S21及较小的S22,NaCl浓度对3种明胶体系的结合水弛豫时间(T21)与自由水弛豫时间(T22)的影响规律性较小,但与对照组相比,各浓度下的T21、T22均相对延长,结合水比例(S21)呈增大趋势,而自由水比例(S22)分别呈线性或二项式递减趋势(r2>0.78)。蛋白质凝胶的形成与维持是体系中各种吸引力与排斥力达到平衡的结果[14]。NaCl的引入不利于明胶的胶凝作用,使明胶胶体的刚性降低,凝胶中水分子的流动性增强,水分子的氢质子所受束缚力降低,因此表现为T21与T22相对延长。同时,由于NaCl中和了明胶表面的电荷,使明胶分子链展开[15],导致更多的亲水基团暴露出来,并与水结合,因此结合水比例(S21)仍相对增加,而S22相对减少。



3 结 论
本文主要研究了不同品质、浓度、混合比例及蔗糖或NaCl浓度对明胶凝胶体系黏度、凝冻强度及LF-NMR弛豫特性的影响规律。结果表明,与食用明胶相对比,工业明胶的凝冻强度与黏度均相对较低,弛豫时间(T21、T22)相对较长,S21相对较高,而S22相对较低。随明胶浓度的增加,体系的黏度、凝胶强度均呈二项式增大趋势。食用/工业明胶体系的T21、T22均呈二项式缩短趋势,S21线性增大,S22线性减小。随工业明胶含量的增加,混合明胶体系的黏度与凝冻强度均线性减小,体系的T21、T22均线性增大,S21线性增大,S22线性减小。随蔗糖浓度的增加,各明胶体系的黏度均线性增大,食用与混合明胶体系的凝冻强度呈二项式增大趋势,而工业明胶体系变化较小;工业明胶体系的T21相对增大,而食用/混合明胶体系的T21虽在添加蔗糖后显著缩短,但随蔗糖浓度的变化不大;各体系的T22均线性缩短,S21均呈二项式增大,S22均呈二项式减小趋势。随NaCl浓度的增加,各明胶体系的凝冻强度均呈降低趋势。添加NaCl使各体系的T21、T22均相对增大,S21增大,而S22减小,但随NaCl浓度的变化均较小。
[1] Kirman C R,Aylward L L,Suh M,Harris M A,Thompson C M,Haws L C,Proctor D M,Lin S S,Parker W,Hays S M.Chem.-Biol.Interact.,2013,204(1):13-27.
[2] Quinaia S P,Nobrega J A.FoodChem.,1999,64(3):429-433.
[3] Ge J H,Xu J H.J.ChinaPharm.(葛建华,徐继华.中国药业),2014,23(21):45-46.
[4] Zhang Y,Zhang D C,Ma X W,Pan D,Zhao D M.ActaPhys.Sin.(张颖,张大成,马新文,潘冬,赵冬梅.物理学报),2014,63(14):231-235.
[5] Zhao L Y,Che S D,He Y K,Li C C,Zhu X Y,Yuan Q X,Zeng F H.TheScienceandTechnologyofGelatin(赵龙岩,车寿德,何银开,李春橙,朱小亚,袁清霞,曾富华.明胶科学与技术),2012,32(3):131-132.
[6] Liu J J.StudyonFunctionalPropertiesandPhaseBehaviorofEggWhiteProtein/KonjacGlucomannanCompositeSystem.Wuhan:Huazhong Agricultural University( 刘金金.蛋清蛋白/魔芋胶复合体系功能特性及相行为研究.武汉:华中农业大学),2013.
[7] Huang Y F,Wang X,Liu B L.Mod.FoodSci.Technol.(黄远芬,王欣,刘宝林.现代食品科技),2015,31(10):45-52.
[8] Hansen M R,Blennow A,Farhat I A,Norgaard L,Pedersen S,Engelsen S B.FoodHydrocoll,2009,23:2038-2048.
[9] Huang B C,Li C X.Sci.Technol.Gelatin(黄壁成,李承献.明胶科学与技术),2013,33(3):139-142.
[10] An G J,Wang Z.FoodSci.(安广杰,王璋.食品科学),2007,28(7):68-72.
[11] Chiotelli E,Pilosio G,Meste M L.Biopolymers,2002,63(1):41-58.
[12] Galmarini M V,Baeza R,Sanchez V,Zamora M C,Chirife J.LWT-FoodSci.Technol.,2011,44(1):186-190.
[13] Choi S S,Regenstein J M.J.FoodSci.,2000,65(2):194-199.
[14] Kan J Q,Duan Y F,Jiang F T.FoodChemistry.Beijing:China Agricultural University Press(阚建全,段玉峰,姜发堂.食品化学.北京:中国农业大学出版社),2009.
[15] Kaewruang P,Benjakul S,Prodpran T,EncarnacionA B,Nalinanon S.LWT-FoodSci.Technol.,2014,55(2):477-482.

